名校
1 . 铜及其化合物在工业生产上有许多用途。某工厂以辉铜矿(主要成分为 Cu2S,含少量 Fe2O3、SiO2等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下:

已知:
①常温下几种物质开始形成沉淀与完全沉淀时的pH如下表
②Ksp[Fe(OH)3]=4.0×10-38
(1)加快“浸取”速率,除将辉铜矿粉碎外,还可采取的措施有____ (任写一种)。
(2)滤渣I中的主要成分是MnO2、S、SiO2,请写出“浸取”反应中生成S的化学方程式:____ 。
(3)常温下“除铁”时加入的试剂A可用CuO等,调节pH调的范围为____ ,若加 A 后溶液的 pH调为5,则溶液中 Fe3+的浓度为____ mol/L。
(4)写出“沉锰”(除 Mn2+)过程中反应的离子方程式:____ 。
(5)“赶氨”时,最适宜的操作方法是____ 。
(6)滤液Ⅱ经蒸发结晶得到的盐主要是____ (写化学式)。
(7)过滤Ⅱ得到的沉淀经过洗涤、干燥可以得到碱式碳酸铜,判断沉淀是否洗净的操作是____ 。

已知:
①常温下几种物质开始形成沉淀与完全沉淀时的pH如下表
| 金属离子 | Fe2+ | Fe3+ | Cu2+ | Mn2+ |
| 开始沉淀 | 7.5 | 2.7 | 5.6 | 8.3 |
| 完全沉淀 | 9.0 | 3.7 | 6.7 | 9.8 |
②Ksp[Fe(OH)3]=4.0×10-38
(1)加快“浸取”速率,除将辉铜矿粉碎外,还可采取的措施有
(2)滤渣I中的主要成分是MnO2、S、SiO2,请写出“浸取”反应中生成S的化学方程式:
(3)常温下“除铁”时加入的试剂A可用CuO等,调节pH调的范围为
(4)写出“沉锰”(除 Mn2+)过程中反应的离子方程式:
(5)“赶氨”时,最适宜的操作方法是
(6)滤液Ⅱ经蒸发结晶得到的盐主要是
(7)过滤Ⅱ得到的沉淀经过洗涤、干燥可以得到碱式碳酸铜,判断沉淀是否洗净的操作是
您最近一年使用:0次
2019-11-13更新
|
764次组卷
|
5卷引用:广西壮族自治区玉林市2021届高三上学期11月教学质量监测理科综合化学试题
解题方法
2 . 工业上利用氧化铝基废催化剂(主要成分为Al2O3,还含有少量Pd)回收Al2(SO4)3及Pd的流程如下:
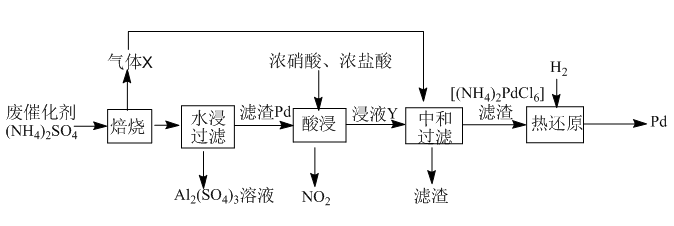
(1)Al2(SO4)3溶液蒸干灼烧后所得物质的化学名称是___________ 。
(2)焙烧时Al2O3与(NH4)2SO4反应的化学方程式为___________ 。
水浸与中和步骤得到溶液的操作方法是___________ 。
(3)浸液Y中含Pd元素的溶质是___________ (填化学式)。
(4)“热还原”中每生成1molPd生成的气体的物质的量为___________ (已知热还原得到的固体只有Pd)。
(5)Pd是优良的储氢金属,其储氢原理为2Pd(s)+xH2(g)==2PdHx(s),其中x的最大值为0.8。已知: Pd的密度为12g·cm-3, 则10.6cm3Pd能储存标准状况下H2的最大体积为___________ L。
(6)铝的阳极氧化法是将铝作为阳极,置于硫酸等电解液中,加入α-羟基丙酸、丙三醇后进行电解,可观察到铝的表面会形成一层致密的氧化膜。
①写出电解时阳极的电极反应式:______________________ 。
②电解过程中α-羟基丙酸、丙三醇的作用可能是______________________ 。

(1)Al2(SO4)3溶液蒸干灼烧后所得物质的化学名称是
(2)焙烧时Al2O3与(NH4)2SO4反应的化学方程式为
水浸与中和步骤得到溶液的操作方法是
(3)浸液Y中含Pd元素的溶质是
(4)“热还原”中每生成1molPd生成的气体的物质的量为
(5)Pd是优良的储氢金属,其储氢原理为2Pd(s)+xH2(g)==2PdHx(s),其中x的最大值为0.8。已知: Pd的密度为12g·cm-3, 则10.6cm3Pd能储存标准状况下H2的最大体积为
(6)铝的阳极氧化法是将铝作为阳极,置于硫酸等电解液中,加入α-羟基丙酸、丙三醇后进行电解,可观察到铝的表面会形成一层致密的氧化膜。
①写出电解时阳极的电极反应式:
②电解过程中α-羟基丙酸、丙三醇的作用可能是
您最近一年使用:0次
2019-04-01更新
|
1282次组卷
|
3卷引用:【市级联考】广西壮族自治区南宁市普通高中2019届高三毕业班第一次适应测试理综化学试题
解题方法
3 . 甲酸钙广泛用于食品、化工、石油等工业生产上,在300~400℃左右分解。
Ⅰ.实验室制取甲酸钙的方法之一是Ca(OH)2+2HCHO+H2O2=Ca(HCOO)2+2H2O+H2。实验室制取时,将工业氢氧化钙(含铜离子等杂质)和甲醛依次加入质量分数为30%~70%的过氧化氢溶液中(投料时工业氢氧化钙、甲醛、过氧化氢的物质的量之比为1: 2: 1.2),最终可得到质量分数大于98%且重金属含量极低的优质产品。
(1)铜离子对该实验的影响是________________________________________ 。
(2)甲酸钙的分解产物为_______________________________ 。
(3)制备时,在混合溶液中除了要加入微量硼酸钠抑制甲醛发生副反应外,还要加入少量的Na2S溶液。加硫化钠的目的之一是除去重金属离子,其反应的离子方程式为_________________________________ 。
(4)实验时需强力搅拌45min,其目的是__________________________________ 。
(5)取ag优质产品[杂质只有Ca(OH)2]溶于水,加入bgNa2CO3(过量),得到cg沉淀,则产品中甲酸钙的百分含量为__________________ (列出计算式即可)。
Ⅱ.某研究性学习小组以工业碳酸钙(主要成分为CaCO3,杂质为Al2O3、FeCO3)为原料,先制备无机钙盐,再与甲酸钠溶液混合制取甲酸钙。结合图中几种物质的溶解度曲线及表中相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol·L-1计算),现提供的试剂有:
a.甲酸钠 b.5mol·L-1的硝酸 c.澄清石灰水
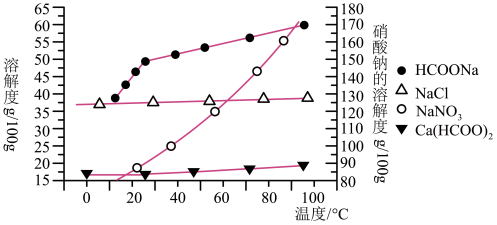
请补充完整由碳酸钙制备甲酸钙的实验步骤:
步骤1:称取13.6g甲酸钠溶于约20mL水中,配成溶液待用,并称取研细的碳酸钙样品10g待用。
步骤2:_____________________________________________________________ 。
步骤3:____________________________________________________________________ 。
步骤4:过滤后,将滤液与甲酸钠溶液混合,调整溶液pH为7~8,充分搅拌,所得溶液经____________ 、趁热过滤、洗涤、干燥得甲酸钙晶体。
Ⅰ.实验室制取甲酸钙的方法之一是Ca(OH)2+2HCHO+H2O2=Ca(HCOO)2+2H2O+H2。实验室制取时,将工业氢氧化钙(含铜离子等杂质)和甲醛依次加入质量分数为30%~70%的过氧化氢溶液中(投料时工业氢氧化钙、甲醛、过氧化氢的物质的量之比为1: 2: 1.2),最终可得到质量分数大于98%且重金属含量极低的优质产品。
(1)铜离子对该实验的影响是
(2)甲酸钙的分解产物为
(3)制备时,在混合溶液中除了要加入微量硼酸钠抑制甲醛发生副反应外,还要加入少量的Na2S溶液。加硫化钠的目的之一是除去重金属离子,其反应的离子方程式为
(4)实验时需强力搅拌45min,其目的是
(5)取ag优质产品[杂质只有Ca(OH)2]溶于水,加入bgNa2CO3(过量),得到cg沉淀,则产品中甲酸钙的百分含量为
Ⅱ.某研究性学习小组以工业碳酸钙(主要成分为CaCO3,杂质为Al2O3、FeCO3)为原料,先制备无机钙盐,再与甲酸钠溶液混合制取甲酸钙。结合图中几种物质的溶解度曲线及表中相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol·L-1计算),现提供的试剂有:
a.甲酸钠 b.5mol·L-1的硝酸 c.澄清石灰水

请补充完整由碳酸钙制备甲酸钙的实验步骤:
步骤1:称取13.6g甲酸钠溶于约20mL水中,配成溶液待用,并称取研细的碳酸钙样品10g待用。
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
步骤3:
步骤4:过滤后,将滤液与甲酸钠溶液混合,调整溶液pH为7~8,充分搅拌,所得溶液经
您最近一年使用:0次
4 . 碳酸锰(MnCO3)是制造电信器材的软磁铁氧体,也用作脱硫的催化剂,瓷釉、涂料和清漆的颜料。工业上利用软锰矿(主要成分是MnO2,还含有Fe2O3、CaCO3、CuO等杂质)制取碳酸锰的流程如下图所示:
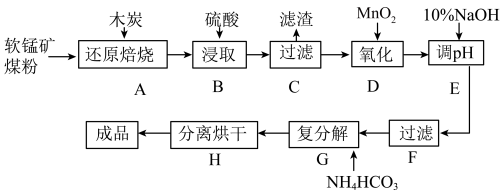
已知:还原焙烧主反应为2MnO2+C 2MnO+CO2↑。
2MnO+CO2↑。
可能用到的数据如下:
根据要求回答下列问题
(1)在实验室进行步骤A操作,需要用到的仪器名称为___________ 。
(2)步骤C中得到的滤渣主要成分是CaSO4和___________ ,步骤D中还原剂与氧化剂的物质的量之比为___________ 。
(3)步骤E中调节pH的范围为___________ ,其目的是______________________ 。
(4)步骤G发生的离子方程式为_________________________________ ,若Mn2+沉淀完全时测得溶液中CO32-的浓度为2.2×10-6mol/L,则Ksp(MnCO3)=___________ 。
(5)实验室可以用Na2S2O8溶液来检验Mn2+是否完全发生反应,原理为Mn2++S2O82-+H2O→H++SO42-+MnO4-,确认Mn2+离子已经完全反应的现象是___________ 。

已知:还原焙烧主反应为2MnO2+C
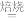 2MnO+CO2↑。
2MnO+CO2↑。可能用到的数据如下:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Mn(OH)2 |
| 开始沉淀pH | 1.5 | 6.5 | 4.2 | 8.3 |
| 沉淀完全pH | 3.7 | 9.7 | 7.4 | 9.8 |
(1)在实验室进行步骤A操作,需要用到的仪器名称为
(2)步骤C中得到的滤渣主要成分是CaSO4和
(3)步骤E中调节pH的范围为
(4)步骤G发生的离子方程式为
(5)实验室可以用Na2S2O8溶液来检验Mn2+是否完全发生反应,原理为Mn2++S2O82-+H2O→H++SO42-+MnO4-,确认Mn2+离子已经完全反应的现象是
您最近一年使用:0次
名校
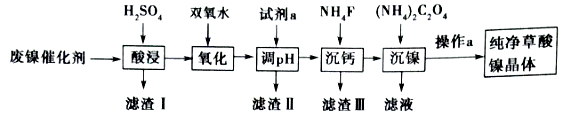
5 . 已知草酸镍晶体(NiC2O4·2H2O)难溶于水,工业上从废镍催化剂(主要成分为Ni,含有定量的Al2O3、FeO、SiO2、CaO等)制备草酸镍晶体的流程如图所示:
已知:①相关金属离子生成氢氧化物沉淀的pH见表中数据:

②2Ksp(CaF2)=1.46×10-10
③当某物质浓度小于1.0×10-5mol·L-1时,视为完全沉淀。
请回答下列问题:
(1)请写出一种能提高“酸浸”速率的措施:_________________________________ 。
(2)双氧水是一种绿色氧化剂,写出“氧化”时的离子反应方程式:______________________ 。
(3)试剂a“调pH”时pH的调控范围为___________ ,试剂a为___________ (填字母)
A .Fe(OH)3 B. Fe(OH)2 C.Al(OH)3 D. Ni(OH)2 E. NaOH
(4)写出“沉钙”时的离子反应方程式:_________________________________ 。当Ca2+沉淀完全时,溶液中c(F-)>___________ mol·L-1(写出计算式即可)。证明Ni2+已经沉淀完全的实验操作及现象是_________________________________ 。
(5)操作a的内容是_______________________________________________________ 。

已知:①相关金属离子生成氢氧化物沉淀的pH见表中数据:

②2Ksp(CaF2)=1.46×10-10
③当某物质浓度小于1.0×10-5mol·L-1时,视为完全沉淀。
请回答下列问题:
(1)请写出一种能提高“酸浸”速率的措施:
(2)双氧水是一种绿色氧化剂,写出“氧化”时的离子反应方程式:
(3)试剂a“调pH”时pH的调控范围为
A .Fe(OH)3 B. Fe(OH)2 C.Al(OH)3 D. Ni(OH)2 E. NaOH
(4)写出“沉钙”时的离子反应方程式:
(5)操作a的内容是
您最近一年使用:0次
2019-02-05更新
|
712次组卷
|
3卷引用:【市级联考】广西壮族自治区柳州市2019届高三上学期1月模拟考试理科综合化学试题
名校
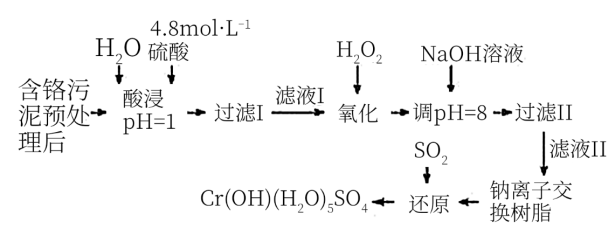
6 . 利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(Ⅲ)的处理工艺流程如下:
其中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(1)实验室用18.4 mol·L-1的浓硫酸配制240 mL 4.8 mol·L-1的硫酸,需量取浓硫酸__ mL;配制时所用玻璃仪器除量筒、烧杯和玻璃棒外,还需____________ 。
(2)酸浸时,为了提高浸取率可采取的措施有____________________ 。(答出两点)
(3)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O72-,写出此反应的离子方程式_________________ 。
(4)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
加入NaOH溶液使溶液呈碱性,Cr2O72-转化为CrO42-。滤液Ⅱ中阳离子主要有_______ ;但溶液的pH不能超过8,其理由是________________________ 。
(5)钠离子交换树脂的反应原理为Mn++nNaR→MRn+nNa+,利用钠离子交换树脂除去滤液Ⅱ中的金属阳离子是_____ 。
(6)写出上述流程中用SO2进行还原时发生反应的化学方程式:________________ 。
其中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(1)实验室用18.4 mol·L-1的浓硫酸配制240 mL 4.8 mol·L-1的硫酸,需量取浓硫酸
(2)酸浸时,为了提高浸取率可采取的措施有
(3)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O72-,写出此反应的离子方程式
(4)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
| 阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
| 开始沉淀时的ph | 2.7 | — | — | — |
| 沉淀完全时的ph | 3.7 | 11.1 | 5.4(>8溶解) | 9(>9溶解) |
(5)钠离子交换树脂的反应原理为Mn++nNaR→MRn+nNa+,利用钠离子交换树脂除去滤液Ⅱ中的金属阳离子是
(6)写出上述流程中用SO2进行还原时发生反应的化学方程式:
您最近一年使用:0次
2019-01-09更新
|
262次组卷
|
4卷引用:广西南宁市2017届高三第二次适应性考试化学试题
7 . 金属镁及其化合物在科学研究及生产中具有广泛的用途。
(1)镁能在氧气、空气、氮气或二氧化碳中燃烧。
①点燃条件下,单质镁能与CO2发生置换反应并产生大量的热,反应的化学方程式为_____________________________________________ 。
②在空气中燃烧会发出眼的自光,将燃烧产物X置于60℃的热水中并充分搅拌,最终得到白色固体,同时有能使湿润的红色石蕊试纸变蓝色的气体生成。则产物X中除MgO外,还肯定含有的物质是_________ (填化学式)。
(2)镁一过氧化氢电池具有能量高、安全方便等优点,可用于驱动无人驾驶的潜航器。某种镁一过氧化氢电池以海水为电解质溶液,其工作原理如右图所示(已知:氢氧化镁难溶于水)。

正极的电极反应式为___________________________ ,隔膜应选择_________ (填“阳”或“阴”)离子膜。
(3)轻质碳酸镁[MgCO3·Mg(OH)2·3H2O]在化工生产上有广泛的用途。以卤块(主要成分为MgCl2,含Fe2+、Fe3+等杂质离子)为原料制备它的工艺流程如下:

常温下,Fe3+、Fe2+、Mg2+生成氢氧化物沉淀时的pH:
[注:Fe(OH)2沉淀呈絮状,不易从溶液中除去]。
①写出一条能提高酸浸速率的措施:_______________________________________ 。
②“氧化”过程中,参加反应的氧化剂与还原剂的物质的量之比为__________________ 。
③加入NaOH溶液调节pH,通常控制pH在9.0左右,其目的是__________________ 。
④热解时,反应的离子方程式为____________________________________ 。
⑤操作I、Ⅱ均是将固体与液体分离,但在对分离后所得固体的操作上有明显差异,差异是_____________________________________________ 。
(1)镁能在氧气、空气、氮气或二氧化碳中燃烧。
①点燃条件下,单质镁能与CO2发生置换反应并产生大量的热,反应的化学方程式为
②在空气中燃烧会发出眼的自光,将燃烧产物X置于60℃的热水中并充分搅拌,最终得到白色固体,同时有能使湿润的红色石蕊试纸变蓝色的气体生成。则产物X中除MgO外,还肯定含有的物质是
(2)镁一过氧化氢电池具有能量高、安全方便等优点,可用于驱动无人驾驶的潜航器。某种镁一过氧化氢电池以海水为电解质溶液,其工作原理如右图所示(已知:氢氧化镁难溶于水)。

正极的电极反应式为
(3)轻质碳酸镁[MgCO3·Mg(OH)2·3H2O]在化工生产上有广泛的用途。以卤块(主要成分为MgCl2,含Fe2+、Fe3+等杂质离子)为原料制备它的工艺流程如下:

常温下,Fe3+、Fe2+、Mg2+生成氢氧化物沉淀时的pH:
| Fe3+ | Fe2+ | Mg2+ | |
| 开始沉淀时的pH | 2.7 | 7.6 | 9.9 |
| 完全沉淀时的pH | 3.7 | 9.6 | 11 |
[注:Fe(OH)2沉淀呈絮状,不易从溶液中除去]。
①写出一条能提高酸浸速率的措施:
②“氧化”过程中,参加反应的氧化剂与还原剂的物质的量之比为
③加入NaOH溶液调节pH,通常控制pH在9.0左右,其目的是
④热解时,反应的离子方程式为
⑤操作I、Ⅱ均是将固体与液体分离,但在对分离后所得固体的操作上有明显差异,差异是
您最近一年使用:0次
2019-01-01更新
|
411次组卷
|
2卷引用:【校级联考】广西壮族自治区名校2019届高三上学期联合调研(12月)考试理科综合化学试题
名校
解题方法
8 . 利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(III)的处理工艺流程如下:
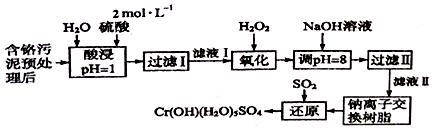
已知:
①硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
(1)酸浸时,为了提高浸取率可采取的措施有_________________ (写出两条)。
(2)过滤操作时所用玻璃仪器除烧杯外,还需要________________ 。
(3)H2O2的作用是将滤液I中的Cr3+转化为C2O72-,该反应的离子方程式为:____________________ 。
(4)加入NaOH溶液调节溶液pH=8,既可以使溶液中某些杂质离子转化为沉淀,同时又可以将Cr2O72-转化为________ (填微粒的化学式),当溶液的pH>8时,沉淀的主要成份为________ (填化学式)。
(5)钠离子交换树脂的反应原理为:Mn++nNaR=MRn+nNa+,则利用钠离子交换树脂可除去滤液Ⅱ中的金属阳离子有________________ ,交换后溶液中浓度明显增大的离子为________________ 。

已知:
①硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
| 阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
| 沉淀完全时的pH | 3.7 | 11.1 | 5.4(>8溶解) | 9(>9溶解) |
(1)酸浸时,为了提高浸取率可采取的措施有
(2)过滤操作时所用玻璃仪器除烧杯外,还需要
(3)H2O2的作用是将滤液I中的Cr3+转化为C2O72-,该反应的离子方程式为:
(4)加入NaOH溶液调节溶液pH=8,既可以使溶液中某些杂质离子转化为沉淀,同时又可以将Cr2O72-转化为
(5)钠离子交换树脂的反应原理为:Mn++nNaR=MRn+nNa+,则利用钠离子交换树脂可除去滤液Ⅱ中的金属阳离子有
您最近一年使用:0次
2018-04-14更新
|
296次组卷
|
2卷引用:【全国百强校】广西陆川县中学2018届高三下学期第二次质量检测理科综合化学试题
解题方法
9 . 回答下列问题:
(1)工业上用钛矿石(主要成分为FeTiO3,主要含FeO、Al2O3、SiO2等杂质)经过以下流程制得TiO2:

其中,步骤II发生的主要反应为:2H2SO4+ FeTiO3=TiOSO4+FeSO4+2H2O
①步骤I发生反应的离子方程式是:_____________ 、___________ 。为提高钛矿石的碱浸出速率,步骤I可采取的办法除提高碱的浓度外,还可以采取的办法有_________________ 、__________________________ (写出两种方法)。
②步骤II中加入Fe的目的是___________________ ;分离出FeSO4晶体的操作是___________ 。
③步骤III形成的TiO2·nH2O为胶体,其反应的化学方程式为____________________ 。
(2)可利用TiO2通过下述两种方法制备金属钛:
方法一:将TiO2作阴极,石墨作阳极,熔融CaO为电解液,碳块作电解槽池,电解TiO2制得钛,阳极上一定生成的气体是____________ ,可能生成的气体是__________________ 。
方法二:通过以下反应制备金属钛
①TiO2(s)+2Cl2(g) TiCl4(g)+O2(g)△H=+ 151kJ/mol
TiCl4(g)+O2(g)△H=+ 151kJ/mol
②TiCl4+2Mg 2MgCl2+Ti
2MgCl2+Ti
实际生产中,需在反应①过程中加入碳,可以顺利制得TiCl4。碳的作用除燃烧放热外,还具有的作用是_______________________________________ 。
(1)工业上用钛矿石(主要成分为FeTiO3,主要含FeO、Al2O3、SiO2等杂质)经过以下流程制得TiO2:

其中,步骤II发生的主要反应为:2H2SO4+ FeTiO3=TiOSO4+FeSO4+2H2O
①步骤I发生反应的离子方程式是:
②步骤II中加入Fe的目的是
③步骤III形成的TiO2·nH2O为胶体,其反应的化学方程式为
(2)可利用TiO2通过下述两种方法制备金属钛:
方法一:将TiO2作阴极,石墨作阳极,熔融CaO为电解液,碳块作电解槽池,电解TiO2制得钛,阳极上一定生成的气体是
方法二:通过以下反应制备金属钛
①TiO2(s)+2Cl2(g)
 TiCl4(g)+O2(g)△H=+ 151kJ/mol
TiCl4(g)+O2(g)△H=+ 151kJ/mol②TiCl4+2Mg
 2MgCl2+Ti
2MgCl2+Ti实际生产中,需在反应①过程中加入碳,可以顺利制得TiCl4。碳的作用除燃烧放热外,还具有的作用是
您最近一年使用:0次
名校
解题方法
10 . 辉铜矿石主要含有硫化亚铜(Cu2S)及少量脉石(SiO2)。一种以辉铜矿石为原料制备硝酸铜的工艺流程如下所示:
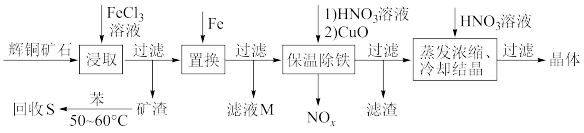
(1)写出“浸取”过程中Cu2S溶解时发生反应的离子方程式:________________________
(2)“矿渣”中除了S以外,还有____________ (填化学式);“回收S”过程中温度控制在50~60℃之间,不宜过高或过低的原因是____________________________________
(3)“保温除铁”过程中,加入CuO的目的是____________________________________ ;“蒸发浓缩、冷却结晶”过程中,要用HNO3溶液调节溶液的pH,其理由是____________
(4)气体NOx与氧气混合后通入水中能生成流程中可循环利用的一种物质,该反应的化学方程式为________________________ ;向“滤液M”中加入(或通入) ____________ (填母代号),可得到另一种流程中可循环利用的物质。
a.铁 b.氯气 c.高锰酸钾

(1)写出“浸取”过程中Cu2S溶解时发生反应的离子方程式:
(2)“矿渣”中除了S以外,还有
(3)“保温除铁”过程中,加入CuO的目的是
(4)气体NOx与氧气混合后通入水中能生成流程中可循环利用的一种物质,该反应的化学方程式为
a.铁 b.氯气 c.高锰酸钾

您最近一年使用:0次
2018-04-07更新
|
394次组卷
|
4卷引用:【全国百强校】广西柳州高级中学2018届高三5月冲刺模拟理科综合化学试题



