解题方法
1 . 硼铁混合精矿含有硼镁石[MgBO2(OH)、磁铁矿(Fe3O4)、磁黄铁矿(FexS)、品质铀矿(UO2)等,以该矿为原料制备MgSO4·H2O和硼酸(H3BO3)的工艺流程如下:

已知: 在pH为4~5的溶液中生成UO2(OH)2沉淀。
在pH为4~5的溶液中生成UO2(OH)2沉淀。
回答下列问题:
(l)“酸浸”时,为了提高浸出率可采取的措施有:________ (至少答两个措施),该步骤中NaClO3可将UO2转化为 ,则该反应的离子方程式为
,则该反应的离子方程式为_____ 。
(2)“除铁净化”需要加入____ (填化学式)把溶液pH调节至4~5,滤渣的成分是_______ 。
(3)“蒸发浓缩”时,加入固体MgC12的作用是___ 。
(4)铁精矿(Fe3O4、FexS)经过一系列加工后,可用于制备氢氧化铁固体。已知T℃,
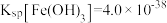 ,
,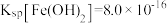 ,
,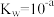 回答下列问题:
回答下列问题:
①在T℃,假设Fe3+水解的离子方程式是: ,则该条件下Fe3+水解反应的平衡常数K=
,则该条件下Fe3+水解反应的平衡常数K= __ (用含以的字母表示)。
②在T℃向饱和Fe(OH)3、Fe(OH)2的混合溶液中,加入少量NaOH固体(忽略溶液体积变化),则溶液中的c(Fe2+)/c(Fe3+)会__ (填“变大”“变小”或“不变”),请结合相关数据推理说明:____ 。

已知:
 在pH为4~5的溶液中生成UO2(OH)2沉淀。
在pH为4~5的溶液中生成UO2(OH)2沉淀。回答下列问题:
(l)“酸浸”时,为了提高浸出率可采取的措施有:
 ,则该反应的离子方程式为
,则该反应的离子方程式为(2)“除铁净化”需要加入
(3)“蒸发浓缩”时,加入固体MgC12的作用是
(4)铁精矿(Fe3O4、FexS)经过一系列加工后,可用于制备氢氧化铁固体。已知T℃,
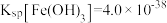 ,
,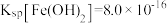 ,
,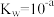 回答下列问题:
回答下列问题:①在T℃,假设Fe3+水解的离子方程式是:
 ,则该条件下Fe3+水解反应的平衡常数K=
,则该条件下Fe3+水解反应的平衡常数K= ②在T℃向饱和Fe(OH)3、Fe(OH)2的混合溶液中,加入少量NaOH固体(忽略溶液体积变化),则溶液中的c(Fe2+)/c(Fe3+)会
您最近一年使用:0次
2 . 葡萄糖酸钙是一种可促进骨骼生长的营养物质。葡萄糖酸钙可通过以下反应制得:
C6H12O6(葡萄糖)+Br2+H2O→C6H12O7(葡萄糖酸)+2HBr
2C6H12O7(葡萄糖酸)+CaCO3→Ca(C6H11O7)2(葡萄糖酸钙)+H2O+CO2↑
相关物质的溶解性见下表:
实验流程如下:

回答下列问题:
(1)第①步中溴水氧化葡萄糖时,甲同学设计了如图所示装置。
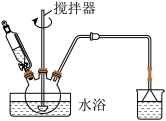
①你认为缺少的仪器是__ 。
②甲同学在尾气吸收装置中使用倒立漏斗的目的是__ 。
(2)第②步CaCO3固体过量,其目的是__ 。
(3)本实验中___ (填“能”或“不能”)用CaCl2替代CaCO3,理由是__ 。
(4)第③步“某种操作”名称是__ 。
(5)第④步加入乙醇的作用是__ 。
(6)第⑥步中洗涤操作主要是除去沉淀表面可能含有的溴化钙,洗涤剂最合适的是__ (填标号)。
A.冷水 B.热水 C.乙醇 D.乙醇—水混合溶液
C6H12O6(葡萄糖)+Br2+H2O→C6H12O7(葡萄糖酸)+2HBr
2C6H12O7(葡萄糖酸)+CaCO3→Ca(C6H11O7)2(葡萄糖酸钙)+H2O+CO2↑
相关物质的溶解性见下表:
物质名称 | 葡萄糖酸钙 | 葡萄糖酸 | 溴化钙 |
水中的溶解性 | 可溶于冷水易溶于热水 | 可溶 | 易溶 |
乙醇中的溶解性 | 微溶 | 微溶 | 可溶 |

回答下列问题:
(1)第①步中溴水氧化葡萄糖时,甲同学设计了如图所示装置。

①你认为缺少的仪器是
②甲同学在尾气吸收装置中使用倒立漏斗的目的是
(2)第②步CaCO3固体过量,其目的是
(3)本实验中
(4)第③步“某种操作”名称是
(5)第④步加入乙醇的作用是
(6)第⑥步中洗涤操作主要是除去沉淀表面可能含有的溴化钙,洗涤剂最合适的是
A.冷水 B.热水 C.乙醇 D.乙醇—水混合溶液
您最近一年使用:0次
解题方法
3 . 工业、上常用钛铁矿[主要成分为FeTiO3(钛酸亚铁,不溶于水)、Fe2O3及少量SiO2杂质]作原料,制取二氧化钛及铁红,其生产流程如图:

已知:TiO2+易水解,只能存在于强酸性溶液中。
回答下列问题:
(1)钛铁矿用硫酸溶解时,过滤所得滤渣的成分是__ (填化学式)。
(2)从溶液B中得到FeSO4·7H2O晶体的操作是__ 、过滤、洗涤、干燥。
(3)溶液C中加入NH4HCO3,发生反应的离子方程式是__ 。
(4)煅烧FeCO3,发生反应的化学方程式是__ 。
(5)流程中加入Na2CO3粉末得到固体TiO2·nH2O。请结合TiO2+的水解平衡原理解释其原因:__ 。
(6)用如图所示装置(熔融CaF2-CaO作电解质)获得金属钙,并用钙还原TiO2制取金属钛。阳极反应式是__ ,反应过程中CaO的物质的量__ (填“减小”“不变”或“增大”)。


已知:TiO2+易水解,只能存在于强酸性溶液中。
回答下列问题:
(1)钛铁矿用硫酸溶解时,过滤所得滤渣的成分是
(2)从溶液B中得到FeSO4·7H2O晶体的操作是
(3)溶液C中加入NH4HCO3,发生反应的离子方程式是
(4)煅烧FeCO3,发生反应的化学方程式是
(5)流程中加入Na2CO3粉末得到固体TiO2·nH2O。请结合TiO2+的水解平衡原理解释其原因:
(6)用如图所示装置(熔融CaF2-CaO作电解质)获得金属钙,并用钙还原TiO2制取金属钛。阳极反应式是

您最近一年使用:0次
2020-03-06更新
|
435次组卷
|
3卷引用:广西桂林市2020届高三第一次联合调研考试理科综合化学试题
名校
解题方法
4 . 氧化锌工业品广泛应用于橡胶、涂料、陶瓷、化工、医药、玻璃和电子等行业,随着工业的飞速发展,我国对氧化锌的需求量日益增加,成为国民经济建设中不可缺少的重要基础化工原料和新型材料。用工业含锌废渣(主要成分为ZnO,还含有铁、铝、铜的氧化物,Mn2+、Pb2+、Cd2+等)制取氧化锌的工艺流程如图所示:
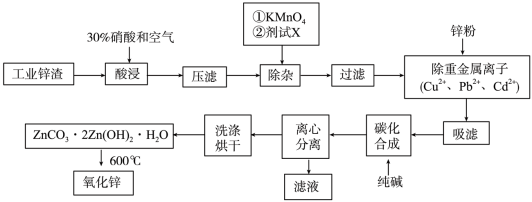
已知:相关金属离子c(Mn+)=0.1mol/L 生成氢氧化物沉淀的pH如下表所示:
回答下列问题:
(1)为保证锌渣酸浸的充分,先保持酸过量,且c(H+)=0.5mol/L左右。写出一种加快锌渣浸出的方法:_______________
(2)为调节溶液的pH,则试剂X为__________________ (填化学式),且调节溶液pH的范围是____________
(3)除杂时加入高锰酸钾的作用是_______________ ,发生反应的离子方程式为_____________
(4)“过滤”所得滤渣的主要成分是_____________________ (填化学式)
(5)写出“碳化合成”的化学方程式:_____________________ ;“碳化合成”过程需纯碱稍过量,请设计实验方案证明纯碱过量:_____________________

已知:相关金属离子c(Mn+)=0.1mol/L 生成氢氧化物沉淀的pH如下表所示:
| Fe3+ | Fe2+ | Al3+ | Mn2+ | Zn2+ | Cu2+ | Cd2+ | |
| 开始沉淀 | 1.5 | 6.3 | 3.4 | 8.1 | 6.2 | 6.0 | 7.4 |
| 沉淀完全 | 2.8 | 8.3 | 4.7 | 10.1 | 8.2 | 8.0 | 9.4 |
(1)为保证锌渣酸浸的充分,先保持酸过量,且c(H+)=0.5mol/L左右。写出一种加快锌渣浸出的方法:
(2)为调节溶液的pH,则试剂X为
(3)除杂时加入高锰酸钾的作用是
(4)“过滤”所得滤渣的主要成分是
(5)写出“碳化合成”的化学方程式:
您最近一年使用:0次
2020-02-25更新
|
372次组卷
|
3卷引用:广西名校高三2019-2020学年第一学期第一次大联考-化学
2019·广西柳州·一模
5 . Ag2O—Zn纽扣电池的固体拆解物中含Ag2O、Ag、Zn、Cu、石墨等物质,从中可提取金属银。如图是简要生产流程。
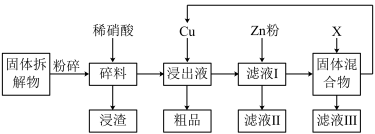
(1)固体拆解物需先粉碎的目的是___ 。
(2)浸渣的主要成分是___ 。
(3)以上流程中可循环使用的物质是___ ,除此之外,你认为通过对___ (填流程图中的物质代号)的回收处理,还有可能实现___ (填化学式)的循环利用。
(4)加入Cu之前若溶液的酸性太强,需适当调节溶液的pH,原因是___ (用离子方程式表示).
(5)有人在实验室中利用如下方案回收银:
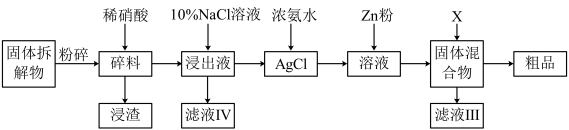
已知:Ag++2NH3 [Ag(NH3)2]+K稳=1.7×107;Ksp(AgCl)=1.8×10-10
[Ag(NH3)2]+K稳=1.7×107;Ksp(AgCl)=1.8×10-10
写出AgCl(s)与NH3反应的离子方程式___ ,该反应的平衡常数K=___ 。
(6)上述两种回收方案中都用到了试剂X,X是___ 。
A.稀硫酸 B.稀硝酸 C.CuSO4溶液
(7)两种方案回收的银均为粗品,若得到纯度更高的银,可以电解精炼。若电流强度为yA,1小时后,得到Ag___ g(列出计算式,已知1个电子所带电量为1.6×10-19C,阿伏加 德罗常数的值用NA表示)。

(1)固体拆解物需先粉碎的目的是
(2)浸渣的主要成分是
(3)以上流程中可循环使用的物质是
(4)加入Cu之前若溶液的酸性太强,需适当调节溶液的pH,原因是
(5)有人在实验室中利用如下方案回收银:

已知:Ag++2NH3
 [Ag(NH3)2]+K稳=1.7×107;Ksp(AgCl)=1.8×10-10
[Ag(NH3)2]+K稳=1.7×107;Ksp(AgCl)=1.8×10-10写出AgCl(s)与NH3反应的离子方程式
(6)上述两种回收方案中都用到了试剂X,X是
A.稀硫酸 B.稀硝酸 C.CuSO4溶液
(7)两种方案回收的银均为粗品,若得到纯度更高的银,可以电解精炼。若电流强度为yA,1小时后,得到Ag
您最近一年使用:0次
6 . 硼镁泥是硼镁矿生产硼砂晶体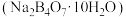 时的废渣,其主要成分是MgO,还含有
时的废渣,其主要成分是MgO,还含有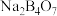 、CaO、
、CaO、 、FeO、MnO、
、FeO、MnO、 等杂质。以硼镁泥为原料制取七水硫酸镁的工艺流程如下:
等杂质。以硼镁泥为原料制取七水硫酸镁的工艺流程如下:
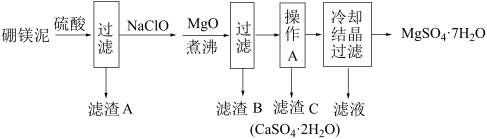
回答下列问题:
(1)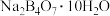 中B的化合价为
中B的化合价为__________ 。
(2)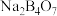 易溶于水,也易发生水解:
易溶于水,也易发生水解: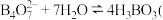 硼酸
硼酸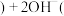 硼酸在常温下溶解度较小
硼酸在常温下溶解度较小 。写出加入硫酸时
。写出加入硫酸时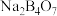 发生反应的化学方程式:
发生反应的化学方程式:_____ 。
(3)滤渣B中含有不溶于稀盐酸但能溶于热浓盐酸的黑色固体,写出生成黑色固体的离子方程式____________ 。
(4)加入MgO的目的是___________________ 。
(5)已知 、
、 的溶解度如下表:
的溶解度如下表:
“操作A”是将 和
和 混合溶液中的
混合溶液中的 除去,根据上表数据,简要说明“操作A”步骤为
除去,根据上表数据,简要说明“操作A”步骤为____________________ 。
(6)硼砂也能在工业上制取 ,
, 被称为有机化学中的“万能还原剂”。
被称为有机化学中的“万能还原剂”。
 写出
写出 的电子式:
的电子式:___________ 。
 “有效氢含量”可用来衡量含氢还原剂的还原能力,其定义是:每克含氢还原剂的还原能力相当于多少克
“有效氢含量”可用来衡量含氢还原剂的还原能力,其定义是:每克含氢还原剂的还原能力相当于多少克 的还原能力。
的还原能力。 的有效氢含量为
的有效氢含量为_________  保留两位小数
保留两位小数 。
。
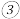 在碱性条件下,在阴极上电解
在碱性条件下,在阴极上电解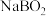 也可制得硼氢化钠,写出阴极室的电极反应式:
也可制得硼氢化钠,写出阴极室的电极反应式:________ 。
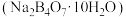 时的废渣,其主要成分是MgO,还含有
时的废渣,其主要成分是MgO,还含有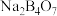 、CaO、
、CaO、 、FeO、MnO、
、FeO、MnO、 等杂质。以硼镁泥为原料制取七水硫酸镁的工艺流程如下:
等杂质。以硼镁泥为原料制取七水硫酸镁的工艺流程如下:
回答下列问题:
(1)
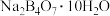 中B的化合价为
中B的化合价为(2)
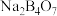 易溶于水,也易发生水解:
易溶于水,也易发生水解: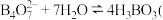 硼酸
硼酸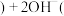 硼酸在常温下溶解度较小
硼酸在常温下溶解度较小 。写出加入硫酸时
。写出加入硫酸时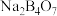 发生反应的化学方程式:
发生反应的化学方程式:(3)滤渣B中含有不溶于稀盐酸但能溶于热浓盐酸的黑色固体,写出生成黑色固体的离子方程式
(4)加入MgO的目的是
(5)已知
 、
、 的溶解度如下表:
的溶解度如下表:温度 溶解度 溶解度 | 40 | 50 | 60 | 70 |
 | 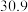 | 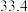 | 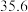 |  |
 | 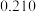 | 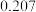 | 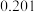 | 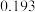 |
“操作A”是将
 和
和 混合溶液中的
混合溶液中的 除去,根据上表数据,简要说明“操作A”步骤为
除去,根据上表数据,简要说明“操作A”步骤为(6)硼砂也能在工业上制取
 ,
, 被称为有机化学中的“万能还原剂”。
被称为有机化学中的“万能还原剂”。 写出
写出 的电子式:
的电子式: “有效氢含量”可用来衡量含氢还原剂的还原能力,其定义是:每克含氢还原剂的还原能力相当于多少克
“有效氢含量”可用来衡量含氢还原剂的还原能力,其定义是:每克含氢还原剂的还原能力相当于多少克 的还原能力。
的还原能力。 的有效氢含量为
的有效氢含量为 保留两位小数
保留两位小数 。
。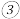 在碱性条件下,在阴极上电解
在碱性条件下,在阴极上电解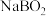 也可制得硼氢化钠,写出阴极室的电极反应式:
也可制得硼氢化钠,写出阴极室的电极反应式:
您最近一年使用:0次
2020-02-03更新
|
374次组卷
|
7卷引用:【全国百强校】广西玉林高级中学2018届高三模拟(二)化学试题
名校
解题方法
7 . 细菌冶金是近年来新兴的绿色冶金工艺,它主要是应用细菌法溶浸贫矿、废矿、尾矿和炉渣等,以回收某些贵重有色金属和稀有金属,节约矿产资源,最大限度地利用矿藏的一种冶金方法。其中细菌冶铜的生产流程为:
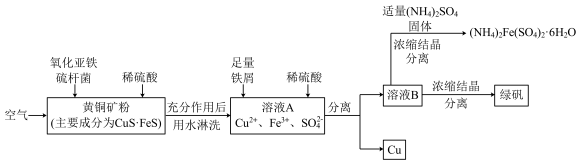
(1)上述生产流程中有三步用到了同一种分离方法,实验室中不能用这种分离方法来分离液态胶体中分散质的原因是___ 。
(2)绿矾(FeSO4·7H2O)是一种良好的还原剂,也可用来制取治疗缺铁性贫血的药剂和食品调味剂。在保存绿矾时,必须___ 。在溶液B中加入适量(NH4)2(SO4)2固体,加热浓缩时,可以得到(NH4)2Fe(SO4)4·6H2O的原因是___ 。
(3)溶液B中一定含有的金属阳离子是___ 。若在溶液A中加入少量铁屑只发生其中的一个反应,则此反应的平衡常数的表达式为___ 。
(4)写出黄铜矿中的CuS·FeS在氧化亚铁硫杆菌作用下被空气氧化生成溶液A的离子方程式:___ 。
(5)氧化亚铜可用作船底防污漆,以杀死低级海生动物而保护船体,也可用作陶瓷和搪瓷的着色剂和红色玻璃的染色剂,氧化亚铜也是一种重要的半导体材料。请用浓的强碱溶液,根据反应2Cu+H2O Cu2O+H2↑,设计出工业生产氧化亚铜的一种方法:
Cu2O+H2↑,设计出工业生产氧化亚铜的一种方法:___ (只要求画实验装置图,其他必要材料任选)。

(1)上述生产流程中有三步用到了同一种分离方法,实验室中不能用这种分离方法来分离液态胶体中分散质的原因是
(2)绿矾(FeSO4·7H2O)是一种良好的还原剂,也可用来制取治疗缺铁性贫血的药剂和食品调味剂。在保存绿矾时,必须
(3)溶液B中一定含有的金属阳离子是
(4)写出黄铜矿中的CuS·FeS在氧化亚铁硫杆菌作用下被空气氧化生成溶液A的离子方程式:
(5)氧化亚铜可用作船底防污漆,以杀死低级海生动物而保护船体,也可用作陶瓷和搪瓷的着色剂和红色玻璃的染色剂,氧化亚铜也是一种重要的半导体材料。请用浓的强碱溶液,根据反应2Cu+H2O
 Cu2O+H2↑,设计出工业生产氧化亚铜的一种方法:
Cu2O+H2↑,设计出工业生产氧化亚铜的一种方法:
您最近一年使用:0次
2019-12-05更新
|
305次组卷
|
2卷引用:广西壮族自治区南宁市第二中学2020届高三下学期模拟考试理综化学试题
名校
8 . 铜及其化合物在工业生产上有许多用途。某工厂以辉铜矿(主要成分为 Cu2S,含少量 Fe2O3、SiO2等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下:

已知:
①常温下几种物质开始形成沉淀与完全沉淀时的pH如下表
②Ksp[Fe(OH)3]=4.0×10-38
(1)加快“浸取”速率,除将辉铜矿粉碎外,还可采取的措施有____ (任写一种)。
(2)滤渣I中的主要成分是MnO2、S、SiO2,请写出“浸取”反应中生成S的化学方程式:____ 。
(3)常温下“除铁”时加入的试剂A可用CuO等,调节pH调的范围为____ ,若加 A 后溶液的 pH调为5,则溶液中 Fe3+的浓度为____ mol/L。
(4)写出“沉锰”(除 Mn2+)过程中反应的离子方程式:____ 。
(5)“赶氨”时,最适宜的操作方法是____ 。
(6)滤液Ⅱ经蒸发结晶得到的盐主要是____ (写化学式)。
(7)过滤Ⅱ得到的沉淀经过洗涤、干燥可以得到碱式碳酸铜,判断沉淀是否洗净的操作是____ 。

已知:
①常温下几种物质开始形成沉淀与完全沉淀时的pH如下表
| 金属离子 | Fe2+ | Fe3+ | Cu2+ | Mn2+ |
| 开始沉淀 | 7.5 | 2.7 | 5.6 | 8.3 |
| 完全沉淀 | 9.0 | 3.7 | 6.7 | 9.8 |
②Ksp[Fe(OH)3]=4.0×10-38
(1)加快“浸取”速率,除将辉铜矿粉碎外,还可采取的措施有
(2)滤渣I中的主要成分是MnO2、S、SiO2,请写出“浸取”反应中生成S的化学方程式:
(3)常温下“除铁”时加入的试剂A可用CuO等,调节pH调的范围为
(4)写出“沉锰”(除 Mn2+)过程中反应的离子方程式:
(5)“赶氨”时,最适宜的操作方法是
(6)滤液Ⅱ经蒸发结晶得到的盐主要是
(7)过滤Ⅱ得到的沉淀经过洗涤、干燥可以得到碱式碳酸铜,判断沉淀是否洗净的操作是
您最近一年使用:0次
2019-11-13更新
|
761次组卷
|
5卷引用:广西壮族自治区玉林市2021届高三上学期11月教学质量监测理科综合化学试题
解题方法
9 . 工业上利用氧化铝基废催化剂(主要成分为Al2O3,还含有少量Pd)回收Al2(SO4)3及Pd的流程如下:
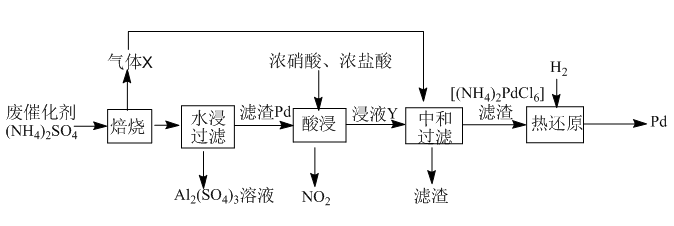
(1)Al2(SO4)3溶液蒸干灼烧后所得物质的化学名称是___________ 。
(2)焙烧时Al2O3与(NH4)2SO4反应的化学方程式为___________ 。
水浸与中和步骤得到溶液的操作方法是___________ 。
(3)浸液Y中含Pd元素的溶质是___________ (填化学式)。
(4)“热还原”中每生成1molPd生成的气体的物质的量为___________ (已知热还原得到的固体只有Pd)。
(5)Pd是优良的储氢金属,其储氢原理为2Pd(s)+xH2(g)==2PdHx(s),其中x的最大值为0.8。已知: Pd的密度为12g·cm-3, 则10.6cm3Pd能储存标准状况下H2的最大体积为___________ L。
(6)铝的阳极氧化法是将铝作为阳极,置于硫酸等电解液中,加入α-羟基丙酸、丙三醇后进行电解,可观察到铝的表面会形成一层致密的氧化膜。
①写出电解时阳极的电极反应式:______________________ 。
②电解过程中α-羟基丙酸、丙三醇的作用可能是______________________ 。

(1)Al2(SO4)3溶液蒸干灼烧后所得物质的化学名称是
(2)焙烧时Al2O3与(NH4)2SO4反应的化学方程式为
水浸与中和步骤得到溶液的操作方法是
(3)浸液Y中含Pd元素的溶质是
(4)“热还原”中每生成1molPd生成的气体的物质的量为
(5)Pd是优良的储氢金属,其储氢原理为2Pd(s)+xH2(g)==2PdHx(s),其中x的最大值为0.8。已知: Pd的密度为12g·cm-3, 则10.6cm3Pd能储存标准状况下H2的最大体积为
(6)铝的阳极氧化法是将铝作为阳极,置于硫酸等电解液中,加入α-羟基丙酸、丙三醇后进行电解,可观察到铝的表面会形成一层致密的氧化膜。
①写出电解时阳极的电极反应式:
②电解过程中α-羟基丙酸、丙三醇的作用可能是
您最近一年使用:0次
2019-04-01更新
|
1277次组卷
|
3卷引用:【市级联考】广西壮族自治区南宁市普通高中2019届高三毕业班第一次适应测试理综化学试题
解题方法
10 . 甲酸钙广泛用于食品、化工、石油等工业生产上,在300~400℃左右分解。
Ⅰ.实验室制取甲酸钙的方法之一是Ca(OH)2+2HCHO+H2O2=Ca(HCOO)2+2H2O+H2。实验室制取时,将工业氢氧化钙(含铜离子等杂质)和甲醛依次加入质量分数为30%~70%的过氧化氢溶液中(投料时工业氢氧化钙、甲醛、过氧化氢的物质的量之比为1: 2: 1.2),最终可得到质量分数大于98%且重金属含量极低的优质产品。
(1)铜离子对该实验的影响是________________________________________ 。
(2)甲酸钙的分解产物为_______________________________ 。
(3)制备时,在混合溶液中除了要加入微量硼酸钠抑制甲醛发生副反应外,还要加入少量的Na2S溶液。加硫化钠的目的之一是除去重金属离子,其反应的离子方程式为_________________________________ 。
(4)实验时需强力搅拌45min,其目的是__________________________________ 。
(5)取ag优质产品[杂质只有Ca(OH)2]溶于水,加入bgNa2CO3(过量),得到cg沉淀,则产品中甲酸钙的百分含量为__________________ (列出计算式即可)。
Ⅱ.某研究性学习小组以工业碳酸钙(主要成分为CaCO3,杂质为Al2O3、FeCO3)为原料,先制备无机钙盐,再与甲酸钠溶液混合制取甲酸钙。结合图中几种物质的溶解度曲线及表中相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol·L-1计算),现提供的试剂有:
a.甲酸钠 b.5mol·L-1的硝酸 c.澄清石灰水
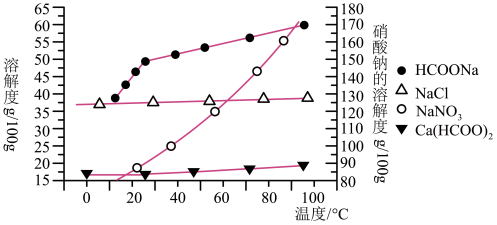
请补充完整由碳酸钙制备甲酸钙的实验步骤:
步骤1:称取13.6g甲酸钠溶于约20mL水中,配成溶液待用,并称取研细的碳酸钙样品10g待用。
步骤2:_____________________________________________________________ 。
步骤3:____________________________________________________________________ 。
步骤4:过滤后,将滤液与甲酸钠溶液混合,调整溶液pH为7~8,充分搅拌,所得溶液经____________ 、趁热过滤、洗涤、干燥得甲酸钙晶体。
Ⅰ.实验室制取甲酸钙的方法之一是Ca(OH)2+2HCHO+H2O2=Ca(HCOO)2+2H2O+H2。实验室制取时,将工业氢氧化钙(含铜离子等杂质)和甲醛依次加入质量分数为30%~70%的过氧化氢溶液中(投料时工业氢氧化钙、甲醛、过氧化氢的物质的量之比为1: 2: 1.2),最终可得到质量分数大于98%且重金属含量极低的优质产品。
(1)铜离子对该实验的影响是
(2)甲酸钙的分解产物为
(3)制备时,在混合溶液中除了要加入微量硼酸钠抑制甲醛发生副反应外,还要加入少量的Na2S溶液。加硫化钠的目的之一是除去重金属离子,其反应的离子方程式为
(4)实验时需强力搅拌45min,其目的是
(5)取ag优质产品[杂质只有Ca(OH)2]溶于水,加入bgNa2CO3(过量),得到cg沉淀,则产品中甲酸钙的百分含量为
Ⅱ.某研究性学习小组以工业碳酸钙(主要成分为CaCO3,杂质为Al2O3、FeCO3)为原料,先制备无机钙盐,再与甲酸钠溶液混合制取甲酸钙。结合图中几种物质的溶解度曲线及表中相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol·L-1计算),现提供的试剂有:
a.甲酸钠 b.5mol·L-1的硝酸 c.澄清石灰水

请补充完整由碳酸钙制备甲酸钙的实验步骤:
步骤1:称取13.6g甲酸钠溶于约20mL水中,配成溶液待用,并称取研细的碳酸钙样品10g待用。
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
步骤3:
步骤4:过滤后,将滤液与甲酸钠溶液混合,调整溶液pH为7~8,充分搅拌,所得溶液经
您最近一年使用:0次



