名校
解题方法
1 . 钇是稀土元素之一。我国蕴藏着丰富的钇矿石(Y2FeBe2Si2O10),用NaOH初步处理钇矿石可以得到Y(OH)3、Fe2O3、Na2SiO3和Na2BeO2的共熔物。工业上利用该共熔物制取氧化钇,并获得副产物铍,流程如图:
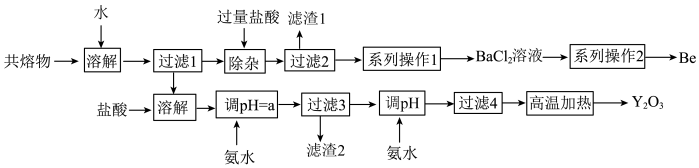
已知i.铍和铝处于元素周期表的对角线位置,化学性质相似;
ii.Fe3+、Y3+形成氢氧化物沉淀时的pH如表:
(1)滤渣1的主要成分是_______ 。
(2)过滤2所得滤液中含有NaCl、BeCl2和少量HCl。为提纯BeCl2。选择合理步骤并排序完成系列操作1_______ 。
a.加入适量的盐酸
b.通入过量的CO2
c.过滤
d.加入过量的NaOH溶液
e.加入过量的氨水
f.洗涤
(3)由BeCl2溶液制得BeCl2固体的操作为_______ 。
(4)用氨水调节pH=a时,a的取值范围是_______ 。
(5)计算常温下Y3++3H2O Y(OH)3+3H+的平衡常数K=
Y(OH)3+3H+的平衡常数K=_______ 。(常温下Ksp[Y(OH)3]=8.0×10-23)
(6)“除杂”中Na2BeO2与过量盐酸反应的离子方程式为_______ 。
(7)常见的由BeCl2固体生产Be的工业方法有两种:①电解法:电解NaCl-BeCl2混合熔融盐制备Be;②热还原法:熔融条件下,钾还原BeCl2制备Be。以上两种方法你认为哪种更好并说明理由_______ 。

已知i.铍和铝处于元素周期表的对角线位置,化学性质相似;
ii.Fe3+、Y3+形成氢氧化物沉淀时的pH如表:
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe3+ | 2.1 | 3.1 |
| Y3+ | 6.0 | 8.3 |
(2)过滤2所得滤液中含有NaCl、BeCl2和少量HCl。为提纯BeCl2。选择合理步骤并排序完成系列操作1
a.加入适量的盐酸
b.通入过量的CO2
c.过滤
d.加入过量的NaOH溶液
e.加入过量的氨水
f.洗涤
(3)由BeCl2溶液制得BeCl2固体的操作为
(4)用氨水调节pH=a时,a的取值范围是
(5)计算常温下Y3++3H2O
 Y(OH)3+3H+的平衡常数K=
Y(OH)3+3H+的平衡常数K=(6)“除杂”中Na2BeO2与过量盐酸反应的离子方程式为
(7)常见的由BeCl2固体生产Be的工业方法有两种:①电解法:电解NaCl-BeCl2混合熔融盐制备Be;②热还原法:熔融条件下,钾还原BeCl2制备Be。以上两种方法你认为哪种更好并说明理由
您最近一年使用:0次
名校
解题方法
2 . 辉铜矿[ ,含
,含 杂质]合成
杂质]合成 目标产物的流程如下。下列说法正确的是
目标产物的流程如下。下列说法正确的是
 ,含
,含 杂质]合成
杂质]合成 目标产物的流程如下。下列说法正确的是
目标产物的流程如下。下列说法正确的是
A.步骤Ⅰ在足量 中煅烧产生气体的主要成分: 中煅烧产生气体的主要成分: |
B.步骤Ⅱ得溶液 中溶质的主要成分: 中溶质的主要成分: 和 和 |
C.步骤Ⅲ的溶液D中存在平衡平衡: |
| D.为得纯净目标产物,步骤Ⅳ的实验操作步骤依次:加热蒸发、冷却结晶、抽滤洗涤。 |
您最近一年使用:0次
2023-06-06更新
|
2023次组卷
|
5卷引用:化学02(15+4模式)2024年1月“九省联考”考前化学猜想卷
名校
3 . 某科研小组制备了新型锂离子电池电极材料-ZnLix/Li3N。科研小组以废旧锌锰电池的锌皮为原料合成该电极材料,简易流程如下:
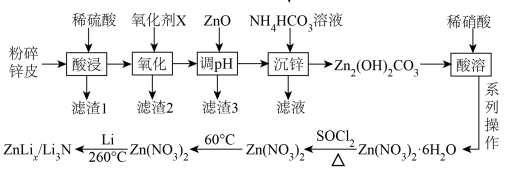
已知:①锌皮的主要成分为Zn和ZnO,还含少量NH4Cl、Fe、Mn2O3等。
②Mn2O3在酸性条件下转化成Mn2+和MnO2;SOCl2的沸点为78.8°C。
③已知几种金属离子形成氢氧化物沉淀时的pH如表所示:
回答下列问题:
(1)提高“酸浸”速率的措施有_______ (答一条即可),“调pH”的最小值为_______ 。
(2)“沉锌”的离子方程式为_______ 。
(3)SOCl2的作用是_______ (用化学方程式表示)。
(4)(i)已知部分信息如下:
①自发的电池反应实质是氧化还原反应,可以拆分为两个半反应,正极、负极的标准电极电势分别表示为φ0(+)和φ0(-);标准电动势E0=φ0(+)-φ0(-)。例如,2Ag+Hg2+=2Ag++Hg的E0=φ0(Hg2+/Hg)-φ0(Ag+/Ag)。
②E0>0,反应能自发进行,E0>0.3,反应趋向完全反应。
③在酸性介质中几种半反应的电极电势数据如下表所示:
如果氧化剂X选择硝酸,其后果是_______ 和会产生大气污染物。从下列物质中选择氧化剂X,杂质除去率最高的是_______ (填标号)。
A.NaClO B. Cl2 C. O2 D. O3
(ii)工业生产中,氧化剂的实际用量和理论计算量之间的比值称为配氧率。“氧化”中除杂率与配氧率的关系如图所示。试解释配氧率选择115%时除杂率最高的原因:_______ 。

(5)常温下,Kh(NH3·H2O)=1.8×10-5,Ka1(H2CO3)=4.3×10-7,Ka2(H2CO3)=5.6×10-11。0.1mol·L-1NH4HCO3溶液的酸度AG=lg
_______ (填“>”、“<”或“=”)0,判断依据是_______ 。

已知:①锌皮的主要成分为Zn和ZnO,还含少量NH4Cl、Fe、Mn2O3等。
②Mn2O3在酸性条件下转化成Mn2+和MnO2;SOCl2的沸点为78.8°C。
③已知几种金属离子形成氢氧化物沉淀时的pH如表所示:
| 金属氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Zn(OH)2 |
| 开始沉淀的pH | 2.2 | 7.5 | 8.8 | 6.5 |
| 完全沉淀的pH | 3.5 | 9.5 | 10.8 | 8.5 |
(1)提高“酸浸”速率的措施有
(2)“沉锌”的离子方程式为
(3)SOCl2的作用是
(4)(i)已知部分信息如下:
①自发的电池反应实质是氧化还原反应,可以拆分为两个半反应,正极、负极的标准电极电势分别表示为φ0(+)和φ0(-);标准电动势E0=φ0(+)-φ0(-)。例如,2Ag+Hg2+=2Ag++Hg的E0=φ0(Hg2+/Hg)-φ0(Ag+/Ag)。
②E0>0,反应能自发进行,E0>0.3,反应趋向完全反应。
③在酸性介质中几种半反应的电极电势数据如下表所示:
| 物质 | HClO/Cl- | Cl2/Cl- | O2/H2O | O3/O2 | HNO3/NO | Fe3+/Fe2+ | MnO2/Mn2+ |
| φ0 | 1.482 | I.358 | 1.229 | 2.076 | 0.983 | 0.771 | 1.224 |
A.NaClO B. Cl2 C. O2 D. O3
(ii)工业生产中,氧化剂的实际用量和理论计算量之间的比值称为配氧率。“氧化”中除杂率与配氧率的关系如图所示。试解释配氧率选择115%时除杂率最高的原因:

(5)常温下,Kh(NH3·H2O)=1.8×10-5,Ka1(H2CO3)=4.3×10-7,Ka2(H2CO3)=5.6×10-11。0.1mol·L-1NH4HCO3溶液的酸度AG=lg

您最近一年使用:0次
2023-06-03更新
|
193次组卷
|
2卷引用:广西壮族自治区玉林市2023届高三下学期学业水平考试理综化学试题
4 . 钛元素位于元素周期表第四周期第IVB族,金属钛的比强度高、耐腐蚀性强,在航空航天、武器装备、能源、化工、冶金、建筑和交通等领域应用前景广阔。工业,上以钛铁矿[主要成分是FeTiO3 (钛酸亚铁) ,还含有少量Al2O3、MgO、SiO2等杂质]为原料制备钛和FePO4的工艺流程如下:
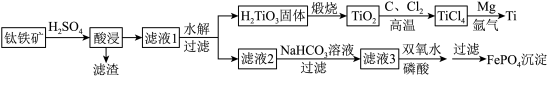
一定条件下,一些金属氢氧化物沉淀时的pH如下表:
回答下列问题:
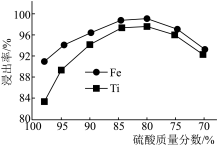
(1)钛、铁浸出率与硫酸质量分数的关系如图所示,则“酸浸”时所加硫酸的质量分数为___________ 范围最合适。
(2)“滤液1”中的钛元素以TiO2+形式存在,则“酸浸”时主要反应的化学方程式为___________ 。
(3)已知常压下TiCl4的熔点为−25° C,沸点为136.4° C.将TiO2与过量焦炭混合投入高温氯化炉中充分反应(焦炭转变成CO) ,将生成的气体分离,得到粗TiCl4,将生成的气体进行分离的操作方法是______________________ 。将粗TiCl4进一步提纯的方法是___________ 。氯化炉中发生反应的化学方程式为___________ 。
(4)氯化反应的尾气须处理后排放。尾气中的Cl2用___________ (填化学式)溶液吸收可得FeCl3溶液。
(5)“滤液2”中加入NaHCO3溶液调pH,调pH的范围是___________ 。
(6)已知FePO4和Mg3(PO4)2的Ksp分别为1.3×10-22和1.0×10-24.若“滤液3”中c(Mg2+)=0.01mol·L-1,加入双氧水和磷酸溶液,溶液体积增加一倍,恰好使Fe3+沉淀完全[即溶液中c(Fe3+)=1.0×10-5 mol·L-1], 此时___________ (填“有”或“没有”) Mg3(PO4)2沉淀生成,理由是___________ 。

一定条件下,一些金属氢氧化物沉淀时的pH如下表:
| 金属氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀的pH | 2.3 | 7.5 | 3.4 | 9.2 |
| 完全沉淀的pH | 3.2 | 9.7 | 4.4 | 11.1 |

(1)钛、铁浸出率与硫酸质量分数的关系如图所示,则“酸浸”时所加硫酸的质量分数为
(2)“滤液1”中的钛元素以TiO2+形式存在,则“酸浸”时主要反应的化学方程式为
(3)已知常压下TiCl4的熔点为−25° C,沸点为136.4° C.将TiO2与过量焦炭混合投入高温氯化炉中充分反应(焦炭转变成CO) ,将生成的气体分离,得到粗TiCl4,将生成的气体进行分离的操作方法是
(4)氯化反应的尾气须处理后排放。尾气中的Cl2用
(5)“滤液2”中加入NaHCO3溶液调pH,调pH的范围是
(6)已知FePO4和Mg3(PO4)2的Ksp分别为1.3×10-22和1.0×10-24.若“滤液3”中c(Mg2+)=0.01mol·L-1,加入双氧水和磷酸溶液,溶液体积增加一倍,恰好使Fe3+沉淀完全[即溶液中c(Fe3+)=1.0×10-5 mol·L-1], 此时
您最近一年使用:0次
5 . 铜转炉烟灰含金属元素(主要为Cu、Zn、Pb、Fe)的硫酸盐和氧化物以及SiO2.其有价金属回收工艺流程如下图所示。已知:25℃时,Ksp(PbSO4) =1.82×10-8,Ksp(PbCO3) =1.46×10-13。回答下列问题:
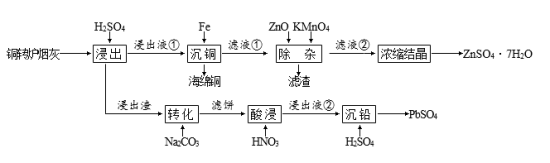
(1)“浸出液①”中所含有的金属阳离子有___________ 和Fe2+、Fe3+。“浸出”中,当硫酸浓度大于1.8 mol·L-1时,金属离子浸出率反而下降,原因是___________ 。
(2)“除杂”中,加入ZnO调pH至5.2后,用KMnO4溶液氧化后,所得滤渣主要成分为Fe(OH)3、MnO2,该氧化过程的离子方程式为___________ 。
(3)ZnSO4的溶解度随温度变化曲线如图所示。“浓缩结晶”的具体操作步骤为:
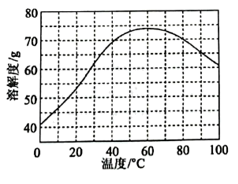
①在沸腾时蒸发至溶液出现晶膜,停止加热;
②降温至___________ ℃蒸发至溶液出现晶膜,停止加热;
③冷却至室温,过滤、洗涤、干燥。其中,步骤①的目的为___________ 。
(4)“转化”后,滤饼的主要成分是___________ 。
(5)该工艺中,可循环利用的物质是___________ 。
(6)蓄电池如果一直闲置不使用,也会损耗电量,这种现象称为蓄电池的自放电现象。铅酸蓄电池的负极在较高温度和较高浓度的硫酸中容易发生自放电现象,用化学方程式表示自放电的机理:___________ 。

(1)“浸出液①”中所含有的金属阳离子有
(2)“除杂”中,加入ZnO调pH至5.2后,用KMnO4溶液氧化后,所得滤渣主要成分为Fe(OH)3、MnO2,该氧化过程的离子方程式为
(3)ZnSO4的溶解度随温度变化曲线如图所示。“浓缩结晶”的具体操作步骤为:

①在沸腾时蒸发至溶液出现晶膜,停止加热;
②降温至
③冷却至室温,过滤、洗涤、干燥。其中,步骤①的目的为
(4)“转化”后,滤饼的主要成分是
(5)该工艺中,可循环利用的物质是
(6)蓄电池如果一直闲置不使用,也会损耗电量,这种现象称为蓄电池的自放电现象。铅酸蓄电池的负极在较高温度和较高浓度的硫酸中容易发生自放电现象,用化学方程式表示自放电的机理:
您最近一年使用:0次
6 . 镁在工业、医疗等领域均有重要用途。某化学兴趣小组利用硼砂工厂的固体废弃物(主要含有MgCO3、MgSiO3、Al2O3和Fe2O3等),设计了如图回收镁的工艺流程:
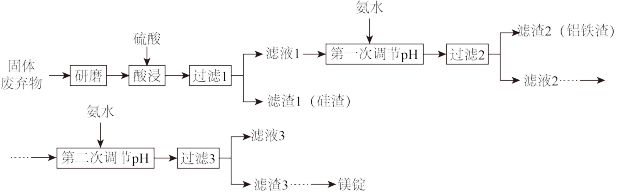
(1)酸浸前,将固体废弃物研磨的目的是______ 。酸浸中硫酸略过量的作用为:①充分浸出金属离子;②______ 。
(2)酸浸时,生成滤渣1的离子方程式为______ 。
(3)第一次调节pH的目的是______ 。当加入氨水使Al3+开始沉淀时,溶液中c(Fe3+)/c(Al3+)为______ 。已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Al(OH)3]=1.0×10-33,Ksp[Mg(OH)2]=1.8×10-11。
(4)设计简单方案分离滤渣2中的成分,简述实验过程:______ 。
(5)滤液3中可回收利用的物质主要是_____ (写化学式),其阳离子的电子式为______ 。
(6)写出工业上从滤渣3中获得镁锭的最后一步反应的化学方程式:______ 。

(1)酸浸前,将固体废弃物研磨的目的是
(2)酸浸时,生成滤渣1的离子方程式为
(3)第一次调节pH的目的是
(4)设计简单方案分离滤渣2中的成分,简述实验过程:
(5)滤液3中可回收利用的物质主要是
(6)写出工业上从滤渣3中获得镁锭的最后一步反应的化学方程式:
您最近一年使用:0次
7 . 检验黑木耳中铁离子的步骤为:灼烧黑木耳→加酸溶解→过滤→取滤液检验,所选择的装置(夹持装置已略去)或操作不正确的是
|
|
|
|
| A.灼烧黑木耳 | B.加酸后搅拌溶解 | C.过滤得滤液 | D.检验铁离子 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-05-04更新
|
1324次组卷
|
9卷引用:2024届广西2024年“贵百河”高三下学期4月新高考模拟二模化学试题
2024届广西2024年“贵百河”高三下学期4月新高考模拟二模化学试题广东省惠州市2024届高三第一次调研考试化学试题广东省梅州市丰顺县2024届高三下学期模拟试卷(三)化学试题广东省梅州市2022-2023学年高一上学期1月期末化学试题(已下线)考点2 物质的分离、提纯、检验与鉴别 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)浙江省柯桥中学2023-2024学年高一上学期期中检测化学试题 广东省深圳市福田区福田中学2023-2024学年高三上学期12月月考化学考试海南省海南中学2023-2024学年高三下学期第6次月考化学试题(已下线)专题3 金属及其化合物-铁及其重要化合物
8 . 三氧化二砷(As2O3)可用于治疗急性早幼粒细胞白血病。一种利用酸性含砷废水提取As2O3的工艺流程如下:
回答下列问题:
(1)砷(As)原子序数为33,其在元素周期表中的位置是___________ 。
(2)“沉淀”时,需控制溶液中NaHS的浓度不能过高,主要原因是___________ 。
(3)“转化”时,As2S3在CuSO4溶液中转化为三元弱酸H3AsO3,该反应的化学方程式为___________ 。
(4)“溶解”时生成Na3AsO4的反应离子方程式为___________ 。从绿色化学的角度分析,该过程还可以用___________ 替代O2。
(5)请设计简单实验验证Na3AsO4溶液呈碱性___________ 。
(6)工业上,As2O3经转化、蒸馏等操作可得到高纯砷,下列与蒸馏操作相关的设备有___________(填字母)。
(7)若一次“还原”制得As2O39.9g,则至少需要通入SO2的体积为___________ L(标准状况)。
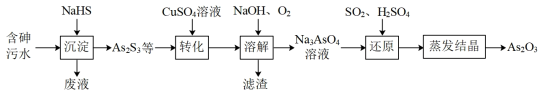
回答下列问题:
(1)砷(As)原子序数为33,其在元素周期表中的位置是
(2)“沉淀”时,需控制溶液中NaHS的浓度不能过高,主要原因是
(3)“转化”时,As2S3在CuSO4溶液中转化为三元弱酸H3AsO3,该反应的化学方程式为
(4)“溶解”时生成Na3AsO4的反应离子方程式为
(5)请设计简单实验验证Na3AsO4溶液呈碱性
(6)工业上,As2O3经转化、蒸馏等操作可得到高纯砷,下列与蒸馏操作相关的设备有___________(填字母)。
| A.蒸馏釜 | B.离心萃取机 | C.加压过滤机 | D.冷凝塔 |
您最近一年使用:0次
9 . 某油脂厂废弃的油脂加氢镍催化剂主要含金属Ni、Al、Fe及其氧化物和少量其它不溶性物质。现采用以下工艺流程制备硫酸镍晶体(NiSO4·7H2O):
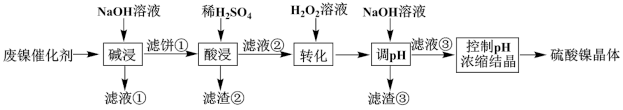
室温下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
回答下列问题:
(1)“碱浸”中NaOH溶液除了溶解铝及其氧化物之外,还起到的作用是_______ 。
(2)“滤液②”中除含有Fe2+外,还可能含的金属离子有_______ (填离子符号)。
(3)结合流程分析,“转化”中选用H2O2的主要优点是_______ 。滤渣③的化学式是_______ 。
(4)反应结束后,将滤液③控制pH,经蒸发浓缩、_______ 、_______ 、洗涤、干燥后可得到硫酸镍晶体。
(5)硫酸镍在强碱溶液中用NaClO氧化,可沉淀出能用作镍镉电池正极材料的NiOOH。写出该反应的离子方程式_______ 。
(6)利用上述表格数据,计算室温下Ni(OH)2的Ksp=_______ 。若“转化”后的溶液中Ni2+浓度为0.1mol·L-1,则“调pH”应控制的pH范围是_______ 。

室温下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 | Ni2+ | Al3+ | Fe3+ | Fe2+ |
| 开始沉淀时(c=0.01mol·L-1)的pH | 7.2 | 3.7 | 2.2 | 7.5 |
| 沉淀完全时(c=1.0×10-5mol·L-1)的pH | 8.7 | 4.7 | 3.2 | 9.0 |
(1)“碱浸”中NaOH溶液除了溶解铝及其氧化物之外,还起到的作用是
(2)“滤液②”中除含有Fe2+外,还可能含的金属离子有
(3)结合流程分析,“转化”中选用H2O2的主要优点是
(4)反应结束后,将滤液③控制pH,经蒸发浓缩、
(5)硫酸镍在强碱溶液中用NaClO氧化,可沉淀出能用作镍镉电池正极材料的NiOOH。写出该反应的离子方程式
(6)利用上述表格数据,计算室温下Ni(OH)2的Ksp=
您最近一年使用:0次
解题方法
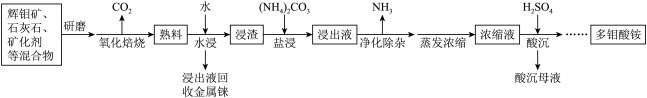
10 . 嫦娥五号从月球带回的“土壤”中含有辉钼矿,其主要成分为 (S为
(S为 价),含少量
价),含少量 、
、 、
、 (铼)等元素。其中钼
(铼)等元素。其中钼 是大脑必需的七种微量元素之一,以辉钼矿为原料生产多钼酸盐的工艺流程如下。
是大脑必需的七种微量元素之一,以辉钼矿为原料生产多钼酸盐的工艺流程如下。
已知:25℃时
回答下列问题:
(1)“研磨”的目的是_______ 。
(2)“氧化焙烧”中发生反应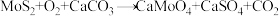 ,该反应中氧化剂与还原剂的物质的量之比为
,该反应中氧化剂与还原剂的物质的量之比为_______ ,其中加入石灰石的主要作用是_______ 。
(3)加入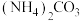 后的“浸出液”中含有
后的“浸出液”中含有 (钼酸根),以及少量
(钼酸根),以及少量 等离子,生成
等离子,生成 的离子方程式为
的离子方程式为_______ ,该反应的
_______ 。
(4)根据已知数据,“净化除杂”过程中,可加入最适宜的试剂是_______ (填标号)。
A. B.
B. C.
C. D.
D.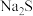
该试剂主要是将 离子转化为
离子转化为_______ (填化学式)。
(5)“酸沉”过程,调节 至6以下,将溶液中的钼酸根离子转化为仲钼酸根离子
至6以下,将溶液中的钼酸根离子转化为仲钼酸根离子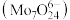 ,该反应的离子方程式为
,该反应的离子方程式为_______ 。
(6)工艺流程中可循环利用的物质是_______ 、_______ 。
 (S为
(S为 价),含少量
价),含少量 、
、 、
、 (铼)等元素。其中钼
(铼)等元素。其中钼 是大脑必需的七种微量元素之一,以辉钼矿为原料生产多钼酸盐的工艺流程如下。
是大脑必需的七种微量元素之一,以辉钼矿为原料生产多钼酸盐的工艺流程如下。
已知:25℃时
| 难溶物 |  | 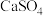 |  |  |  |
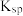 | 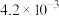 |  |  | 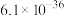 | 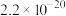 |
(1)“研磨”的目的是
(2)“氧化焙烧”中发生反应
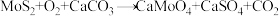 ,该反应中氧化剂与还原剂的物质的量之比为
,该反应中氧化剂与还原剂的物质的量之比为(3)加入
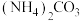 后的“浸出液”中含有
后的“浸出液”中含有 (钼酸根),以及少量
(钼酸根),以及少量 等离子,生成
等离子,生成 的离子方程式为
的离子方程式为
(4)根据已知数据,“净化除杂”过程中,可加入最适宜的试剂是
A.
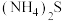 B.
B. C.
C. D.
D.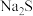
该试剂主要是将
 离子转化为
离子转化为(5)“酸沉”过程,调节
 至6以下,将溶液中的钼酸根离子转化为仲钼酸根离子
至6以下,将溶液中的钼酸根离子转化为仲钼酸根离子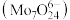 ,该反应的离子方程式为
,该反应的离子方程式为(6)工艺流程中可循环利用的物质是
您最近一年使用:0次
2022-10-21更新
|
853次组卷
|
3卷引用:广西南宁市2022-2023学年高三上学期摸底测试化学试题