名校
1 . 用废镍触媒(主要成分为Ni,含少量的NiO、Al2O3、Fe3O4及其他杂质)制备硫酸镍的过程如下图所示:

已知:①常温下,几种难溶碱开始沉淀和完全沉淀的pH如下表:
②金属离子浓度≤1.0×10-5mol·L-1时,可以认为该金属离子已经沉淀完全。
③Ni的常见化合价为+2、+3。
回答下列问题:
(1)为加快碱化除铝的速率,可以采取的措施是_______ (列举一条即可)。
(2)用离子方程式表示加入双氧水的目的_______ 。
(3)酸化时,反应温度对产品收率的影响有如下数据:
本反应选取的最佳温度范围为_______ ,温度低产品收率低的原因为_______ 。
(4)如果加入双氧水的量不足或“保温时间较短”,对实验结果的影响是产品中混有绿矾。设计实验证明产品中是否含杂质Fe2+(不考虑硫酸镍影响):_______ 。
(5)通过该题数据可知Ksp[Fe(OH)3]为_______ 。

已知:①常温下,几种难溶碱开始沉淀和完全沉淀的pH如下表:
| 沉淀物 | 开始沉淀 | 完全沉淀 |
| Al(OH)3 | 3.8 | 5.2 |
| Fe(OH)3 | 2.7 | 3.2 |
| Fe(OH)2 | 7.6 | 9.7 |
| Ni(OH)2 | 7.1 | 9.2 |
③Ni的常见化合价为+2、+3。
回答下列问题:
(1)为加快碱化除铝的速率,可以采取的措施是
(2)用离子方程式表示加入双氧水的目的
(3)酸化时,反应温度对产品收率的影响有如下数据:
| 温度/°C | 70 | 75 | 80 | 85 | 90 | 95 |
| 收率/% | 53.3 | 62.7 | 70.2 | 77.1 | 81.5 | 81.45 |
(4)如果加入双氧水的量不足或“保温时间较短”,对实验结果的影响是产品中混有绿矾。设计实验证明产品中是否含杂质Fe2+(不考虑硫酸镍影响):
(5)通过该题数据可知Ksp[Fe(OH)3]为
您最近一年使用:0次
2022-07-06更新
|
552次组卷
|
2卷引用:广西玉林市普通高中2022届高三上学期1月统考理科综合化学试题
2 . 铬系和非铬系铜镍电镀污泥均含有Cu(OH)2、Ni(OH)2、Fe(OH)2、Al(OH)3前者还含有Cr(OH)3,一种综合回收铜、镍的新工艺流程如下:

已知:
I. FePO4、CrPO4、AlPO4、Ni3(PO4)2的Ksp依次为1.3 ×10-22、2.4× 10-23、5.8×10-19、5.0×10-31。
II. Cr及其化合物的性质与铝类似。
回答下列问题:
(1)为了增加“浸出I”的浸出效率,可以采取的措施是___________ (任写一 条)。
(2)“电解I”时,需严格控制电压,除了回收铜之外,第二个目的是将二价铁转化为三价铁。可通过一种试剂证明第二个目的是否完全达成,该试剂为___________ (填名称),若未完全达成,出现的现象是____ 。
(3)“除杂”时,若镍离子(Ni2+)浓度为0.05mol·L-1,则应控制溶液中 浓度范围为
浓度范围为___________ mol·L-1~6.4×10-14mol·L-1(已知溶液中离子浓度≤10-5mol·L-1时,认为该离子沉淀完全)。
(4)“沉淀转化”时,氢氧化钠加入量不宜过多,其原因为___________ 、___________ (用离 子方程式表示)。
(5)“浸出II”时,铜镍电镀污泥中铜和镍分别转化为 和
和 ,此时宜采取多次浸取的方式,其目的为
,此时宜采取多次浸取的方式,其目的为___________ 。
(6)“萃取II”时,发生的反应为 + 2HR = CuR2+ 2
+ 2HR = CuR2+ 2 + 2NH3和
+ 2NH3和 + 2HR= NiR2+ 2
+ 2HR= NiR2+ 2 + 4NH3(HR为有机溶剂),则“反萃取II“时含铜微粒发生反应的离子方程式为
+ 4NH3(HR为有机溶剂),则“反萃取II“时含铜微粒发生反应的离子方程式为___________ 。
(7)“滤液1”的主要成分为___________ (填化学式)。

已知:
I. FePO4、CrPO4、AlPO4、Ni3(PO4)2的Ksp依次为1.3 ×10-22、2.4× 10-23、5.8×10-19、5.0×10-31。
II. Cr及其化合物的性质与铝类似。
回答下列问题:
(1)为了增加“浸出I”的浸出效率,可以采取的措施是
(2)“电解I”时,需严格控制电压,除了回收铜之外,第二个目的是将二价铁转化为三价铁。可通过一种试剂证明第二个目的是否完全达成,该试剂为
(3)“除杂”时,若镍离子(Ni2+)浓度为0.05mol·L-1,则应控制溶液中
 浓度范围为
浓度范围为(4)“沉淀转化”时,氢氧化钠加入量不宜过多,其原因为
(5)“浸出II”时,铜镍电镀污泥中铜和镍分别转化为
 和
和 ,此时宜采取多次浸取的方式,其目的为
,此时宜采取多次浸取的方式,其目的为(6)“萃取II”时,发生的反应为
 + 2HR = CuR2+ 2
+ 2HR = CuR2+ 2 + 2NH3和
+ 2NH3和 + 2HR= NiR2+ 2
+ 2HR= NiR2+ 2 + 4NH3(HR为有机溶剂),则“反萃取II“时含铜微粒发生反应的离子方程式为
+ 4NH3(HR为有机溶剂),则“反萃取II“时含铜微粒发生反应的离子方程式为(7)“滤液1”的主要成分为
您最近一年使用:0次
名校
解题方法
3 . K3[Fe(C2O4)3]·3H2O是制备负载型活性铁催化剂的主要原料,为亮绿色晶体,易溶于水,难溶于乙醇。以废铁屑(含C和SiO2)为原料制备K3[Fe(C2O4)3]·3H2O的工艺流程如图所示。

已知:25℃时,[Fe(C2O4)3]3-(aq)+SCN-(aq) [Fe(SCN)]2+(aq)+3C2O
[Fe(SCN)]2+(aq)+3C2O (aq) K=6.31×10-17。
(aq) K=6.31×10-17。
(1)K3[Fe(C2O4)3]·3H2O中Fe的化合价为____ 。
(2)废铁屑需碱浸预处理,“碱浸”中加Na2CO3溶液的目的是____ 。
(3)“溶解、氧化”过程中除了生成K3[Fe(C2O4)3]外,还有Fe(OH)3生成,该反应的化学方程式为____ ,该过程中体系温度需保持在40℃的原因是____ 。
(4)“调pH”是为了获得更多的产品,此时发生反应的化学方程式为____ 。
(5)获得K3[Fe(C2O4)3]·3H2O晶体的“一系列操作”包括:蒸发浓缩、冷却结晶,过滤,洗涤,干燥。其中洗涤的具体操作是____ 。
(6)该流程中可以循环使用的物质是____ 。
(7)某同学欲检验所制晶体中的铁元素,取少量晶体放入试管中,加蒸馏水使其充分溶解,再向试管中滴入几滴0.1mol·L-1KSCN溶液。判断上述实验方案是否可行并结合数据和原理说明理由:____ 。

已知:25℃时,[Fe(C2O4)3]3-(aq)+SCN-(aq)
 [Fe(SCN)]2+(aq)+3C2O
[Fe(SCN)]2+(aq)+3C2O (aq) K=6.31×10-17。
(aq) K=6.31×10-17。(1)K3[Fe(C2O4)3]·3H2O中Fe的化合价为
(2)废铁屑需碱浸预处理,“碱浸”中加Na2CO3溶液的目的是
(3)“溶解、氧化”过程中除了生成K3[Fe(C2O4)3]外,还有Fe(OH)3生成,该反应的化学方程式为
(4)“调pH”是为了获得更多的产品,此时发生反应的化学方程式为
(5)获得K3[Fe(C2O4)3]·3H2O晶体的“一系列操作”包括:蒸发浓缩、冷却结晶,过滤,洗涤,干燥。其中洗涤的具体操作是
(6)该流程中可以循环使用的物质是
(7)某同学欲检验所制晶体中的铁元素,取少量晶体放入试管中,加蒸馏水使其充分溶解,再向试管中滴入几滴0.1mol·L-1KSCN溶液。判断上述实验方案是否可行并结合数据和原理说明理由:
您最近一年使用:0次
4 . 抗氧化的明星营养元素硒(Se)是人体必需的微量元素,工业上从电解精炼铜的阳极泥(主要含Au、Ag、Cu、Se、CuSe、Ag2Se等)中提取硒,同时回收部分金属,工艺流程如下:
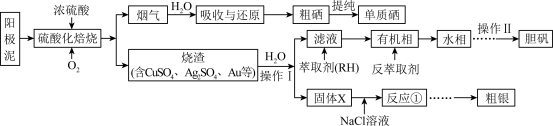
已知:
①硒(Se)的熔点217℃,沸点684.9℃,带有金属光泽。
②硒(Se)可做半导体材料,500℃下可与氧气反应。
回答下列问题:
(1)“硫酸化焙烧”即将阳极泥与浓硫酸混合均匀,在350~500℃下焙烧,为了加快该过程反应速率,该过程中可采取的措施有_______ 、_______ (回答两点即可)。
(2)烟气的主要成分为SO2、SeO2,是焙烧中CuSe与浓H2SO4反应而产生,该反应的化学方程式为_______ ;吸收与还原过程中SeO2极易溶解于水生成亚硒酸(H2SeO3),亚硒酸被烟气中的SO2还原为单质硒,若该过程中有13.44 LSO2(标准状况下)参加反应,则还原得到单质Se的质量为_______ g。
(3)粗硒需用减压蒸馏提纯得到单质硒,其原因是_______ 。
(4)上述流程中萃取与反萃取原理为2RH+Cu2+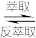 R2Cu+2H+,反萃取剂最好选用
R2Cu+2H+,反萃取剂最好选用_______ (填化学式)溶液;操作II为_______ 、_______ 过滤、洗涤、干燥。
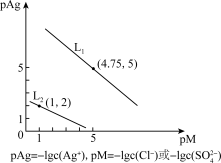
(5)已知常温下的Ag2SO4、AgC1饱和溶液中阳离子和阴离子浓度关系如图所示,其中L1表示AgCl,L2表示Ag2SO4,固体X加入NaCl溶液后,反应①Ag2SO4(s)+2Cl-(aq) 2AgCl(s)+
2AgCl(s)+ (aq),反应①的K=
(aq),反应①的K=_______ 。

已知:
①硒(Se)的熔点217℃,沸点684.9℃,带有金属光泽。
②硒(Se)可做半导体材料,500℃下可与氧气反应。
回答下列问题:
(1)“硫酸化焙烧”即将阳极泥与浓硫酸混合均匀,在350~500℃下焙烧,为了加快该过程反应速率,该过程中可采取的措施有
(2)烟气的主要成分为SO2、SeO2,是焙烧中CuSe与浓H2SO4反应而产生,该反应的化学方程式为
(3)粗硒需用减压蒸馏提纯得到单质硒,其原因是
(4)上述流程中萃取与反萃取原理为2RH+Cu2+
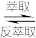 R2Cu+2H+,反萃取剂最好选用
R2Cu+2H+,反萃取剂最好选用(5)已知常温下的Ag2SO4、AgC1饱和溶液中阳离子和阴离子浓度关系如图所示,其中L1表示AgCl,L2表示Ag2SO4,固体X加入NaCl溶液后,反应①Ag2SO4(s)+2Cl-(aq)
 2AgCl(s)+
2AgCl(s)+ (aq),反应①的K=
(aq),反应①的K=
您最近一年使用:0次
名校
5 . 三氧化二镍(Ni2O3)是一种灰黑色无气味有光泽的块状物,易碎成细粉末,常用于制造高能电池。工业上以金属镍废料(含有少量铁、铝等杂质)生产NiCl2,继而生产Ni2O3的工艺流程如下:
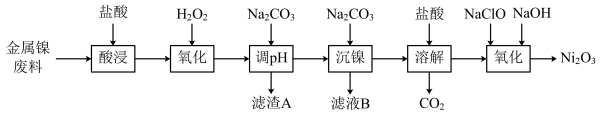
下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
回答下列问题:
(1)Ni2O3中Ni元素的化合价为___________ ;为了提高金属镍废料浸出的速率,在“酸浸”时可采取的措施有:___________ (任写一种)。
(2)“酸浸”后的酸性溶液中加入H2O2的目的是___________ (用语言叙述)。
(3)“沉镍”前需加Na2CO3控制溶液pH范围为___________ ;滤渣A为___________ 。
(4)“氧化”时生成Ni2O3的离子方程式为___________ 。
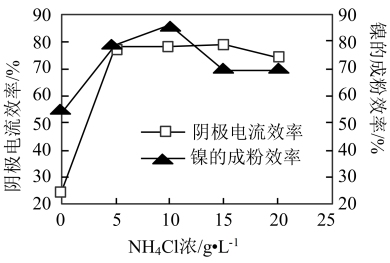
(5)工业上用镍为阳极,电解0.05~0.1 mol·L-1 NiCl2溶液与一定量NH4Cl组成的混合溶液,可得到高纯度、球形的超细镍粉。当其他条件一定时,NH4Cl的浓度对阴极电流效率及镍的成粉率的影响如图所示,则NH4Cl的浓度最好控制为_______ 。

下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Ni(OH)2 |
| 开始沉淀的pH | 1.1 | 6.5 | 3.5 | 7.1 |
| 沉淀完全的pH | 3.2 | 9.7 | 4.7 | 9.2 |
(1)Ni2O3中Ni元素的化合价为
(2)“酸浸”后的酸性溶液中加入H2O2的目的是
(3)“沉镍”前需加Na2CO3控制溶液pH范围为
(4)“氧化”时生成Ni2O3的离子方程式为
(5)工业上用镍为阳极,电解0.05~0.1 mol·L-1 NiCl2溶液与一定量NH4Cl组成的混合溶液,可得到高纯度、球形的超细镍粉。当其他条件一定时,NH4Cl的浓度对阴极电流效率及镍的成粉率的影响如图所示,则NH4Cl的浓度最好控制为

您最近一年使用:0次
2021-11-24更新
|
594次组卷
|
3卷引用:广西北海市2021-2022学年高三上学期第一次化学模拟考试理综化学试题
解题方法
6 . 利用所学化学知识积极探索资源的有效使用、节约使用和循环使用,以实现循环经济和可持续发展,从而实现废弃物的综合利用和保护环境。实验室利用废旧电池的铜帽(主要成分为Cu、Zn)制备 的部分实验步骤如图:
的部分实验步骤如图:

下列说法错误的是
 的部分实验步骤如图:
的部分实验步骤如图:
下列说法错误的是
| A.“溶解I”中,为加快溶解速率,可将铜帽粉碎 |
| B.“滤液I”中,溶质的主要成分为ZnSO4 |
| C.“溶解II”过程中,有大量的气体产生 |
| D.“操作I”需要用到酒精灯、玻璃棒等仪器 |
您最近一年使用:0次
2021-09-09更新
|
222次组卷
|
3卷引用:广西来宾市2020届高三5月教学质量诊断性联合考试理综化学试题
名校
7 . 高纯六水氯化锶晶体(SrCl2·6H2O)可作有机合成的催化剂。工业上用难溶于水的碳酸锶(SrCO3)粉末为原料(含少量BaCO3、FeO、 SiO2等杂质)制备高纯六水氯化锶晶体(SrCl2·6H2O),其过程如图所示。

已知:
I.25℃,Ksp[Fe(OH)3]=1.0×10-38,Ksp[Fe(OH)2]=1.0×10-16
II.SrCl2·6H2O 晶体在61 ℃时开始失去结晶水。
请回答:
(1)天青石(主要成分SrSO4)经过多步反应后可制得工业碳酸锶。其中第一步是与过量焦炭隔绝空气微波加热还原为硫化锶,该过程的化学方程式为___________ 。
(2)步骤①中将工业碳酸锶粉碎制成浆液能加快反应速率的原因是___________ 。
(3)在“浆液”中加入工业盐酸,测得锶的浸出率与温度、时间的关系如图所示:

据此合适的工业生产条件为___________ 。
(4)步骤③所得滤渣的主要成分除Fe(OH)3外,还有___________ (填化学式); 25℃,为使Fe3+沉淀完全需调节溶液pH值最小为___________ (当离子浓度减小至1.0×10-5mol/L时,可认为沉淀完全)。
(5)关于上述流程中各步骤的说法,正确的是___________ (填标号)。
A.步骤④用60℃的热水浴加热蒸发至有晶膜出现
B.步骤④冷却结晶过程中应通入HCl气体
C.步骤⑤干燥SrCl2·6H2O晶体可以采用减压干燥
(6)若需进一步获得无水氯化锶,必须对SrCl2·6H2O(M=267g·mol-1)进行脱水。脱水过程采用烘干法在170℃下预脱水,失重达33.7%,此时获得的产物化学式为___________ 。

已知:
I.25℃,Ksp[Fe(OH)3]=1.0×10-38,Ksp[Fe(OH)2]=1.0×10-16
II.SrCl2·6H2O 晶体在61 ℃时开始失去结晶水。
请回答:
(1)天青石(主要成分SrSO4)经过多步反应后可制得工业碳酸锶。其中第一步是与过量焦炭隔绝空气微波加热还原为硫化锶,该过程的化学方程式为
(2)步骤①中将工业碳酸锶粉碎制成浆液能加快反应速率的原因是
(3)在“浆液”中加入工业盐酸,测得锶的浸出率与温度、时间的关系如图所示:

据此合适的工业生产条件为
(4)步骤③所得滤渣的主要成分除Fe(OH)3外,还有
(5)关于上述流程中各步骤的说法,正确的是
A.步骤④用60℃的热水浴加热蒸发至有晶膜出现
B.步骤④冷却结晶过程中应通入HCl气体
C.步骤⑤干燥SrCl2·6H2O晶体可以采用减压干燥
(6)若需进一步获得无水氯化锶,必须对SrCl2·6H2O(M=267g·mol-1)进行脱水。脱水过程采用烘干法在170℃下预脱水,失重达33.7%,此时获得的产物化学式为
您最近一年使用:0次
名校
解题方法
8 . 氧化铈(CeO2)是一种应用非常广泛稀土氧化物。现以氟碳铈矿(含CeFCO3、BaO、SiO2等)为原料制备氧化铈,其工艺流程如图所示:
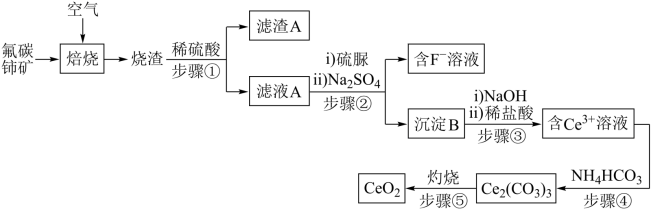
已知:①Ce3+易和SO 形成复盐沉淀:Ce2(SO4)3+Na2SO4+nH2O=Ce2(SO4)3·Na2SO4·nH2O↓(复盐沉淀);
形成复盐沉淀:Ce2(SO4)3+Na2SO4+nH2O=Ce2(SO4)3·Na2SO4·nH2O↓(复盐沉淀);
②硫脲:(分子式为SCN2H4),具有还原性,酸性条件下易被氧化为(SCN2H3)2;
③Ce3+在空气中易被氧化为Ce4+;
回答下列问题:
(1)焙烧时,为了提高焙烧效率,可采取的措施有_______ (任写一条)。
(2)滤渣A的主要成分是_______ 、_______ 。
(3)焙烧后加入稀硫酸浸出,Ce的浸出率和稀硫酸浓度、温度有关,其关系如图所示,应选择的适宜的条件为_______ (填序号)
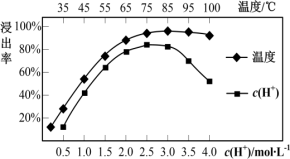
A. 65℃ 2.0mol/L B. 75℃ 2.0mol/L C. 85℃ 2.5mol/L D.100℃ 2.5mol/L
硫酸浓度过大时,浸出率降低的原因是_______ 。
(4)加入硫脲的目的是将Ce4+还原为Ce3+,反应的化学方程式为_______ 。
(5)步骤③加入盐酸后,通常还需加入H2O2,其主要目的为_______ 。
(6)步骤④的离子方程式为_______ 。
(7)铈元素( )常见有
)常见有 、
、 两种价态。
两种价态。 可以被含
可以被含 的溶液吸收,生成含有Ce3+和
的溶液吸收,生成含有Ce3+和 的吸收液。现采用电解法将上述吸收液中的
的吸收液。现采用电解法将上述吸收液中的 转化为无毒物质,同时再生
转化为无毒物质,同时再生 ,其原理如图所示。
,其原理如图所示。

① 从电解槽的
从电解槽的_______ (填字母代号)口流出。
②写出阴极的电极反应式:_______ 。

已知:①Ce3+易和SO
 形成复盐沉淀:Ce2(SO4)3+Na2SO4+nH2O=Ce2(SO4)3·Na2SO4·nH2O↓(复盐沉淀);
形成复盐沉淀:Ce2(SO4)3+Na2SO4+nH2O=Ce2(SO4)3·Na2SO4·nH2O↓(复盐沉淀);②硫脲:(分子式为SCN2H4),具有还原性,酸性条件下易被氧化为(SCN2H3)2;
③Ce3+在空气中易被氧化为Ce4+;
回答下列问题:
(1)焙烧时,为了提高焙烧效率,可采取的措施有
(2)滤渣A的主要成分是
(3)焙烧后加入稀硫酸浸出,Ce的浸出率和稀硫酸浓度、温度有关,其关系如图所示,应选择的适宜的条件为

A. 65℃ 2.0mol/L B. 75℃ 2.0mol/L C. 85℃ 2.5mol/L D.100℃ 2.5mol/L
硫酸浓度过大时,浸出率降低的原因是
(4)加入硫脲的目的是将Ce4+还原为Ce3+,反应的化学方程式为
(5)步骤③加入盐酸后,通常还需加入H2O2,其主要目的为
(6)步骤④的离子方程式为
(7)铈元素(
 )常见有
)常见有 、
、 两种价态。
两种价态。 可以被含
可以被含 的溶液吸收,生成含有Ce3+和
的溶液吸收,生成含有Ce3+和 的吸收液。现采用电解法将上述吸收液中的
的吸收液。现采用电解法将上述吸收液中的 转化为无毒物质,同时再生
转化为无毒物质,同时再生 ,其原理如图所示。
,其原理如图所示。
①
 从电解槽的
从电解槽的②写出阴极的电极反应式:
您最近一年使用:0次
解题方法
9 . 氯化钡是重要的化工原料,是制备其他钡盐的主要中间原料,以毒重石(主要成分为BaCO3,还含有SiO2及含Ca、Mg、Fe、Al的化合物)为原料制备BaCl2·2H2O的工艺流程如下:
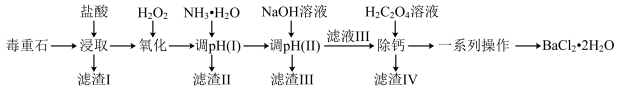
已知:盐酸“浸取”后,Ca、Mg、Fe、Al元素分别以Ca2+、Mg2+、Fe2+、Al3+形式存在于溶液中。
回答下列问题:
(1)在“浸取”时,除温度、酸的浓度、液固比等因素影响钡的浸出率外,还有_______ 因素。
(2)下表列举了不同温度、盐酸的浓度、液固比下钡的浸出率实验数据,每个实验只改变一个条件:
分析表中数据,温度越高钡的浸出率越低的可能原因是_______ ;判断“浸取”的最佳液固比为_______ 。
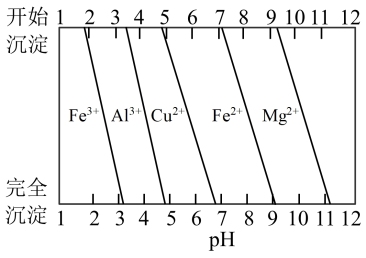
(3)常温时,几种金属离子沉淀的pH如图所示,加H2O2时发生反应的离子方程式为_______ 。“调pH(I)”时,调节溶液pH≈5,则“滤渣II”的主要成分为_______ (填化学式)。
(4)“一系列操作”中洗涤晶体时,通常采用乙醇洗而不采用水洗,原因是_______ 。
(5)“除钙”前,需测定溶液中钙离子的含量,从而确定加入草酸的量,测钙离子含量的操作为取“滤液III”V1mL,加入稍过量的铬酸钾,使钡离子完全沉淀,过滤,将滤液转入250mL容量瓶后再加水定容,取其中25. 00 mL于锥形瓶中,用NaOH溶液将pH调为13,加入黄绿素作指示剂(黄绿素溶液为红色,能与钙离子形成络合物使溶液呈黄绿色) ,用0.100 mol·L-1的标准EDTA溶液滴定(EDTA能与Ca2+以1: 1形成无色络合物)至终点,消耗标准EDTA溶液V2 mL。
①滴定至终点时的现象为_______ 。
②该溶液中钙离子的浓度为_______ (用含 V1、V2的代数式表示)g·mL-1。

已知:盐酸“浸取”后,Ca、Mg、Fe、Al元素分别以Ca2+、Mg2+、Fe2+、Al3+形式存在于溶液中。
回答下列问题:
(1)在“浸取”时,除温度、酸的浓度、液固比等因素影响钡的浸出率外,还有
(2)下表列举了不同温度、盐酸的浓度、液固比下钡的浸出率实验数据,每个实验只改变一个条件:
| 改变的条件 | 温度(℃) | 盐酸的浓度(%) | 液固比 | ||||||||||
| 30 | 55 | 75 | 10 | 15 | 20 | 25。 | 3:1 | 4:1 | 5:1 | 6:1 | |||
| 钡的浸出率(%) | 74.31 | 69.60 | 68.42 | 59.21 | 74.31 | 74.15 | 55.32 | 59.84 | 65.12 | 74.31 | 74.35 | ||
分析表中数据,温度越高钡的浸出率越低的可能原因是
(3)常温时,几种金属离子沉淀的pH如图所示,加H2O2时发生反应的离子方程式为

(4)“一系列操作”中洗涤晶体时,通常采用乙醇洗而不采用水洗,原因是
(5)“除钙”前,需测定溶液中钙离子的含量,从而确定加入草酸的量,测钙离子含量的操作为取“滤液III”V1mL,加入稍过量的铬酸钾,使钡离子完全沉淀,过滤,将滤液转入250mL容量瓶后再加水定容,取其中25. 00 mL于锥形瓶中,用NaOH溶液将pH调为13,加入黄绿素作指示剂(黄绿素溶液为红色,能与钙离子形成络合物使溶液呈黄绿色) ,用0.100 mol·L-1的标准EDTA溶液滴定(EDTA能与Ca2+以1: 1形成无色络合物)至终点,消耗标准EDTA溶液V2 mL。
①滴定至终点时的现象为
②该溶液中钙离子的浓度为
您最近一年使用:0次
解题方法
10 . 2020年初比亚迪汉EV和特斯拉Model3均搭载了磷酸亚铁锂(LiFePO4)电池组。某企业设计了磷酸亚铁锂电池正极生产和回收的工艺流程如图:

已知:①Ksp[Fe(OH)3]=10-39;②Li2CO3的溶解度:0℃为1.54g,100℃为0.72g。
(1)反应釜中反应的化学方程式为___ 。
(2)获得LiH2PO4晶体的分离操作是___ ,反应器中加入C的目的是____ 。
(3)写出一条可以提高“碱浸”效率的措施___ 。
(4)向滤液1中加入过量CO2可得到白色胶状物质,该反应的离子方程式为__ 。
(5)“酸浸”时若用HNO3代替H2O2,缺点是____ ,若“沉铁"后溶液中c(Fe3+)=10-6mol·L-1,则该过程应调节pH=___ ,“沉锂”时,所得Li2CO3应选择___ (“冷水”或“热水")进行洗涤;从滤渣2中可以回收循环利用___ (填化学式)。

已知:①Ksp[Fe(OH)3]=10-39;②Li2CO3的溶解度:0℃为1.54g,100℃为0.72g。
(1)反应釜中反应的化学方程式为
(2)获得LiH2PO4晶体的分离操作是
(3)写出一条可以提高“碱浸”效率的措施
(4)向滤液1中加入过量CO2可得到白色胶状物质,该反应的离子方程式为
(5)“酸浸”时若用HNO3代替H2O2,缺点是
您最近一年使用:0次



