名校
解题方法
1 . 铁是人体必需的微量元素,铁摄入不足可能引起缺铁性贫血。日常生活中可通过食物摄入铁元素,例如黑木耳中就含有比较丰富的铁元素。某研究性学习小组为测定某地黑木耳中铁的含量,开展了如下研究与实践活动。
【研究与实践活动一】
研究黑木耳中含铁物质的水溶性:称取a g黑木耳,洗净切碎,用蒸馏水浸泡后取浸泡液进行铁元素检测,结果未能检测到铁元素。
【研究与实践活动二】
研究黑木耳中铁的含量:称取a g黑木耳,高温灼烧使之完全灰化,按如下流程对得到的黑木耳灰进行处理。
(1)浸泡液中未能检测到铁元素,说明黑木耳中的含铁物质___________ 溶于水(选填“能”或“不能”)。
(2)取少量滤液于试管中,滴入KSCN溶液,溶液变红。则滤液中铁元素的存在形式有 、
、___________ (填离子符号)。
(3)滤液与Fe生成A的离子方程式是___________ 。
(4)由A转化为B可加入的试剂X可以是___________ (填字母)
a. (
( ) b.
) b. c.
c.
(5)由C转化成D的现象是:白色沉淀迅速变为灰绿色,最终变为___________ 。
(6)将a g黑木耳中的铁元素经流程A→C-D进行完全转化,将D经过一系列处理,得到b g红棕色固体。若流程中加入的铁反应掉c g,则该黑木耳中铁元素的质量分数为___________ (用含a、b、c的代数式表示)。
【研究与实践活动一】
研究黑木耳中含铁物质的水溶性:称取a g黑木耳,洗净切碎,用蒸馏水浸泡后取浸泡液进行铁元素检测,结果未能检测到铁元素。
【研究与实践活动二】
研究黑木耳中铁的含量:称取a g黑木耳,高温灼烧使之完全灰化,按如下流程对得到的黑木耳灰进行处理。

(1)浸泡液中未能检测到铁元素,说明黑木耳中的含铁物质
(2)取少量滤液于试管中,滴入KSCN溶液,溶液变红。则滤液中铁元素的存在形式有
 、
、(3)滤液与Fe生成A的离子方程式是
(4)由A转化为B可加入的试剂X可以是
a.
 (
( ) b.
) b. c.
c.
(5)由C转化成D的现象是:白色沉淀迅速变为灰绿色,最终变为
(6)将a g黑木耳中的铁元素经流程A→C-D进行完全转化,将D经过一系列处理,得到b g红棕色固体。若流程中加入的铁反应掉c g,则该黑木耳中铁元素的质量分数为
您最近一年使用:0次
2023-09-20更新
|
244次组卷
|
2卷引用:湖南省怀化市第一中高一2023-2024学年高一上学期11月月考化学试题
名校
2 . 钛是航空、军工、电力等领域的重要原材料。地壳中的含钛矿石之一是金红石( ),其是冶炼钛的重要原料。生产钛的工艺流程如图:
),其是冶炼钛的重要原料。生产钛的工艺流程如图:

已知:①常温下,钛既不与常见非金属单质反应,也不与强酸反应;
②加热时,钛可以和常见的非金属单质反应。
(1)在反应I中:
①下列有关CO的说法正确的是_______ (填标号)。
A.属于酸性氧化物 B.摩尔质量为28 C.为可燃性气体 D.具有还原性
②反应I的化学方程式为_______ ,该反应中氧化剂与还原剂的质量之比为_______ 。
③每转移0.2mol电子,同时生成CO的体积为_______ (标准状况下)。
(2)在反应II中:
①氩气的作用为_______ 。
②该反应的基本反应类型为_______ 。
(3)为了测定反应II制得的金属钛(杂质仅含Mg)中的钛元素含量。常温下,取mg反应II制得的金属钛置于烧杯中,往烧杯中逐滴滴入物质的量浓度为 的稀硫酸,当不再出现气泡时,共消耗VmL稀硫酸:
的稀硫酸,当不再出现气泡时,共消耗VmL稀硫酸:
①上述反应的离子方程式为_______ 。
②金属钛的质量分数为_______ (用含m、c、V的代数式表示)。
 ),其是冶炼钛的重要原料。生产钛的工艺流程如图:
),其是冶炼钛的重要原料。生产钛的工艺流程如图:
已知:①常温下,钛既不与常见非金属单质反应,也不与强酸反应;
②加热时,钛可以和常见的非金属单质反应。
(1)在反应I中:
①下列有关CO的说法正确的是
A.属于酸性氧化物 B.摩尔质量为28 C.为可燃性气体 D.具有还原性
②反应I的化学方程式为
③每转移0.2mol电子,同时生成CO的体积为
(2)在反应II中:
①氩气的作用为
②该反应的基本反应类型为
(3)为了测定反应II制得的金属钛(杂质仅含Mg)中的钛元素含量。常温下,取mg反应II制得的金属钛置于烧杯中,往烧杯中逐滴滴入物质的量浓度为
 的稀硫酸,当不再出现气泡时,共消耗VmL稀硫酸:
的稀硫酸,当不再出现气泡时,共消耗VmL稀硫酸:①上述反应的离子方程式为
②金属钛的质量分数为
您最近一年使用:0次
2023-01-11更新
|
288次组卷
|
7卷引用:湖南省湘潭市2022-2023学年高一上学期1月期末考试化学试题
名校
解题方法
3 . 某实验小组欲利用如下装置以焦炭、氯气与 为原料在高温下制备
为原料在高温下制备 ,反应原理为:
,反应原理为: 。已知
。已知 是一种易水解生成
是一种易水解生成 的无色液体,沸点为136.41℃。
的无色液体,沸点为136.41℃。

(1)A装置中所用试剂不合理,原因是_______ ,反应开始前持续通入A装置中产生的 气体,目的是
气体,目的是_______ ;干燥剂X可选用_______ (填标号)。
A.碱石灰 B. C.无水
C.无水 D.
D.
(2)C处弯管的作用是_______ ;干燥管F中盛放碱石灰,结合实验原理和反应过程,分析G装置中 溶液的作用是
溶液的作用是_______ 。
(3)写出B装置中反应的离子方程式_______ ;干燥管F去掉,写出E装置中发生反应的化学方程式_______ 。
(4) 可利用钛铁矿(主要成分为
可利用钛铁矿(主要成分为 )进行制备,该实验小组欲利用下列方法测定某钛铁矿中钛元素的含量。取该钛铁矿mg,研碎后用适量浓硫酸加热溶浸,溶浸后过滤得到“钛液”,冷却后将“钛液”加水稀释到amL,加入过量铝粉,振荡使其完全反应
)进行制备,该实验小组欲利用下列方法测定某钛铁矿中钛元素的含量。取该钛铁矿mg,研碎后用适量浓硫酸加热溶浸,溶浸后过滤得到“钛液”,冷却后将“钛液”加水稀释到amL,加入过量铝粉,振荡使其完全反应 ,忽略溶液体积变化,过滤后取出滤液
,忽略溶液体积变化,过滤后取出滤液 ,滴加2滴KSCN溶液,用
,滴加2滴KSCN溶液,用 溶液滴定
溶液滴定 ,滴定至终点时消耗
,滴定至终点时消耗 溶液,滴定终点的现象是
溶液,滴定终点的现象是_______ ,该钛铁矿中钛元素的质量分数为_______ %。
 为原料在高温下制备
为原料在高温下制备 ,反应原理为:
,反应原理为: 。已知
。已知 是一种易水解生成
是一种易水解生成 的无色液体,沸点为136.41℃。
的无色液体,沸点为136.41℃。
(1)A装置中所用试剂不合理,原因是
 气体,目的是
气体,目的是A.碱石灰 B.
 C.无水
C.无水 D.
D.
(2)C处弯管的作用是
 溶液的作用是
溶液的作用是(3)写出B装置中反应的离子方程式
(4)
 可利用钛铁矿(主要成分为
可利用钛铁矿(主要成分为 )进行制备,该实验小组欲利用下列方法测定某钛铁矿中钛元素的含量。取该钛铁矿mg,研碎后用适量浓硫酸加热溶浸,溶浸后过滤得到“钛液”,冷却后将“钛液”加水稀释到amL,加入过量铝粉,振荡使其完全反应
)进行制备,该实验小组欲利用下列方法测定某钛铁矿中钛元素的含量。取该钛铁矿mg,研碎后用适量浓硫酸加热溶浸,溶浸后过滤得到“钛液”,冷却后将“钛液”加水稀释到amL,加入过量铝粉,振荡使其完全反应 ,忽略溶液体积变化,过滤后取出滤液
,忽略溶液体积变化,过滤后取出滤液 ,滴加2滴KSCN溶液,用
,滴加2滴KSCN溶液,用 溶液滴定
溶液滴定 ,滴定至终点时消耗
,滴定至终点时消耗 溶液,滴定终点的现象是
溶液,滴定终点的现象是
您最近一年使用:0次
名校
4 . 碳酸钙(CaCO3)是地球上常见物质之一,是石灰石等的主要成分,用途甚广。
Ⅰ.牙膏主要由摩擦剂和一些可溶于水的物质组成。某牙膏摩擦剂的成分仅为CaCO3和SiO2,为测定该牙膏中CaCO3的含量,某化学兴趣小组设计如下实验。
①配制1mol∙L-1稀盐酸和1mol∙L-1NaOH溶液。
②称取6.0g该牙膏,溶于水并稀释至30mL,过滤。
③用1mol∙L-1NaOH溶液中和过量的稀盐酸,记录所消耗氢氧化钠溶液的体积。
④对反应后的混合物进行过滤。
⑤将滤渣加入60mL1mol∙L-1稀盐酸中,充分反应。
已知:SiO2不溶于水也不溶于稀盐酸。
(1)正确的实验操作顺序为①_______ (填标号)。
(2)③中发生反应的离子方程式为_______ ;④中过滤所得的滤渣中含有的_______ (填化学式)为该牙膏中摩擦剂的成分之一,该物质属于_______ (填“酸”、“碱”、“盐”、“酸性氧化物”或“碱性氧化物”)。
(3)该实验需称量4次6.0g牙膏进行4次测定,若实验室现有250mL、500mL、1L等几种规格的容量瓶,在本实验中溶液均只配制一次的情况下,应选规格为_______ 的容量瓶配制NaOH溶液。
(4)某同学共称量了4次6.0g该牙膏进行了4次测定,所消耗NaOH溶液的体积记录如下。
则测得该牙膏中碳酸钙的质量分数约为_______ (保留三位有效数字)%。
Ⅱ.石灰石主要成分为碳酸钙(杂质不溶于酸),甲同学设计了如下实验方案制备并提纯碳酸钙。
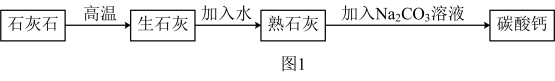
(5)熟石灰与Na2CO3溶液反应的化学方程式为:_______ 。
(6)参照图1,另设计实验提纯碳酸钙(如图2)。_______ 。(提供试剂:稀盐酸和Na2CO3溶液)

Ⅰ.牙膏主要由摩擦剂和一些可溶于水的物质组成。某牙膏摩擦剂的成分仅为CaCO3和SiO2,为测定该牙膏中CaCO3的含量,某化学兴趣小组设计如下实验。
①配制1mol∙L-1稀盐酸和1mol∙L-1NaOH溶液。
②称取6.0g该牙膏,溶于水并稀释至30mL,过滤。
③用1mol∙L-1NaOH溶液中和过量的稀盐酸,记录所消耗氢氧化钠溶液的体积。
④对反应后的混合物进行过滤。
⑤将滤渣加入60mL1mol∙L-1稀盐酸中,充分反应。
已知:SiO2不溶于水也不溶于稀盐酸。
(1)正确的实验操作顺序为①
(2)③中发生反应的离子方程式为
(3)该实验需称量4次6.0g牙膏进行4次测定,若实验室现有250mL、500mL、1L等几种规格的容量瓶,在本实验中溶液均只配制一次的情况下,应选规格为
(4)某同学共称量了4次6.0g该牙膏进行了4次测定,所消耗NaOH溶液的体积记录如下。
| 实验编号 | 1 | 2 | 3 | 4 |
 | 10.1 | 9.9 | 10.2 | 9.8 |
Ⅱ.石灰石主要成分为碳酸钙(杂质不溶于酸),甲同学设计了如下实验方案制备并提纯碳酸钙。

(5)熟石灰与Na2CO3溶液反应的化学方程式为:
(6)参照图1,另设计实验提纯碳酸钙(如图2)。

您最近一年使用:0次
2022-11-11更新
|
142次组卷
|
2卷引用:湖南省金太阳联考2022-2023学年高一上学期期中考试化学试题
名校
解题方法
5 . 透明铁黄(FeOOH)是一种分散性良好的铁系颜料。工业上采用硫铁矿熔烧去硫后烧渣(主要成分为 、FeO、
、FeO、 、
、 、不考虑其他杂质)制备透明铁黄工艺流程如下:
、不考虑其他杂质)制备透明铁黄工艺流程如下:
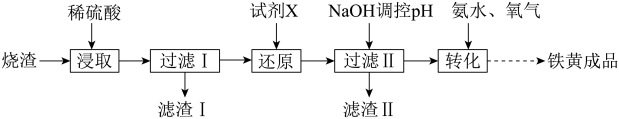
(1)浸取液中 的核外电子排布式为
的核外电子排布式为_______ 。
(2)“过滤I”后,滤液中所含金属阳离子有_______ 。
(3)“还原”时,试剂X若选用铁粉,则该反应的离子方程式为_______ 。
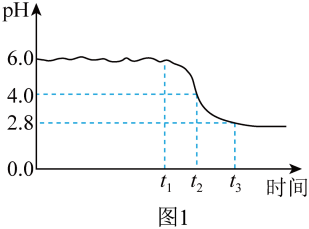
(4)制备铁黄:向一定浓度 溶液中加入氨水,当滴加氨水至pH为6.0时,停止滴加氨水,开始通氧气,生成铁黄。通入氧气过程中,记录溶液pH变化如图1所示。
溶液中加入氨水,当滴加氨水至pH为6.0时,停止滴加氨水,开始通氧气,生成铁黄。通入氧气过程中,记录溶液pH变化如图1所示。
已知:25℃时, 完全沉淀(离子浓度
完全沉淀(离子浓度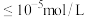 )的
)的 。
。
①滴加氨水产生沉淀,当pH为6.0时,溶液中残留 浓度为
浓度为_______ mol/L。
②请写出0~ 时段发生的化学方程式
时段发生的化学方程式_______ ; ~
~ 时段,溶液pH明显降低,请解释原因:
时段,溶液pH明显降低,请解释原因:_______ 。
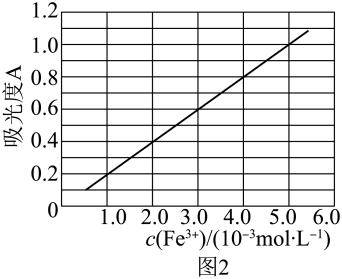
(5)制得的透明铁黄中往往混有氧化铁,可用分光光度法测定透明铁黄的含量。已知 的吸光度A(对特定波长光的吸收程度)与
的吸光度A(对特定波长光的吸收程度)与 标准溶液浓度的关系如图-2所示。称取3.47g样品,用稀硫酸溶解并定容至1L,准确移取该溶液10.00 mL,加入足量KSCN溶液,再用蒸馏水定容至100 mL。测得溶液吸光度A=0.8,计算样品中FeOOH的质量分数(写出主要计算过程)。
标准溶液浓度的关系如图-2所示。称取3.47g样品,用稀硫酸溶解并定容至1L,准确移取该溶液10.00 mL,加入足量KSCN溶液,再用蒸馏水定容至100 mL。测得溶液吸光度A=0.8,计算样品中FeOOH的质量分数(写出主要计算过程)。_______
 、FeO、
、FeO、 、
、 、不考虑其他杂质)制备透明铁黄工艺流程如下:
、不考虑其他杂质)制备透明铁黄工艺流程如下:
(1)浸取液中
 的核外电子排布式为
的核外电子排布式为(2)“过滤I”后,滤液中所含金属阳离子有
(3)“还原”时,试剂X若选用铁粉,则该反应的离子方程式为
(4)制备铁黄:向一定浓度
 溶液中加入氨水,当滴加氨水至pH为6.0时,停止滴加氨水,开始通氧气,生成铁黄。通入氧气过程中,记录溶液pH变化如图1所示。
溶液中加入氨水,当滴加氨水至pH为6.0时,停止滴加氨水,开始通氧气,生成铁黄。通入氧气过程中,记录溶液pH变化如图1所示。
已知:25℃时,
 完全沉淀(离子浓度
完全沉淀(离子浓度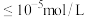 )的
)的 。
。①滴加氨水产生沉淀,当pH为6.0时,溶液中残留
 浓度为
浓度为②请写出0~
 时段发生的化学方程式
时段发生的化学方程式 ~
~ 时段,溶液pH明显降低,请解释原因:
时段,溶液pH明显降低,请解释原因:(5)制得的透明铁黄中往往混有氧化铁,可用分光光度法测定透明铁黄的含量。已知
 的吸光度A(对特定波长光的吸收程度)与
的吸光度A(对特定波长光的吸收程度)与 标准溶液浓度的关系如图-2所示。称取3.47g样品,用稀硫酸溶解并定容至1L,准确移取该溶液10.00 mL,加入足量KSCN溶液,再用蒸馏水定容至100 mL。测得溶液吸光度A=0.8,计算样品中FeOOH的质量分数(写出主要计算过程)。
标准溶液浓度的关系如图-2所示。称取3.47g样品,用稀硫酸溶解并定容至1L,准确移取该溶液10.00 mL,加入足量KSCN溶液,再用蒸馏水定容至100 mL。测得溶液吸光度A=0.8,计算样品中FeOOH的质量分数(写出主要计算过程)。
您最近一年使用:0次
2022-09-03更新
|
282次组卷
|
3卷引用:湖南省常德市汉寿县第一中学2023-2024学年高三上学期12月期中化学试题
名校
解题方法
6 . 过-硫酸氢钾复合盐(K2SO4·KHSO4·2KHSO5,M=614 g·mol-1)是白色粉末状固体,具有强氧化性,易溶于水,当溶液pH大于3.0时分解。实验室制取该物质的实验步骤如下:
①制取过-硫酸(H2SO5) :先在三颈烧瓶中加入吸附型双氧水稳定剂,然后加入冷的双氧水和过量的浓硫酸,pH控制在2. 0~2.5,反应30 min(反应装置如图所示);
②过-硫酸氢钾复合盐的制备:向①中反应后的溶液中加入碳酸钾溶液,边加边搅拌,碳酸钾溶液滴加完毕后,反应30min,将反应后的混合液转移至烧杯中,在-10°C条件下冷却结晶后,将混合液转移到抽滤瓶中抽滤,得到滤饼,将滤饼置于电热鼓风干燥箱中烘干,得到产品过-硫酸氢钾复合盐。
(1)装置a的名称是_______ ,用冷的双氧水的原因是_______ 。向三颈烧瓶中加入双氧水和浓硫酸的操作:_______ 。
(2)写出加入碳酸钾溶液时发生反应生成复合盐和KHSO4的化学方程式:_______ 。
(3)步骤②中加入碳酸钾溶液时,应控制加入速度,边加边搅拌的目的是_______ 。
(4)一种简单鉴别市售过-硫酸氢钾复合盐是否合格的方法:把一片过-硫酸氢钾片剂放入装有适量稀盐酸的烧杯中,若很快就可以明显闻到有刺激性气味且持续一定时间,可以证明产品的氧化性很好,从而证明这是合格的过-硫酸氢钾复合盐产品。这种方法的原理是_______ (用离子方程式表示)。
(5)间接碘量法测定产品活性氧(一个活性氧可得到2e-)含量。
检测原理:2KHSO5 =K2SO4+H2SO4+O2↑
4I-+4H+ +O2=2I2+2H2O
I2+2S2O =S4O
=S4O +2I-
+2I-
量取75 mL蒸馏水于碘量瓶中,加入适量的稀硫酸和过量的碘化钾溶液,称取a g产品于碘量瓶中摇匀。暗处放置5 min后,用c mol·L-1的标准硫代硫酸钠溶液滴定,终点时消耗的体积为V mL,则样品中活性氧的质量分数是_______ 。
①制取过-硫酸(H2SO5) :先在三颈烧瓶中加入吸附型双氧水稳定剂,然后加入冷的双氧水和过量的浓硫酸,pH控制在2. 0~2.5,反应30 min(反应装置如图所示);
②过-硫酸氢钾复合盐的制备:向①中反应后的溶液中加入碳酸钾溶液,边加边搅拌,碳酸钾溶液滴加完毕后,反应30min,将反应后的混合液转移至烧杯中,在-10°C条件下冷却结晶后,将混合液转移到抽滤瓶中抽滤,得到滤饼,将滤饼置于电热鼓风干燥箱中烘干,得到产品过-硫酸氢钾复合盐。

(1)装置a的名称是
(2)写出加入碳酸钾溶液时发生反应生成复合盐和KHSO4的化学方程式:
(3)步骤②中加入碳酸钾溶液时,应控制加入速度,边加边搅拌的目的是
(4)一种简单鉴别市售过-硫酸氢钾复合盐是否合格的方法:把一片过-硫酸氢钾片剂放入装有适量稀盐酸的烧杯中,若很快就可以明显闻到有刺激性气味且持续一定时间,可以证明产品的氧化性很好,从而证明这是合格的过-硫酸氢钾复合盐产品。这种方法的原理是
(5)间接碘量法测定产品活性氧(一个活性氧可得到2e-)含量。
检测原理:2KHSO5 =K2SO4+H2SO4+O2↑
4I-+4H+ +O2=2I2+2H2O
I2+2S2O
 =S4O
=S4O +2I-
+2I-量取75 mL蒸馏水于碘量瓶中,加入适量的稀硫酸和过量的碘化钾溶液,称取a g产品于碘量瓶中摇匀。暗处放置5 min后,用c mol·L-1的标准硫代硫酸钠溶液滴定,终点时消耗的体积为V mL,则样品中活性氧的质量分数是
您最近一年使用:0次
2022-04-11更新
|
323次组卷
|
3卷引用:湖南省怀化市沅陵县第二中学2021-2022学年高三下学期四月第一次调研考试化学试题
名校
7 . 在实验中通常用滴定法测量物质的浓度或进行定量实验。
(1)用氧化还原滴定法测定某样品中草酸的含量。称量草酸H2C2O4样品1.0000g并溶于水,用0.200mol·L-1的酸性KMnO4溶液进行滴定,终点时消耗KMnO4标准溶液20.00mL(假设样品中杂质不与酸性KMnO4溶液反应)。
①滴定过程中发生反应的离子方程式为_______ 。
②滴定时_______ (填“需要”或“不需要”)使用指示剂。
③高锰酸钾溶液用_______ (填“酸式”或“碱式”)滴定管盛放。
④样品中草酸的质量分数是_______ 。
(2)某小组同学为了测定某中性溶液中Cl-的含量,用AgNO3溶液进行滴定。
下列物质能用作指示剂的是_______ (填物质名称)。
①K2CrO4②Na2S ③KI ④KBr
达到滴定终点的实验现象为_______ 。
(3)25° C时,向NaHA溶液中滴入盐酸,混合溶液的pH与粒子浓度变化的关系如图所示,则HA- +H2O H2A+OH-的水解平衡常数为
H2A+OH-的水解平衡常数为_______ 。

(1)用氧化还原滴定法测定某样品中草酸的含量。称量草酸H2C2O4样品1.0000g并溶于水,用0.200mol·L-1的酸性KMnO4溶液进行滴定,终点时消耗KMnO4标准溶液20.00mL(假设样品中杂质不与酸性KMnO4溶液反应)。
①滴定过程中发生反应的离子方程式为
②滴定时
③高锰酸钾溶液用
④样品中草酸的质量分数是
(2)某小组同学为了测定某中性溶液中Cl-的含量,用AgNO3溶液进行滴定。
| 物质 | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
| Ksp | 2×10-10 | 5.4×10-13 | 8.3×10-17 | 6.3×10-50 | 1.12×10-12 |
| 颜色 | 白色 | 淡黄色 | 黄色 | 黑色 | 砖红色 |
①K2CrO4②Na2S ③KI ④KBr
达到滴定终点的实验现象为
(3)25° C时,向NaHA溶液中滴入盐酸,混合溶液的pH与粒子浓度变化的关系如图所示,则HA- +H2O
 H2A+OH-的水解平衡常数为
H2A+OH-的水解平衡常数为
您最近一年使用:0次
2022-05-04更新
|
201次组卷
|
2卷引用:湖南省长沙市雅礼中学2021-2022学年高二下学期5月月考化学试题
8 . 硫酸铵是常见的氮肥。实验室利用氨气与硫酸为原料制备硫酸铵,并测定产品中硫酸铵的含量,过程如下:
步骤I. 的制备
的制备

步骤II.产品中 含量测定
含量测定
①称取产品2.000g,用蒸馏水溶解,定容于250mL容量瓶中;
②移取25.00mL上述溶液于锥形瓶,加5mL甲醛(HCHO)溶液,放置5min,加1~2滴酚酞,用 标准溶液滴定,消耗标准溶液VmL;
标准溶液滴定,消耗标准溶液VmL;
③平行测定三次,V的平均值为7.40。
已知:

回答下列问题:
(1)实验室利用 和
和 制氨气的化学方程式
制氨气的化学方程式___________ 。
(2)步骤I中“混合”所选用的装置是___________ (填标号)。
(3)步骤II中“放置5min”的目的是___________ 。
(4)步骤II中滴定终点的现象是___________ 。
(5)产品中 的质量分数为
的质量分数为___________ (保留四位有效数字)。
(6)若用含有少量甲酸的甲醛溶液进行实验,其他操作均正确,则 质量分数的计算结果
质量分数的计算结果___________ (填“偏大”或“偏小”),防止出现上述误差的方法是___________ 。
步骤I.
 的制备
的制备
步骤II.产品中
 含量测定
含量测定①称取产品2.000g,用蒸馏水溶解,定容于250mL容量瓶中;
②移取25.00mL上述溶液于锥形瓶,加5mL甲醛(HCHO)溶液,放置5min,加1~2滴酚酞,用
 标准溶液滴定,消耗标准溶液VmL;
标准溶液滴定,消耗标准溶液VmL;③平行测定三次,V的平均值为7.40。
已知:


回答下列问题:
(1)实验室利用
 和
和 制氨气的化学方程式
制氨气的化学方程式(2)步骤I中“混合”所选用的装置是
 |  |  |  |
| A | B | C | D |
(4)步骤II中滴定终点的现象是
(5)产品中
 的质量分数为
的质量分数为(6)若用含有少量甲酸的甲醛溶液进行实验,其他操作均正确,则
 质量分数的计算结果
质量分数的计算结果
您最近一年使用:0次
真题
名校
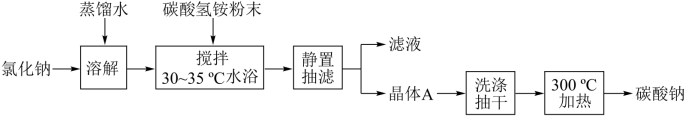
9 . 碳酸钠俗称纯碱,是一种重要的化工原料。以碳酸氢铵和氯化钠为原料制备碳酸钠,并测定产品中少量碳酸氢钠的含量,过程如下:
步骤I. 的制备
的制备
步骤Ⅱ.产品中 含量测定
含量测定
①称取产品2.500g,用蒸馏水溶解,定容于250mL容量瓶中;
②移取25.00mL上述溶液于锥形瓶,加入2滴指示剂M,用 盐酸标准溶液滴定,溶液由红色变至近无色(第一滴定终点),消耗盐酸
盐酸标准溶液滴定,溶液由红色变至近无色(第一滴定终点),消耗盐酸 ;
;
③在上述锥形瓶中再加入2滴指示剂N,继续用 盐酸标准溶液滴定至终点(第二滴定终点),又消耗盐酸
盐酸标准溶液滴定至终点(第二滴定终点),又消耗盐酸 ;
;
④平行测定三次, 平均值为22.45,
平均值为22.45, 平均值为23.51。
平均值为23.51。
已知:(i)当温度超过35℃时, 开始分解。
开始分解。
(ii)相关盐在不同温度下的溶解度表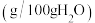
回答下列问题:
(1)步骤I中晶体A的化学式为_______ ,晶体A能够析出的原因是_______ ;
(2)步骤I中“300℃加热”所选用的仪器是_______ (填标号);
A. B.
B. C.
C. D.
D.
(3)指示剂N为_______ ,描述第二滴定终点前后颜色变化_______ ;
(4)产品中 的质量分数为
的质量分数为_______ (保留三位有效数字);
(5)第一滴定终点时,某同学俯视读数,其他操作均正确,则 质量分数的计算结果
质量分数的计算结果_______ (填“偏大”“偏小”或“无影响”)。
步骤I.
 的制备
的制备
步骤Ⅱ.产品中
 含量测定
含量测定①称取产品2.500g,用蒸馏水溶解,定容于250mL容量瓶中;
②移取25.00mL上述溶液于锥形瓶,加入2滴指示剂M,用
 盐酸标准溶液滴定,溶液由红色变至近无色(第一滴定终点),消耗盐酸
盐酸标准溶液滴定,溶液由红色变至近无色(第一滴定终点),消耗盐酸 ;
;③在上述锥形瓶中再加入2滴指示剂N,继续用
 盐酸标准溶液滴定至终点(第二滴定终点),又消耗盐酸
盐酸标准溶液滴定至终点(第二滴定终点),又消耗盐酸 ;
;④平行测定三次,
 平均值为22.45,
平均值为22.45, 平均值为23.51。
平均值为23.51。已知:(i)当温度超过35℃时,
 开始分解。
开始分解。(ii)相关盐在不同温度下的溶解度表
温度/ | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
 | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
 | 11.9 | 15.8 | 21.0 | 27.0 | |||
 | 6.9 | 8.2 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 |
 | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.2 |
(1)步骤I中晶体A的化学式为
(2)步骤I中“300℃加热”所选用的仪器是
A.
 B.
B. C.
C. D.
D.
(3)指示剂N为
(4)产品中
 的质量分数为
的质量分数为(5)第一滴定终点时,某同学俯视读数,其他操作均正确,则
 质量分数的计算结果
质量分数的计算结果
您最近一年使用:0次
2021-06-09更新
|
9057次组卷
|
31卷引用:2021年新高考湖南化学高考真题
2021年新高考湖南化学高考真题2021年湖南省高考化学试卷变式题11-19湖南省常德市汉寿县第一中学2022-2023学年高三上学期第一次月考化学试题(已下线)考向02 物质的量浓度及其相关计算-备战2022年高考化学一轮复习考点微专题(已下线)考点13 钠及其化合物-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点31 化学实验与工艺流程-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)考点13 钠及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)第6讲 钠及其化合物(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)江西省新余市第一中学2021-2022学年高三上学期第二次模拟考试化学试题(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)专题10 化学实验综合—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)押新高考卷16题 化学实验综合题-备战2022年高考化学临考题号押题(新高考通版)(已下线)回归教材重难点08 化学工艺流程分析-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)专题17 化学实验综合题-三年(2020-2022)高考真题分项汇编(已下线)考点13 钠及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第06讲 钠及其化合物(讲)-2023年高考化学一轮复习讲练测(新教材新高考)第三章 综合拔高练(已下线)第28讲 定性、定量实验(练)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)易错点05 钠及其化合物-备战2023年高考化学考试易错题山东省鄄城县第一中学2022-2023学年高二上学期期末考试化学试题辽宁省葫芦岛市兴城市高级中学等四校2022-2023学年高二上学期12月月考化学试题(已下线)专题六 金属元素及其化合物-实战高考·二轮复习核心突破山东省济南市历城第二中学2022-2023学年高二上学期期末线上测试化学试题(已下线)专题26 定量测定类综合性实验题-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)第十章 化学综合实验 第64讲 物质的检测综合实验探究热点1滴定法(已下线)第一部分 化学综合实验 综合提能训练(已下线)考点09 钠及其重要化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)考点13 钠及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)河北省邢台市第一中学2022-2023学年高二上学期期末考试化学试题
10 . 过氧乙酸是具有重要用途的有机合成氧化剂和化工原料,实验室拟合成过氧乙酸并测定其含量。
(1)浓缩
在图示装置(加热装置已省略)中,由分液漏斗向冷凝管1中滴加30% 溶液,最终得到质量分数约68%的
溶液,最终得到质量分数约68%的 溶液。
溶液。
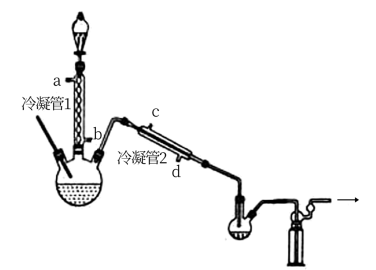
冷凝管1、冷凝管2中进水接口依次为___________ 、___________ (填字母)。
②加热温度不宜超过60℃的原因是___________ 。
(2)合成过氧乙酸
向带有搅拌装置及温度计的500mL三口烧瓶中先加入16g冰醋酸,在搅拌下滴加90g68% 溶液,最后加入4.1mL浓硫酸,搅拌5h,静置20h。
溶液,最后加入4.1mL浓硫酸,搅拌5h,静置20h。
(已知:CH3COOH+H2O2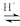
 +H2O)
+H2O)
①用浓缩的68% 溶液代替常见的30%
溶液代替常见的30% 溶液的目的是
溶液的目的是___________ 。
②充分搅拌的目的是___________ 。
(3)过氧乙酸含量的测定
步骤a:称取5.0g过氧乙酸试样(液体),配制成100mL溶液A。
步骤b:在碘量瓶中加入5.0mL 溶液、3滴
溶液、3滴 溶液、5.0mL溶液A,摇匀,用0.01mol/L的
溶液、5.0mL溶液A,摇匀,用0.01mol/L的 溶液滴定至溶液呈微红色。
溶液滴定至溶液呈微红色。
步骤c:向滴定后的溶液中再加1.0gKI( ),摇匀,置于暗处5min,用蒸馏水冲洗瓶盖及四周,加钼酸铵催化剂20mL,摇匀,用淀粉溶液作指示剂,用0.05mol/L的
),摇匀,置于暗处5min,用蒸馏水冲洗瓶盖及四周,加钼酸铵催化剂20mL,摇匀,用淀粉溶液作指示剂,用0.05mol/L的 标准溶液滴定至蓝色刚好褪去(
标准溶液滴定至蓝色刚好褪去( )。重复步骤b,步骤c三次,测得平均消耗
)。重复步骤b,步骤c三次,测得平均消耗 标准溶液的体积为20.00mL。
标准溶液的体积为20.00mL。
①步骤a中配制溶液A时,需要用到的玻璃仪器除烧杯、100mL容量瓶,玻璃棒和量筒外,还需要___________
②设计步骤b的目的是___________
③过氧乙酸的质量分数为___________ %。
(1)浓缩

在图示装置(加热装置已省略)中,由分液漏斗向冷凝管1中滴加30%
 溶液,最终得到质量分数约68%的
溶液,最终得到质量分数约68%的 溶液。
溶液。
冷凝管1、冷凝管2中进水接口依次为
②加热温度不宜超过60℃的原因是
(2)合成过氧乙酸
向带有搅拌装置及温度计的500mL三口烧瓶中先加入16g冰醋酸,在搅拌下滴加90g68%
 溶液,最后加入4.1mL浓硫酸,搅拌5h,静置20h。
溶液,最后加入4.1mL浓硫酸,搅拌5h,静置20h。(已知:CH3COOH+H2O2
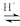
 +H2O)
+H2O)①用浓缩的68%
 溶液代替常见的30%
溶液代替常见的30% 溶液的目的是
溶液的目的是②充分搅拌的目的是
(3)过氧乙酸含量的测定
步骤a:称取5.0g过氧乙酸试样(液体),配制成100mL溶液A。
步骤b:在碘量瓶中加入5.0mL
 溶液、3滴
溶液、3滴 溶液、5.0mL溶液A,摇匀,用0.01mol/L的
溶液、5.0mL溶液A,摇匀,用0.01mol/L的 溶液滴定至溶液呈微红色。
溶液滴定至溶液呈微红色。步骤c:向滴定后的溶液中再加1.0gKI(
 ),摇匀,置于暗处5min,用蒸馏水冲洗瓶盖及四周,加钼酸铵催化剂20mL,摇匀,用淀粉溶液作指示剂,用0.05mol/L的
),摇匀,置于暗处5min,用蒸馏水冲洗瓶盖及四周,加钼酸铵催化剂20mL,摇匀,用淀粉溶液作指示剂,用0.05mol/L的 标准溶液滴定至蓝色刚好褪去(
标准溶液滴定至蓝色刚好褪去( )。重复步骤b,步骤c三次,测得平均消耗
)。重复步骤b,步骤c三次,测得平均消耗 标准溶液的体积为20.00mL。
标准溶液的体积为20.00mL。①步骤a中配制溶液A时,需要用到的玻璃仪器除烧杯、100mL容量瓶,玻璃棒和量筒外,还需要
②设计步骤b的目的是
③过氧乙酸的质量分数为
您最近一年使用:0次



