1 . 某学习小组将酚酞试液滴入Na2O2与水反应后的溶液中,发现溶液先变红后迅速褪色,为探究原因,查阅资料后做了分析和实验。
【查阅资料】
①Na2O2与水反应先生成H2O2,然后H2O2分解;
②H2O2类似于二元弱酸,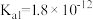 ,且具有强氧化性;
,且具有强氧化性;
③酚酞在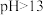 的溶液中变为无色。
的溶液中变为无色。
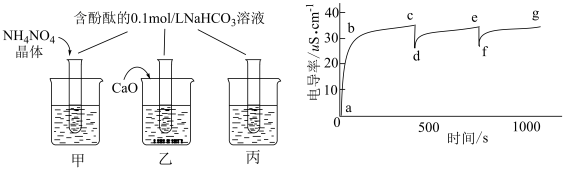
(1)探究一:褪色原因
【提出猜想】
假设一:反应产生的O2将酚酞氧化;
假设二:反应产生的H2O2将酚酞氧化;
假设三:NaOH溶液浓度过高导致酚酞试液褪色。
实验如下表,请填写空白:
【提出猜想】
(2)针对假设二,有同学提出还应补充实验才能证明Na2O2与水反应生成了 H2O2,则补充的实验操作为:________
(3)探究二:H2O2的性质及应用
①H2O2的酸性
用化学用语表示H2O2显酸性的原因______ 。
②H2O2的还原性
某实验用量筒量取浓H2O2溶液配制 溶液,所需玻璃仪器除量筒、烧杯、玻璃棒外,还有
溶液,所需玻璃仪器除量筒、烧杯、玻璃棒外,还有______ 。现用 酸性KMnO4液滴定所配H2O2溶液,取25.00mL H2O2溶液于锥形瓶中,完成三次实验平均消耗KMnO4标准溶液22.50mL,该反应的离子方程式为:
酸性KMnO4液滴定所配H2O2溶液,取25.00mL H2O2溶液于锥形瓶中,完成三次实验平均消耗KMnO4标准溶液22.50mL,该反应的离子方程式为:______ ,标定的H2O2溶液浓度为______  。
。
③若滴定时出现以下情况,将导致测定结果偏高的是______ 。
A.装入标准酸性KMnO4溶液时,未润洗滴定管
B.滴入最后半滴标准液出现颜色变化就立即停止滴定
C.滴定前盛标准液的滴定管尖嘴处有气泡,滴定后气泡消失
D.记录标准液体积时,滴定前仰视读数,滴定后俯视读数
【查阅资料】
①Na2O2与水反应先生成H2O2,然后H2O2分解;
②H2O2类似于二元弱酸,
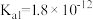 ,且具有强氧化性;
,且具有强氧化性;③酚酞在
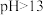 的溶液中变为无色。
的溶液中变为无色。
(1)探究一:褪色原因
【提出猜想】
假设一:反应产生的O2将酚酞氧化;
假设二:反应产生的H2O2将酚酞氧化;
假设三:NaOH溶液浓度过高导致酚酞试液褪色。
实验如下表,请填写空白:
| 实验编号 | 实验操作 | 实验现象 | 实验结论 |
| ① | 在5mLpH=10的NaOH溶液中滴加5滴酚酞试液,再通入足量O2 | 溶液变红后不褪色 | 假设一: |
| ② | 在5mLpH=10的NaOH溶液中滴加5滴酚酞试液,再滴加1mL3%的H2O2溶液 | 假设二:成立 | |
| ③ | 在5mL 的NaOH溶液中滴加5滴酚酞试液 的NaOH溶液中滴加5滴酚酞试液 | 溶液先变红,后褪色 | 假设三:成立 |
【提出猜想】
(2)针对假设二,有同学提出还应补充实验才能证明Na2O2与水反应生成了 H2O2,则补充的实验操作为:
(3)探究二:H2O2的性质及应用
①H2O2的酸性
用化学用语表示H2O2显酸性的原因
②H2O2的还原性
某实验用量筒量取浓H2O2溶液配制
 溶液,所需玻璃仪器除量筒、烧杯、玻璃棒外,还有
溶液,所需玻璃仪器除量筒、烧杯、玻璃棒外,还有 酸性KMnO4液滴定所配H2O2溶液,取25.00mL H2O2溶液于锥形瓶中,完成三次实验平均消耗KMnO4标准溶液22.50mL,该反应的离子方程式为:
酸性KMnO4液滴定所配H2O2溶液,取25.00mL H2O2溶液于锥形瓶中,完成三次实验平均消耗KMnO4标准溶液22.50mL,该反应的离子方程式为: 。
。③若滴定时出现以下情况,将导致测定结果偏高的是
A.装入标准酸性KMnO4溶液时,未润洗滴定管
B.滴入最后半滴标准液出现颜色变化就立即停止滴定
C.滴定前盛标准液的滴定管尖嘴处有气泡,滴定后气泡消失
D.记录标准液体积时,滴定前仰视读数,滴定后俯视读数
您最近一年使用:0次
名校
解题方法
2 . 下图是一种检验某气体化学性质的实验装置,图中B为开关。如先打开B,在A处通入干燥氯气,C中红色布条颜色无变化;当关闭B时,C中红色布条颜色褪去。则D瓶中盛有的溶液是
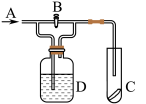

| A.浓H2SO4 | B.饱和Na2SO4 | C.浓NaOH溶液 | D.KI溶液 |
您最近一年使用:0次
2023-03-28更新
|
154次组卷
|
4卷引用:四川省达州市万源中学2023-2024学年高一上学期12月月考化学试题
四川省达州市万源中学2023-2024学年高一上学期12月月考化学试题(已下线)【2022】【高一上】【期中考】【杭十一中】【高中化学】【李雪收集】广东省普宁市华侨中学2022-2023学年高一上学期(11月)期中考试化学试题四川省成都市双流棠湖中学2023-2024学年高三上学期11月期中考试化学试题
3 . 氨是重要的化工原料,回答下列问题:
I.氨气的制备

(1)制取并收集一瓶干燥氨气,上述装置的连接顺序为A→_____→_____→C→____,____ ,制气时的化学方程式为___________ ,收集时气体从___________ 口进入
II.氨气的性质
(2)装置如图所示,打开止水夹,用热毛巾将烧瓶捂热,水上喷形成红色喷泉,说明氨气___________ 。

III.氨气的用途
利用下图装置由氨制硝酸,实验时戊中溶液呈淡黄色时关闭分液漏斗活塞。

(3)Na2O2的作用___________ ,证明有硝酸生成的实验是___________ ,发生反应的离子方程式___________ 。
(4)实验中的氮氧化物(NOx)尾气折算成标准状况下的体积为aL,完全吸收时,烧杯中c(NaOH)至少是___________ mol/L(忽略溶液体积变化)。
I.氨气的制备

(1)制取并收集一瓶干燥氨气,上述装置的连接顺序为A→_____→_____→C→____,
II.氨气的性质
(2)装置如图所示,打开止水夹,用热毛巾将烧瓶捂热,水上喷形成红色喷泉,说明氨气

III.氨气的用途
利用下图装置由氨制硝酸,实验时戊中溶液呈淡黄色时关闭分液漏斗活塞。

(3)Na2O2的作用
(4)实验中的氮氧化物(NOx)尾气折算成标准状况下的体积为aL,完全吸收时,烧杯中c(NaOH)至少是
您最近一年使用:0次
2021-12-11更新
|
1080次组卷
|
3卷引用:四川省达州市2021-2022学年高三上学期第一次诊断考试理科综合化学试题
四川省达州市2021-2022学年高三上学期第一次诊断考试理科综合化学试题四川省达州市普通高中2022届高三第一次诊断性测试理综化学试题(已下线)微专题24 氯气、氨气、二氧化硫的实验室制备与应用-备战2023年高考化学一轮复习考点微专题
4 . 如图所示,在光照条件下,将盛有 和
和 的试管倒扣于盛有饱和食盐水的水槽中进行实验,不可能出现的现象是
的试管倒扣于盛有饱和食盐水的水槽中进行实验,不可能出现的现象是

 和
和 的试管倒扣于盛有饱和食盐水的水槽中进行实验,不可能出现的现象是
的试管倒扣于盛有饱和食盐水的水槽中进行实验,不可能出现的现象是
| A.试管中液面上升至试管顶部 |
| B.试管内的黄绿色变浅 |
| C.试管内壁出现油状液滴 |
| D.试管内出现少量白雾,水槽中出现少量白色晶体 |
您最近一年使用:0次
2021-07-02更新
|
328次组卷
|
2卷引用:四川省达州市2020-2021学年高一下学期期末检测化学试题
5 . 某同学设计了如下装置用于制取SO2和验证SO2的性质。回答下列问题:

(1)仪器a的名称为______________
(2)下列试剂不能用于吸收尾气的是________ (填序号)
a.饱和Na2SO4溶液 b.饱和Na2CO3溶液 c.浓NH3·H2O d.饱和NaCl溶液
(3)实验时观察到装置B无明显现象,装置C红色褪去,则使品红的水溶液褪色的微粒一定不是_____ 。
(4)转置D目的是检验SO2的_____ 性,观察到的现象是________________ 。
(5)为进一步研究SO2的性质,分别用煮沸和未煮沸过的蒸馏水配制的Ba(NO3)2和BaCl2溶液,进行如下实验:
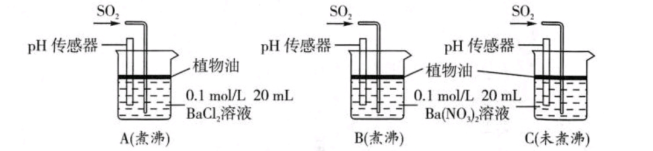
实验中A、B、C烧杯中观察到的现象如下表
①煮沸的目的是___________ ,据A中现象得出的结论是___________
②B中白色沉淀的化学式为______ ,C中出现白色沉淀比B中快很多的原因是_______
③在B中通入过量的SO2后,溶液中存在的主要阴离子是_________ ,其原因是_____ (用离子方程式表示)

(1)仪器a的名称为
(2)下列试剂不能用于吸收尾气的是
a.饱和Na2SO4溶液 b.饱和Na2CO3溶液 c.浓NH3·H2O d.饱和NaCl溶液
(3)实验时观察到装置B无明显现象,装置C红色褪去,则使品红的水溶液褪色的微粒一定不是
(4)转置D目的是检验SO2的
(5)为进一步研究SO2的性质,分别用煮沸和未煮沸过的蒸馏水配制的Ba(NO3)2和BaCl2溶液,进行如下实验:

实验中A、B、C烧杯中观察到的现象如下表
| 烧杯 | 实验现象 |
| A | 无白色沉淀产生,pH传感器测得溶液pH=5.3 |
| B | 有白色沉淀产生 |
| C | 有白色沉淀产生,C中出现白色沉淀比B中快很多 |
②B中白色沉淀的化学式为
③在B中通入过量的SO2后,溶液中存在的主要阴离子是
您最近一年使用:0次
2020-12-23更新
|
1063次组卷
|
4卷引用:四川省达州市2021届高三第一次诊断性测试理综化学试题
四川省达州市2021届高三第一次诊断性测试理综化学试题四川省绵阳市南山中学2021届高三下学期开学考试理科综合化学试题(已下线)解密07 非金属及其化合物(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密07 非金属及其化合物(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练
名校
6 . 铜粉放入稀硫酸溶液中,加热后无明显变化,但加入某盐一段时间后,发现铜粉溶解,溶液呈蓝色,且无气体逸出,该盐可能是
| A.FeC13 | B.Na2CO3 | C.KNO3 | D.FeSO4 |
您最近一年使用:0次
2018-01-27更新
|
205次组卷
|
6卷引用:四川省达州市第一中学校2021-2022学年高一下学期第一次月考化学试题
四川省达州市第一中学校2021-2022学年高一下学期第一次月考化学试题2015-2016学年山东寿光现代中学高一上12月月考化学卷2017届河北省定州中学高三上期末化学试卷(已下线)2019高考备考一轮复习精品资料 第四章 常见的非金属及其化合物 第4讲 氮及其化合物【押题专练】北京市昌平临川育人学校2018届高三上学期期末考试化学试题甘肃省武威市第一中学2019-2020学年高一下学期期中考试化学试题
7 . 某校化学兴趣小组探究SO2的一些性质。
[探究一]:SO2能否被BaCl2溶液吸收。

甲、乙两同学分别设计如下装置甲和装置乙进行探究
甲、乙两同学实验时观察到各仪器中的现象如下:
回答下列问题:
(1)甲同学经过后续实验确证了B中白色沉淀是BaSO4.甲同学的后续实验操作是____
(2)乙同学分析装置甲中产生BaSO4的可能原因有:
①A中产生的白雾是硫酸的酸雾,进入B中与BaCl2溶液反应生成BaSO4沉淀。
②________________________ (用离子方程式表示)。
(3)装置乙中B中所盛试剂是___ ;乙同学在滴加浓硫酸之前的操作是___________
(4)通过上述实验,得出的结论是________________________
[探究二]:SO2与FeCl3溶液的反应
查阅资料:①Fe(HSO3)2+离子为红棕色,它可以将Fe3+还原为Fe2+;②生成Fe(HSO3)2+离子的反应为可逆反应。实验步骤为:
回答下列问题:
(5)当SO2通入到FeCl3(未用盐酸酸化)溶液至饱和时,同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔现象。将混合液放置12小时,溶液才变成浅绿色。则溶液由棕黄色变成红棕色的原因是_________ ;写出溶液由红棕色变为浅绿色时发生反应的离子方程式___________
(6)通过实验可知_____ 和________ 可缩短浅绿色出现的时间。
[探究一]:SO2能否被BaCl2溶液吸收。

甲、乙两同学分别设计如下装置甲和装置乙进行探究
甲、乙两同学实验时观察到各仪器中的现象如下:
| A | B | C | D | |
| 装置甲中的现象 | Na2SO3固体表面有气泡.瓶中白雾 | 白色沉淀 | ----- | ------ |
| 装置乙中的现象 | Na2SO3固体表面有气泡.瓶中白雾 | 有气泡 | 有气泡 | 品红褪色 |
(1)甲同学经过后续实验确证了B中白色沉淀是BaSO4.甲同学的后续实验操作是
(2)乙同学分析装置甲中产生BaSO4的可能原因有:
①A中产生的白雾是硫酸的酸雾,进入B中与BaCl2溶液反应生成BaSO4沉淀。
②
(3)装置乙中B中所盛试剂是
(4)通过上述实验,得出的结论是
[探究二]:SO2与FeCl3溶液的反应
查阅资料:①Fe(HSO3)2+离子为红棕色,它可以将Fe3+还原为Fe2+;②生成Fe(HSO3)2+离子的反应为可逆反应。实验步骤为:
| 步骤I | 往5mL1mol·L-1 FeCl3溶液中通入SO2气体,溶液立即变为红棕色。微热3 min,溶液颜色变为浅绿色。 |
| 步骤II | 往5mL重新配制的1mol·L-1 FeCl3溶液(用浓盐酸酸化)中通入SO2气体,溶液立即变为红棕色。几分钟后,发现溶液颜色变成浅绿色。 |
回答下列问题:
(5)当SO2通入到FeCl3(未用盐酸酸化)溶液至饱和时,同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔现象。将混合液放置12小时,溶液才变成浅绿色。则溶液由棕黄色变成红棕色的原因是
(6)通过实验可知
您最近一年使用:0次
名校
8 . 有关催化剂的催化机理等问题可以从“乙醇催化氧化实验”得到一些认识,某教师设计了如图所示装置(夹持装置等已省略),其实验操作为:先按图安装好装置,关闭活塞a、b、c,在铜丝的中间部分加热片刻,然后打开活塞a、b、c,通过控制活塞a和b,而有节奏(间歇性)地通入气体,即可在M处观察到明显的实验现象。试回答以下问题:
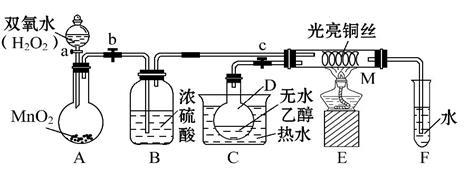
(1)A中发生反应的化学方程式:__________________ ,B的作用:_____________ ;C中热水的作用:_____________________ 。
(2)M处发生反应的化学方程式为_________________ 。
(3)从M管中可观察到的现象:_______________ ,从中可认识到该实验过程中催化剂______ (填“参加”或“不参加”)化学反应,还可以认识到催化剂起催化作用需要一定的_____________ 。
(4)实验进行一段时间后,如果撤掉酒精灯,反应__________ (填“能”或“不能”)继续进行,其原因是_____________ 。
(5)验证乙醇氧化产物的化学方法是______________________ 。

(1)A中发生反应的化学方程式:
(2)M处发生反应的化学方程式为
(3)从M管中可观察到的现象:
(4)实验进行一段时间后,如果撤掉酒精灯,反应
(5)验证乙醇氧化产物的化学方法是
您最近一年使用:0次
2016-12-09更新
|
2191次组卷
|
7卷引用:2014-2015四川省达州市高级中学高二春季期中考试化学试卷



