名校
1 . 某实验室利用 和
和 反应合成硫酰氯(
反应合成硫酰氯( ),并对
),并对 和HClO的酸性强弱进行探究。已知
和HClO的酸性强弱进行探究。已知 的沸点为69.1℃,在空气中遇水蒸气发生剧烈反应,并产生大量HCl,100℃以上容易分解。实验室合成
的沸点为69.1℃,在空气中遇水蒸气发生剧烈反应,并产生大量HCl,100℃以上容易分解。实验室合成 的原理:
的原理: ,反应会放热。实验装置如图所示,请回答下列问题:
,反应会放热。实验装置如图所示,请回答下列问题:_____
(2)装置戊上方分液漏斗中最好选用_____ (填字母)。
a.蒸馏水 b.饱和食盐水 c.浓氢氧化钠溶液 d. 盐酸
盐酸
(3)装置乙和丁盛放的试剂均是_____ (写名称)。
(4)装置丙放置在冰水浴中的原因是_____ 。
(5) 和水反应的化学方程式为
和水反应的化学方程式为_____
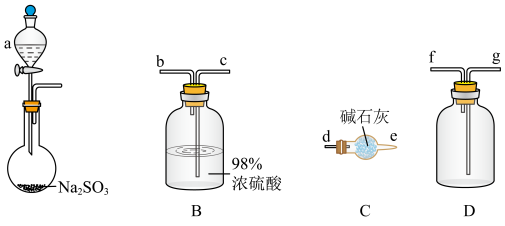
(6)选用下面的装置探究酸性: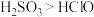 ,其连接顺序为A→C→B→E→D→Fa'装置E中反应的离子方程式为
,其连接顺序为A→C→B→E→D→Fa'装置E中反应的离子方程式为_____ ,能证明 的酸性强于HClO的实验现象为
的酸性强于HClO的实验现象为_____ (已知: 酸性大于
酸性大于 )
)
 和
和 反应合成硫酰氯(
反应合成硫酰氯( ),并对
),并对 和HClO的酸性强弱进行探究。已知
和HClO的酸性强弱进行探究。已知 的沸点为69.1℃,在空气中遇水蒸气发生剧烈反应,并产生大量HCl,100℃以上容易分解。实验室合成
的沸点为69.1℃,在空气中遇水蒸气发生剧烈反应,并产生大量HCl,100℃以上容易分解。实验室合成 的原理:
的原理: ,反应会放热。实验装置如图所示,请回答下列问题:
,反应会放热。实验装置如图所示,请回答下列问题:
(2)装置戊上方分液漏斗中最好选用
a.蒸馏水 b.饱和食盐水 c.浓氢氧化钠溶液 d.
 盐酸
盐酸(3)装置乙和丁盛放的试剂均是
(4)装置丙放置在冰水浴中的原因是
(5)
 和水反应的化学方程式为
和水反应的化学方程式为(6)选用下面的装置探究酸性:
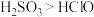 ,其连接顺序为A→C→B→E→D→Fa'装置E中反应的离子方程式为
,其连接顺序为A→C→B→E→D→Fa'装置E中反应的离子方程式为 的酸性强于HClO的实验现象为
的酸性强于HClO的实验现象为 酸性大于
酸性大于 )
)
您最近一年使用:0次
名校
解题方法
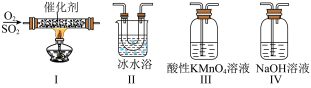
2 . 某化学小组为探究SO2的制备、性质及检验等相关问题,进行如下实验:
I.制备并收集纯净干燥的SO2_______ →d→e(按气流方向用小写字母标号表示)。
②该实验中制备SO2的反应方程式为_______ 。
③仪器C的化学名称为_______ ,其作用为_______ 。
Ⅱ.探究SO2的性质
(2)将收集到的SO2持续通入如图装置进行实验:_______ 现象时可验证SO2具有氧化性。
②装置F用于验证SO2的还原性,为实现这一目的,需进一步采取的实验操作是_______ 。
③从硫元素间的相互转化所得的规律判断下列物质中既有氧化性,又有还原性的是_______ (填字母序号)。
a.Na b.Na+ c.Cl2 d.Cl- e.Fe2+
Ⅲ.葡萄酒中抗氧化剂残留量(以游离SO2计算的测定)
准确量取100.00mL葡萄酒样品,加酸蒸馏出抗氧化剂成分,取馏分于锥形瓶中,滴加少量淀粉溶液,用物质的量浓度为0.0100mol/L标准溶液滴定至终点,重复操作三次,平均消耗标准溶液22.50mL。(已知滴定过程中所发生的反应是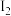 +SO2+2H2O=2HI+H2SO4)。
+SO2+2H2O=2HI+H2SO4)。
(3)滴定前需排放装有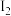 溶液的滴定管尖嘴处的气泡,其正确的图示为_______(填字母)。
溶液的滴定管尖嘴处的气泡,其正确的图示为_______(填字母)。
(4)判断达到滴定终点的依据是_______ ;所测100.00mL葡萄酒样品中抗氧化剂的残留量_______ (以游离SO2计算)为mg/L。
I.制备并收集纯净干燥的SO2
②该实验中制备SO2的反应方程式为
③仪器C的化学名称为
Ⅱ.探究SO2的性质
(2)将收集到的SO2持续通入如图装置进行实验:

②装置F用于验证SO2的还原性,为实现这一目的,需进一步采取的实验操作是
③从硫元素间的相互转化所得的规律判断下列物质中既有氧化性,又有还原性的是
a.Na b.Na+ c.Cl2 d.Cl- e.Fe2+
Ⅲ.葡萄酒中抗氧化剂残留量(以游离SO2计算的测定)
准确量取100.00mL葡萄酒样品,加酸蒸馏出抗氧化剂成分,取馏分于锥形瓶中,滴加少量淀粉溶液,用物质的量浓度为0.0100mol/L标准溶液滴定至终点,重复操作三次,平均消耗标准溶液22.50mL。(已知滴定过程中所发生的反应是
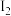 +SO2+2H2O=2HI+H2SO4)。
+SO2+2H2O=2HI+H2SO4)。(3)滴定前需排放装有
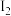 溶液的滴定管尖嘴处的气泡,其正确的图示为_______(填字母)。
溶液的滴定管尖嘴处的气泡,其正确的图示为_______(填字母)。A.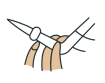 | B. | C.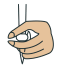 | D. |
(4)判断达到滴定终点的依据是
您最近一年使用:0次
名校
3 . 实验室用如下装置制取氯气,并进行性质实验。回答下列问题;
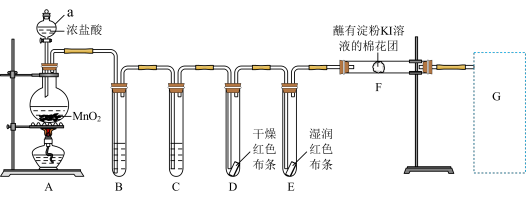
(1)写出A中反应的化学方程式________ 。装置中B盛装________ 装置中C盛装________ 。
(2)能证明氯气无漂白性的现象是________ 。
(3)F处观察到棉花团变蓝色,说明氯气具有________ 性(填“氧化”或“还原”)。
(4)写出G处尾气吸收的离子方程式________ 。
(5)实验室还可用 固体与浓盐酸常温下反应制备氯气;
固体与浓盐酸常温下反应制备氯气;
( ) ( )HCl(浓)=( )KCl+( )
( )HCl(浓)=( )KCl+( ) ( )
( ) ( )
( ) (未配平)。
(未配平)。
请写出该反应配平后的离子方程式:________ 。若生成等量的 ,所需
,所需 与
与 的物质的量之比为
的物质的量之比为________ 。

(1)写出A中反应的化学方程式
(2)能证明氯气无漂白性的现象是
(3)F处观察到棉花团变蓝色,说明氯气具有
(4)写出G处尾气吸收的离子方程式
(5)实验室还可用
 固体与浓盐酸常温下反应制备氯气;
固体与浓盐酸常温下反应制备氯气;( )
 ( )HCl(浓)=( )KCl+( )
( )HCl(浓)=( )KCl+( ) ( )
( ) ( )
( ) (未配平)。
(未配平)。请写出该反应配平后的离子方程式:
 ,所需
,所需 与
与 的物质的量之比为
的物质的量之比为
您最近一年使用:0次
名校
解题方法
4 . Ⅰ.“84消毒液”有效成分是NaClO。某次实验需要使用900mL0.2mol/L的NaClO溶液,欲用NaClO固体配制该溶液。
(1)计算所需NaClO固体的质量为________ g。
(2)配制溶液时,下图不需要的仪器是________ (写仪器名称)。
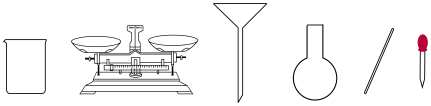
(3)写出配制溶液时的正确操作顺序(用字母表示,每个字母只能用一次)________ 。
A.洗涤 B.称量、溶解 C.转移 D.摇匀 E.定容
(4)配制过程中,下列操作导致溶液浓度偏小的是________(填序号)。
Ⅱ.某班同学通过实验探究 、
、 的性质。回答下列问题:
的性质。回答下列问题:
(5)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1mol/L的溶液。刻制印刷电路板时用氯化铁溶液作为“腐蚀液”,发生反应的离子方程式是________ 。
(6)甲组同学取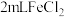 溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明
溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明 可将
可将 氧化。
氧化。 溶液与氯水反应的离子方程式为
溶液与氯水反应的离子方程式为________ 。
(7)乙组同学认为甲组的实验不够严谨,该组同学在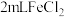 溶液中先加入0.5mL煤油(不溶于水,密度比水小),再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红。煤油的作用是:
溶液中先加入0.5mL煤油(不溶于水,密度比水小),再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红。煤油的作用是:________ 。
(8)向 溶液中滴加NaOH溶液,现象是
溶液中滴加NaOH溶液,现象是________ ;沉淀变色的原因是________ (用化学方程式解释)。
(1)计算所需NaClO固体的质量为
(2)配制溶液时,下图不需要的仪器是

(3)写出配制溶液时的正确操作顺序(用字母表示,每个字母只能用一次)
A.洗涤 B.称量、溶解 C.转移 D.摇匀 E.定容
(4)配制过程中,下列操作导致溶液浓度偏小的是________(填序号)。
| A.加水定容时俯视刻度线 |
| B.容量瓶未干燥处理 |
| C.定容加水时超过刻度线后,立即吸出多余的水 |
| D.溶液从烧杯转移到容量瓶中后没有洗涤烧杯 |
Ⅱ.某班同学通过实验探究
 、
、 的性质。回答下列问题:
的性质。回答下列问题:(5)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1mol/L的溶液。刻制印刷电路板时用氯化铁溶液作为“腐蚀液”,发生反应的离子方程式是
(6)甲组同学取
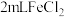 溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明
溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明 可将
可将 氧化。
氧化。 溶液与氯水反应的离子方程式为
溶液与氯水反应的离子方程式为(7)乙组同学认为甲组的实验不够严谨,该组同学在
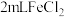 溶液中先加入0.5mL煤油(不溶于水,密度比水小),再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红。煤油的作用是:
溶液中先加入0.5mL煤油(不溶于水,密度比水小),再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红。煤油的作用是:(8)向
 溶液中滴加NaOH溶液,现象是
溶液中滴加NaOH溶液,现象是
您最近一年使用:0次
名校
解题方法
5 . 小组同学进行Na2CO3和NaHCO3性质的探究,实验如下(夹持装置已略去,气密性已检验)。
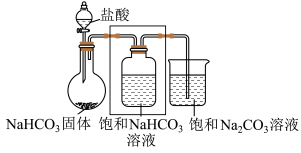
(1)打开分液漏斗活塞放出盐酸,发现流速越来越慢,可能的原因是________ 。
(2) NaHCO3与盐酸反应的化学方程式为________ 。
(3)方框中为洗气装置,请将该装置补充完整________ 。
(4)饱和 NaHCO3溶液的作用是________ 。
(5)反应持续一段时间后,观察到饱和Na2CO3溶液中有细小晶体析出,用化学方程式表示产生细小晶体的原因:________ 。
(6)若向饱和NaHCO3溶液加入少量澄清石灰水的离子方程式_______

(1)打开分液漏斗活塞放出盐酸,发现流速越来越慢,可能的原因是
(2) NaHCO3与盐酸反应的化学方程式为
(3)方框中为洗气装置,请将该装置补充完整
(4)饱和 NaHCO3溶液的作用是
(5)反应持续一段时间后,观察到饱和Na2CO3溶液中有细小晶体析出,用化学方程式表示产生细小晶体的原因:
(6)若向饱和NaHCO3溶液加入少量澄清石灰水的离子方程式
您最近一年使用:0次
6 .  、
、 等均为大气污染物,需处理后才能排放。
等均为大气污染物,需处理后才能排放。
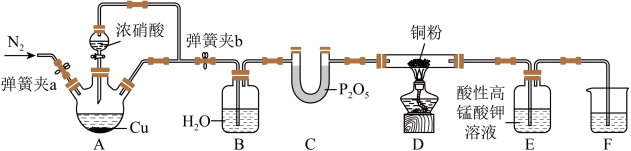
I.某研究性小组探究NO与炽热的铜粉反应,设计如下: ,
, 被还原成Mn2+。
被还原成Mn2+。
(1)实验开始前,检查装置气密性涉及以下操作:将F中的长导管插入液面以下→___________→___________→___________→___________→______________________ (操作可重复使用)。(填序号)
①关闭弹簧夹a,打开弹簧夹b ②观察F中的现象
③用酒精灯加热A中三颈烧瓶 ④撤走酒精灯
(2)装置B的作用为___________ ,实验结束时需通一段时间的N2,目的是___________ 。
(3)反应一段时间后,装置D中铜粉变黑,写出发生反应的化学方程式___________ 。
(4)实验过程中,装置E中溶液颜色变浅,则装置E发生的离子方程式为___________ 。
II.煤的洁净技术(包括固硫技术和脱硫技术)可有效降低燃煤废气中SO2的含量,通过加入固硫剂,将硫元素以固体形式留在煤燃烧的残渣中。
(5)生石灰是常用的固硫剂,SO2与生石灰反应将转化成___________ ;用碱液吸收SO2也是一种常用的脱硫方法,用1L 1.0 mol/L NaOH溶液吸收0.8mol SO2,所得溶液中的SO 和HSO
和HSO 的物质的量浓度之比是
的物质的量浓度之比是___________ 。
 、
、 等均为大气污染物,需处理后才能排放。
等均为大气污染物,需处理后才能排放。I.某研究性小组探究NO与炽热的铜粉反应,设计如下:
 ,
, 被还原成Mn2+。
被还原成Mn2+。(1)实验开始前,检查装置气密性涉及以下操作:将F中的长导管插入液面以下→___________→___________→___________→___________→___________
①关闭弹簧夹a,打开弹簧夹b ②观察F中的现象
③用酒精灯加热A中三颈烧瓶 ④撤走酒精灯
(2)装置B的作用为
(3)反应一段时间后,装置D中铜粉变黑,写出发生反应的化学方程式
(4)实验过程中,装置E中溶液颜色变浅,则装置E发生的离子方程式为
II.煤的洁净技术(包括固硫技术和脱硫技术)可有效降低燃煤废气中SO2的含量,通过加入固硫剂,将硫元素以固体形式留在煤燃烧的残渣中。
(5)生石灰是常用的固硫剂,SO2与生石灰反应将转化成
 和HSO
和HSO 的物质的量浓度之比是
的物质的量浓度之比是
您最近一年使用:0次
2023-10-01更新
|
386次组卷
|
2卷引用:四川省内江二中2023-2024学年高一下期3月月考化学试卷
解题方法
7 . 某小组探究CuCl2溶液和Na2SO3溶液反应的主要产物,开展如下活动。
[实验准备]
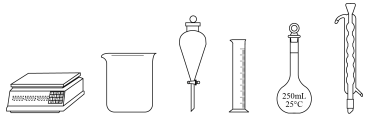
(1)用亚硫酸钠固体配制100mL0.2mol·L-1Na2SO3溶液,下列仪器中无需使用的有___________ (填名称)。
(2)检验亚硫酸钠溶液在空气中是否变质所需的试剂为___________ 。
[理论预测]
(3)预测3中反应的离子方程式为___________ 。
[实验探究]
实验1
取1mL0.2mol·L-1Na2SO3溶液和2mL0.2mol·L-1CuCl2溶液混合,立即生成橙黄色沉淀,3min后沉淀颜色变浅并伴有少量白色沉淀产生振荡1min沉淀全部变为白色。
为证明实验1产生的白色沉淀为CuCl,需鉴定沉淀中含Cl-、Cu+,其中鉴定含Cu+的实验设计如下:
实验2
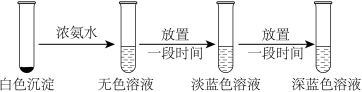
(4)已知[Cu(NH3)2]+、[Cu(NH3)4]2+在水中分别呈无色和深蓝色,实验2总反应的离子方程式为_____ 。
[进一步探究]
查阅资料获知橙黄色沉淀可能为xCuSO3·yCu2SO3·zH2O,在实验1获得橙黄色沉淀后,立即离心分离并洗涤。为探究其组成进行如下实验:
实验3

(5)离心分离的目的是加快过滤速度,防止___________ 。
(6)已知2Cu2++4I-=2CuI↓+I2,实验3___________ (选填“能”或“不能”)证明橙黄色沉淀中含有Cu2+和 。
。
为验证橙黄色沉淀转化为CuCl的原因可能是Cl-提高了Cu2+的氧化性,进行如下实验(已知装置中物质氧化性与还原性强弱差异越大,电压越大)。
实验4
(7)①表中X为___________ 。
②能证实实验结论的实验现象为___________ 。
[解释和结论]
综上所述,Cu2+与 发生复分解反应速率较快,发生氧化还原反应趋势更大。
发生复分解反应速率较快,发生氧化还原反应趋势更大。
[实验准备]
(1)用亚硫酸钠固体配制100mL0.2mol·L-1Na2SO3溶液,下列仪器中无需使用的有

(2)检验亚硫酸钠溶液在空气中是否变质所需的试剂为
[理论预测]
| 预测 | 主要产物 | 主要实验现象 |
| 1 | CuSO3 | 生成绿色沉淀 |
| 2 | Cu(OH)2、SO2 | 溶液中出现蓝色沉淀,伴有刺激性气味气体产生 |
| 3 | Cu2SO3 | 生成红色沉淀 |
| 4 | CuCl | 生成白色沉淀 |
[实验探究]
实验1
取1mL0.2mol·L-1Na2SO3溶液和2mL0.2mol·L-1CuCl2溶液混合,立即生成橙黄色沉淀,3min后沉淀颜色变浅并伴有少量白色沉淀产生振荡1min沉淀全部变为白色。
为证明实验1产生的白色沉淀为CuCl,需鉴定沉淀中含Cl-、Cu+,其中鉴定含Cu+的实验设计如下:
实验2

(4)已知[Cu(NH3)2]+、[Cu(NH3)4]2+在水中分别呈无色和深蓝色,实验2总反应的离子方程式为
[进一步探究]
查阅资料获知橙黄色沉淀可能为xCuSO3·yCu2SO3·zH2O,在实验1获得橙黄色沉淀后,立即离心分离并洗涤。为探究其组成进行如下实验:
实验3

(5)离心分离的目的是加快过滤速度,防止
(6)已知2Cu2++4I-=2CuI↓+I2,实验3
 。
。为验证橙黄色沉淀转化为CuCl的原因可能是Cl-提高了Cu2+的氧化性,进行如下实验(已知装置中物质氧化性与还原性强弱差异越大,电压越大)。
实验4
| 装置 | 试剂a | 试剂b | 电压表读数 |
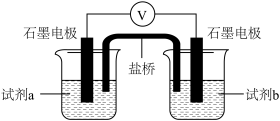 | 0.2mol·L-1Na2SO3溶液 | 0.2mol·L-1CuCl2 溶液 | V1 |
| 0.2mol·L-1Na2SO3溶液 | X | V2 |
②能证实实验结论的实验现象为
[解释和结论]
综上所述,Cu2+与
 发生复分解反应速率较快,发生氧化还原反应趋势更大。
发生复分解反应速率较快,发生氧化还原反应趋势更大。
您最近一年使用:0次
名校
解题方法
8 . 某小组同学欲研究 及
及 的性质。
的性质。
(1)将相关的含硫物质分为如下表所示3组,第2组中物质X的化学式是____________ 。
(2)实验室通常用______试剂检验 。
。
(3)利用如图所示的装置研究 的性质:(熔点:
的性质:(熔点: -
-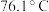 ,
,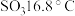 ;沸点:
;沸点: -
- ,
,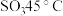 )
)
①装置I模拟工业生产中 催化氧化的反应,其化学方程式是
催化氧化的反应,其化学方程式是____________ 。
②甲同学按I、II、III、IV的顺序连接装置,装置II的作用是____________ ;装置III中溶液逐渐褪色,则该反应的离子方程式是____________ 。
③乙同学按I、II、IV的顺序连接装置,若装置Ⅳ中有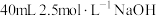 溶液,反应后增重4.8g,则装置IV中发生总反应的化学方程式
溶液,反应后增重4.8g,则装置IV中发生总反应的化学方程式____________ 。
(4)已知 溶液与
溶液与 反应时,
反应时,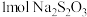 转移
转移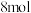 电子。该反应的离子方程式是
电子。该反应的离子方程式是_____ 。
(5)该实验小组的学生丁用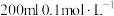 酸性
酸性 溶液测定空气中
溶液测定空气中 含量,若气体流速为
含量,若气体流速为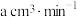 ,当时间为
,当时间为 时酸性
时酸性 溶液恰好褪色,则空气中
溶液恰好褪色,则空气中 的含量为
的含量为___ ( )。
)。
 及
及 的性质。
的性质。(1)将相关的含硫物质分为如下表所示3组,第2组中物质X的化学式是
第1组 | 第2组 | 第3组 |
S(单质) |
|
|
 。
。| A.紫色石蕊 | B.品红 | C.酚酞 | D.高锰酸钾 |
 的性质:(熔点:
的性质:(熔点: -
-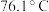 ,
,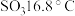 ;沸点:
;沸点: -
- ,
,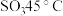 )
)
①装置I模拟工业生产中
 催化氧化的反应,其化学方程式是
催化氧化的反应,其化学方程式是②甲同学按I、II、III、IV的顺序连接装置,装置II的作用是
③乙同学按I、II、IV的顺序连接装置,若装置Ⅳ中有
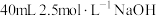 溶液,反应后增重4.8g,则装置IV中发生总反应的化学方程式
溶液,反应后增重4.8g,则装置IV中发生总反应的化学方程式(4)已知
 溶液与
溶液与 反应时,
反应时,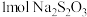 转移
转移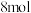 电子。该反应的离子方程式是
电子。该反应的离子方程式是(5)该实验小组的学生丁用
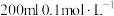 酸性
酸性 溶液测定空气中
溶液测定空气中 含量,若气体流速为
含量,若气体流速为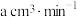 ,当时间为
,当时间为 时酸性
时酸性 溶液恰好褪色,则空气中
溶液恰好褪色,则空气中 的含量为
的含量为 )。
)。
您最近一年使用:0次
名校
解题方法
9 . 某化学兴趣小组在实验室中利用如图装置制备SO2并进行相关性质的探究。回答下列问题:
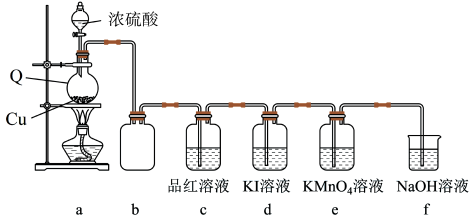
(1)仪器Q的名称为_____ ;装置c中品红溶液褪色,可证明SO2具有_____ 性。
(2)装置b的作用是_____ 。
(3)装置c中KMnO4溶液褪色,可证明SO2具有_____ 性。
(4)探究:探究SO2在KI溶液体系中的反应产物
实验开始后,发现装置d中的溶液迅速变黄,继续通入SO2,装置d中出现乳黄色浑浊。该小组同学查阅资料得知,存在反应:SO2+4I-+4H+=S↓+2I2+2H2O。但有同学提出上述反应生成的I2可与SO2发生反应:SO2+I2+2H2O=SO +2I-+4H+。为进一步探究体系中的产物,完成下列实验方案。
+2I-+4H+。为进一步探究体系中的产物,完成下列实验方案。
①取适量装置d中浊液,向其中滴加几滴_____ 溶液(填试剂名称),振荡,无明显变化,浊液中无I2。
②将装置d中浊液进行分离,得淡黄色固体和澄清溶液:取适量分离后的澄清溶液于试管中,_____ ,出现白色沉淀,产物溶液中存在SO 。综上可知,SO2在KI溶液中发生了歧化反应,其反应的离子方程式为
。综上可知,SO2在KI溶液中发生了歧化反应,其反应的离子方程式为_____ 。

(1)仪器Q的名称为
(2)装置b的作用是
(3)装置c中KMnO4溶液褪色,可证明SO2具有
(4)探究:探究SO2在KI溶液体系中的反应产物
实验开始后,发现装置d中的溶液迅速变黄,继续通入SO2,装置d中出现乳黄色浑浊。该小组同学查阅资料得知,存在反应:SO2+4I-+4H+=S↓+2I2+2H2O。但有同学提出上述反应生成的I2可与SO2发生反应:SO2+I2+2H2O=SO
 +2I-+4H+。为进一步探究体系中的产物,完成下列实验方案。
+2I-+4H+。为进一步探究体系中的产物,完成下列实验方案。①取适量装置d中浊液,向其中滴加几滴
②将装置d中浊液进行分离,得淡黄色固体和澄清溶液:取适量分离后的澄清溶液于试管中,
 。综上可知,SO2在KI溶液中发生了歧化反应,其反应的离子方程式为
。综上可知,SO2在KI溶液中发生了歧化反应,其反应的离子方程式为
您最近一年使用:0次
2023-03-27更新
|
359次组卷
|
3卷引用:四川省内江市威远中学校2022-2023学年高一下学期期中考试化学试题
名校
10 . 电路板广泛用于计算机、手机等电子产品中。我区某中学化学兴趣小组拟制作带有“COP15”标志的电路板并对铁及其化合物的性质进行探究。
I.制作电路板
兴趣小组同学取一小块覆铜板,用油性笔在铜板上画出“COP15”标志(图1),然后浸入 溶液(图2)。过一段时间后,取出覆铜板并用水洗净,获得带有图案的印刷电路板(图3)和废液。
溶液(图2)。过一段时间后,取出覆铜板并用水洗净,获得带有图案的印刷电路板(图3)和废液。
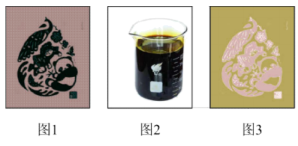
(1)在覆铜板上制作出“COP15”图案过程中发生反应的化学方程式为_______ 。取少量废液于试管中,滴加几滴_______ 溶液(填化学式),溶液出现红色,则废液中含有 。离子反应方程式为
。离子反应方程式为_______ 。
II.探究铁及其化合物的性质
(2)填写下表。
(3)将 溶液酸化后振荡,一段时间溶液变为黄色,写出反应过程的离子方程式
溶液酸化后振荡,一段时间溶液变为黄色,写出反应过程的离子方程式_______ 。
(4)向一定量的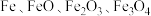 的混合物中加入
的混合物中加入 的盐酸,恰好完全反应,放出
的盐酸,恰好完全反应,放出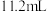 (标准状况)气体,所得溶液无
(标准状况)气体,所得溶液无 。用足量的
。用足量的 在高温下还原相同质量的此混合物,所得铁的质量为
在高温下还原相同质量的此混合物,所得铁的质量为_______ g。
I.制作电路板
兴趣小组同学取一小块覆铜板,用油性笔在铜板上画出“COP15”标志(图1),然后浸入
 溶液(图2)。过一段时间后,取出覆铜板并用水洗净,获得带有图案的印刷电路板(图3)和废液。
溶液(图2)。过一段时间后,取出覆铜板并用水洗净,获得带有图案的印刷电路板(图3)和废液。
(1)在覆铜板上制作出“COP15”图案过程中发生反应的化学方程式为
 。离子反应方程式为
。离子反应方程式为II.探究铁及其化合物的性质
(2)填写下表。
| 实验 | 实验操作 | 实验现象 | 离子方程式 | 实验结论 |
| a | 取少量废液于试管中,加入足量Fe粉 | 铁粉部分溶解,溶液呈浅绿色 | ①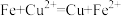 | ② |
| b | 取少量实验a中反应后的上层清液于试管中,滴加几滴氯水 | ③ | 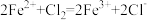 |  具有还原性 具有还原性 |
 溶液酸化后振荡,一段时间溶液变为黄色,写出反应过程的离子方程式
溶液酸化后振荡,一段时间溶液变为黄色,写出反应过程的离子方程式(4)向一定量的
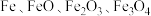 的混合物中加入
的混合物中加入 的盐酸,恰好完全反应,放出
的盐酸,恰好完全反应,放出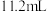 (标准状况)气体,所得溶液无
(标准状况)气体,所得溶液无 。用足量的
。用足量的 在高温下还原相同质量的此混合物,所得铁的质量为
在高温下还原相同质量的此混合物,所得铁的质量为
您最近一年使用:0次
2022-11-17更新
|
260次组卷
|
2卷引用:四川省内江市第六中学2022-2023学年高一上学期第一次月考(创新班)化学试题

 、
、
 、
、 、
、 、
、


