1 . 氨气选择性催化还原消除氮氧化物( ),以其高效、环保、低成本等优势成为目前最具潜力的脱硝技术。某研究小组利用如下装置模拟脱硝反应:
),以其高效、环保、低成本等优势成为目前最具潜力的脱硝技术。某研究小组利用如下装置模拟脱硝反应:
Ⅰ.制 :
:
(1)下列各组试剂不适用于实验室制 的是
的是_______ (选填序号)。
A. 固体 B.浓氨水和生石灰 C.
固体 B.浓氨水和生石灰 C. 固体和
固体和 固体
固体
(2)利用如图1装置和(1)中所提供的试剂可制得 ,写出
,写出 的一种主要用途:
的一种主要用途:_______ ,为制得干燥的 ,U形管盛放的试剂是
,U形管盛放的试剂是_______ 。
Ⅱ.利用图2制 :
:
(3)仪器a的名称为_______ 。
(4)用Cu与浓 制备
制备 的离子方程式为
的离子方程式为_______ 。
Ⅲ.利用图3模拟 催化还原
催化还原
(5)为了避免装置中空气对实验的影响,先打开 和
和_______ 、关闭_______ (选填“ ”或“
”或“ ”),通入气体。若观察到
”),通入气体。若观察到_______ (填实验现象)则说明空气已排尽。
(6)指出本实验装置中存在的一个不足之处:_______ 。
 ),以其高效、环保、低成本等优势成为目前最具潜力的脱硝技术。某研究小组利用如下装置模拟脱硝反应:
),以其高效、环保、低成本等优势成为目前最具潜力的脱硝技术。某研究小组利用如下装置模拟脱硝反应: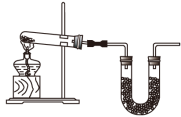 | 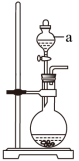 | 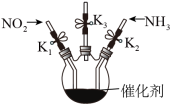 |
| 图1 | 图2 | 图3 |
 :
:(1)下列各组试剂不适用于实验室制
 的是
的是A.
 固体 B.浓氨水和生石灰 C.
固体 B.浓氨水和生石灰 C. 固体和
固体和 固体
固体(2)利用如图1装置和(1)中所提供的试剂可制得
 ,写出
,写出 的一种主要用途:
的一种主要用途: ,U形管盛放的试剂是
,U形管盛放的试剂是Ⅱ.利用图2制
 :
:(3)仪器a的名称为
(4)用Cu与浓
 制备
制备 的离子方程式为
的离子方程式为Ⅲ.利用图3模拟
 催化还原
催化还原
(5)为了避免装置中空气对实验的影响,先打开
 和
和 ”或“
”或“ ”),通入气体。若观察到
”),通入气体。若观察到(6)指出本实验装置中存在的一个不足之处:
您最近一年使用:0次
14-15高一上·安徽淮北·期末
名校
解题方法
2 . 某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下实验装置:__ 。
(2)实验室可用装置E通过MnO2和浓盐酸反应制备Cl2,若有6molHCl参加反应,则转移电子的总数为___ 。
(3)反应开始一段时间后,观察到B、D两个试管中的品红溶液出现的现象分别是:B__ ,D___ 。停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别是:B__ ,D__ 。
(4)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后漂白性肯定会更强。他们将制得的SO2和Cl2按物质的量之比为1:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析产生该现象的原因:__ (用化学方程式表示)。
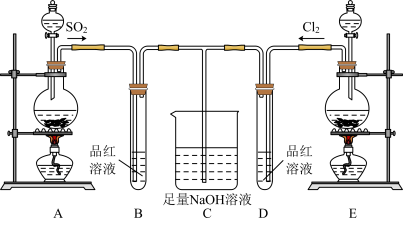
(2)实验室可用装置E通过MnO2和浓盐酸反应制备Cl2,若有6molHCl参加反应,则转移电子的总数为
(3)反应开始一段时间后,观察到B、D两个试管中的品红溶液出现的现象分别是:B
(4)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后漂白性肯定会更强。他们将制得的SO2和Cl2按物质的量之比为1:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析产生该现象的原因:
您最近一年使用:0次
2020-09-16更新
|
157次组卷
|
8卷引用:2014-2015甘肃省白银市会宁县五中高一上学期期末化学试卷
2014-2015甘肃省白银市会宁县五中高一上学期期末化学试卷(已下线)2013-2014学年安徽省濉溪县高一上学期期末考试化学试卷(已下线)2013-2014学年河南省平顶山市高一第一学期期末调研考试化学试卷【全国百强校】西藏自治区拉萨中学2017-2018学年高一下学期期中考试化学试题吉林省公主岭市范家屯镇第一中学2019-2020学年高一上学期期末考试化学试题鲁科版(2019)高一必修第一册第三章易错疑难集训(二)高一必修第一册(苏教2019版)专题4 第一单元 含硫化合物的性质 易错疑难集训陕西省西安市选课分科摸底考2023-2024学年高一下学期4月月考化学试题
名校
3 . 葡萄酒中添加的SO2有抗氧化和杀菌等作用。中华人民共和国国家标准规定葡萄酒中SO2最大使用量为0.25g/L。
1.SO2的制取和部分性质研究。
(1)下列实验室制取、验证漂白性、收集及尾气处理的装置和原理能达到实验目的的是_______ 。

(2)设计实验验证SO2与Fe2+还原性的强弱(可供选择的试剂有:FeCl2溶液、氯水、KSCN溶液、Ba(NO3)2溶液、BaCl2溶液、KMnO4溶液)。取SO2的饱和溶液,向其中滴加少量FeCl3溶液,充分反应。将反应后混合液分成甲、乙两份。
向甲中滴加_______ 溶液,观察到_______ ,可知混合液中无Fe3+;
向乙中滴加_______ 溶液,观察到_______ ,可知混合液中有_______
由此得出结论:SO2的还原性强于Fe2+。
2.葡萄酒中SO2的检测。
(3)检测干白葡萄酒(液体为无色)中的SO2或 。设计如图1的实验:
。设计如图1的实验:
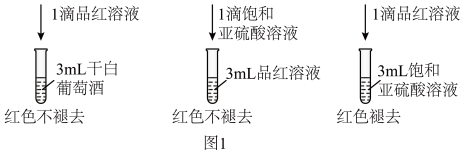
甲同学得出实验结论:干白葡萄酒中不含SO2或 。这个结论是否合理
。这个结论是否合理_______ (填“是”或“否”)说明理由_______ 。
(4)某兴趣小组用图2装置(夹持装置略)收集某葡萄酒中SO2,并对含量进行测定。
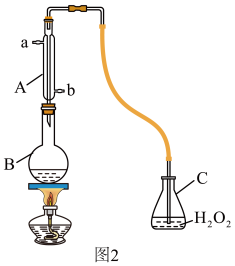
实验步骤:
i.检查装置的气密性后,向图2仪器B中加入300.00mL葡萄酒和适量盐酸
ii.加热使SO2全部逸出并与C中H2O2完全反应
iii.除去C中过量的H2O2
iv.用0.0900mol/LNaOH标准溶液进行滴定
回答下列问题:
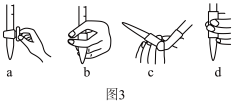
①A的进水口为_______ ,滴定前排气泡时,应选择图3中的_______ 。
②C中反应生成物的化学式是_______ ,除去过量H2O2的方法是_______ 。
③滴定至终点时,消耗NaOH溶液25.00mL,该葡萄酒中SO2含量为_______ g/L,是否符合国家标准_______ (填“是”或“否”)。
④下列操作使测定结果比实际值偏高的是_______ 。
a.B中加入的盐酸挥发
b.滴定终点读取滴定管刻度时,俯视标准液液面
c.配制NaOH标准溶液时,未等烧杯中溶液冷却至室温即转移定容
1.SO2的制取和部分性质研究。
(1)下列实验室制取、验证漂白性、收集及尾气处理的装置和原理能达到实验目的的是

(2)设计实验验证SO2与Fe2+还原性的强弱(可供选择的试剂有:FeCl2溶液、氯水、KSCN溶液、Ba(NO3)2溶液、BaCl2溶液、KMnO4溶液)。取SO2的饱和溶液,向其中滴加少量FeCl3溶液,充分反应。将反应后混合液分成甲、乙两份。
向甲中滴加
向乙中滴加
由此得出结论:SO2的还原性强于Fe2+。
2.葡萄酒中SO2的检测。
(3)检测干白葡萄酒(液体为无色)中的SO2或
 。设计如图1的实验:
。设计如图1的实验:
甲同学得出实验结论:干白葡萄酒中不含SO2或
 。这个结论是否合理
。这个结论是否合理(4)某兴趣小组用图2装置(夹持装置略)收集某葡萄酒中SO2,并对含量进行测定。

实验步骤:
i.检查装置的气密性后,向图2仪器B中加入300.00mL葡萄酒和适量盐酸
ii.加热使SO2全部逸出并与C中H2O2完全反应
iii.除去C中过量的H2O2
iv.用0.0900mol/LNaOH标准溶液进行滴定
回答下列问题:
①A的进水口为

②C中反应生成物的化学式是
③滴定至终点时,消耗NaOH溶液25.00mL,该葡萄酒中SO2含量为
④下列操作使测定结果比实际值偏高的是
a.B中加入的盐酸挥发
b.滴定终点读取滴定管刻度时,俯视标准液液面
c.配制NaOH标准溶液时,未等烧杯中溶液冷却至室温即转移定容
您最近一年使用:0次
名校
解题方法
4 . 某化学兴趣小组同学依据 和
和 的性质,设计如图装置(夹持装置已略去,装置的气密性良好)探究
的性质,设计如图装置(夹持装置已略去,装置的气密性良好)探究 与
与 的反应。
的反应。 与
与 反应生成的气体产物。
反应生成的气体产物。
查阅资料: 与
与 反应生成的气体产物只有一种。
反应生成的气体产物只有一种。
(1)列举一种常见的制取 的原理:
的原理:___________ (填化学方程式)。
(2)关闭K',打开K,若装置C中品红溶液不褪色,说明___________ ;关闭K,打开K',用小试管收集a处气体,将带火星的小木条伸入试管中,小木条复燃,可推出 与
与 反应生成的气体产物为
反应生成的气体产物为___________ (填化学式)。
Ⅱ.探究 与
与 反应生成的固体产物。
反应生成的固体产物。
(3)通入足量 ,二者充分反应后,装置B中的固体变为白色。同学们认为B中固体产物有三种可能:
,二者充分反应后,装置B中的固体变为白色。同学们认为B中固体产物有三种可能:
假设1:只有 。
。
假设2:只有___________ (填化学式)。
假设3: 和
和 都有。
都有。
(4)为验证假设2成立,甲同学取少量反应后的固体于试管中,加适量蒸馏水溶解后滴加稀硝酸酸化的 溶液,产生白色沉淀且沉淀不溶解。
溶液,产生白色沉淀且沉淀不溶解。
你认为甲同学设计的方案是否合理:___________ (填“是”或“否”),理由是___________ 。
(5)乙同学取少量反应后的固体于试管中,加适量蒸馏水溶解,并分成两等份于两支试管中。
步骤1:向第一支试管中加入过量的稀硫酸,将生成的气体通入少量酸性 溶液中。
溶液中。
步骤2:向第二支试管中加入过量的稀盐酸,然后加入适量 溶液,产生白色沉淀。
溶液,产生白色沉淀。
①步骤1中酸性 溶液褪色,则发生反应的离子方程式为
溶液褪色,则发生反应的离子方程式为___________ 。通过步骤1的实验现象可确定假设___________ (填“1”“2”或“3”)不成立。
②结合步骤1和步骤2的实验现象可确定假设___________ (填“1”“2”或“3”)成立。
(6)查阅资料得知学者对 与
与 反应的看法主要有两种:①2
反应的看法主要有两种:①2 ,②
,②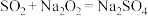 。结合Ⅰ和Ⅱ的实验现象,试分析上述实验玻璃管B中的固体中既有
。结合Ⅰ和Ⅱ的实验现象,试分析上述实验玻璃管B中的固体中既有 又有
又有 的原因:
的原因:___________ 。
 和
和 的性质,设计如图装置(夹持装置已略去,装置的气密性良好)探究
的性质,设计如图装置(夹持装置已略去,装置的气密性良好)探究 与
与 的反应。
的反应。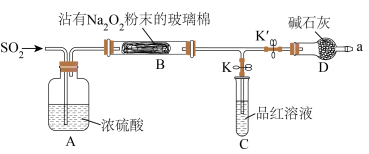
 与
与 反应生成的气体产物。
反应生成的气体产物。查阅资料:
 与
与 反应生成的气体产物只有一种。
反应生成的气体产物只有一种。(1)列举一种常见的制取
 的原理:
的原理:(2)关闭K',打开K,若装置C中品红溶液不褪色,说明
 与
与 反应生成的气体产物为
反应生成的气体产物为Ⅱ.探究
 与
与 反应生成的固体产物。
反应生成的固体产物。(3)通入足量
 ,二者充分反应后,装置B中的固体变为白色。同学们认为B中固体产物有三种可能:
,二者充分反应后,装置B中的固体变为白色。同学们认为B中固体产物有三种可能:假设1:只有
 。
。假设2:只有
假设3:
 和
和 都有。
都有。(4)为验证假设2成立,甲同学取少量反应后的固体于试管中,加适量蒸馏水溶解后滴加稀硝酸酸化的
 溶液,产生白色沉淀且沉淀不溶解。
溶液,产生白色沉淀且沉淀不溶解。你认为甲同学设计的方案是否合理:
(5)乙同学取少量反应后的固体于试管中,加适量蒸馏水溶解,并分成两等份于两支试管中。
步骤1:向第一支试管中加入过量的稀硫酸,将生成的气体通入少量酸性
 溶液中。
溶液中。步骤2:向第二支试管中加入过量的稀盐酸,然后加入适量
 溶液,产生白色沉淀。
溶液,产生白色沉淀。①步骤1中酸性
 溶液褪色,则发生反应的离子方程式为
溶液褪色,则发生反应的离子方程式为②结合步骤1和步骤2的实验现象可确定假设
(6)查阅资料得知学者对
 与
与 反应的看法主要有两种:①2
反应的看法主要有两种:①2 ,②
,② 。结合Ⅰ和Ⅱ的实验现象,试分析上述实验玻璃管B中的固体中既有
。结合Ⅰ和Ⅱ的实验现象,试分析上述实验玻璃管B中的固体中既有 又有
又有 的原因:
的原因:
您最近一年使用:0次
2024-05-19更新
|
202次组卷
|
7卷引用:甘肃省白银市靖远县2024届高三下学期全真模拟化学试题
名校
解题方法
5 . “化学——我们的生活,我们的未来”,学习化学应该明白“从生活中来,到生活中去”的道理。根据所学知识,回答下列问题:
(1)实验室加热亚硝酸铵(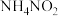 )的浓溶液可制得氮气,同时可得到一种无色无味的液体,则反应的化学方程式为
)的浓溶液可制得氮气,同时可得到一种无色无味的液体,则反应的化学方程式为________ ,被氧化的氮原子与被还原的氮原子的物质的量之比为________ 。
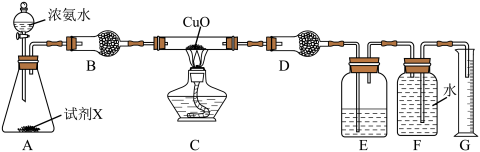
(2)氨气还原氧化铜也可制得氮气,实验装置如图。________ 。
②装置B的作用为________ 。
③氨气易溶于水,氨水呈碱性,其原因是________ (用离子方程式表示)。
④若在试管中进行氨气与红热的氧化铜反应的实验,可观察到的实验现象为________ ,反应的化学方程式为________ 。
(1)实验室加热亚硝酸铵(
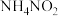 )的浓溶液可制得氮气,同时可得到一种无色无味的液体,则反应的化学方程式为
)的浓溶液可制得氮气,同时可得到一种无色无味的液体,则反应的化学方程式为(2)氨气还原氧化铜也可制得氮气,实验装置如图。
②装置B的作用为
③氨气易溶于水,氨水呈碱性,其原因是
④若在试管中进行氨气与红热的氧化铜反应的实验,可观察到的实验现象为
您最近一年使用:0次
名校
解题方法
6 . 微型实验具有装置小巧、节约药品、操作简便、现象明显、安全可靠、减少污染等优点,下图是某同学设计的实验室制取Cl2并探究其化学性质的微型装置(图中夹持装置均略去)。
查阅资料:氯气的氧化性大于HIO3。

回答下列问题:
(1)实验室中可代替图中添加浓盐酸的仪器名称是___________ 。
(2)加入浓盐酸后试管内发生反应的化学方程式是___________ 。
(3)探究氯气的化学性质,将实验现象填写在下表对应的空格里:
(4)实验中发现若氯气的通入量过多,淀粉碘化钾试纸会逐渐变为无色,可能的原因是___________ 。
(5)此装置___________ (填“能”或“不能”)证明氧化性顺序Cl2>Br2>I2,原因是___________ ,实验完毕后,关闭止水夹b,打开a、c,挤压气球,目的是___________ 。
查阅资料:氯气的氧化性大于HIO3。

回答下列问题:
(1)实验室中可代替图中添加浓盐酸的仪器名称是
(2)加入浓盐酸后试管内发生反应的化学方程式是
(3)探究氯气的化学性质,将实验现象填写在下表对应的空格里:
| 操作步骤 | 实验现象 |
| I.缓慢加入浓盐酸,关闭b,打开c、d、e,使产生的氯气缓慢充入Y型管 | ①潮湿的红色布条褪色; ② ③ |
| II.关闭c打开b,使氯气缓慢进入Y型管 | ①浸有NaBr溶液的滤纸变为红棕色; ② ③湿润的蓝色石蕊试纸先变红色后褪色。 |
(5)此装置
您最近一年使用:0次
2022-03-20更新
|
100次组卷
|
4卷引用:甘肃省会宁县第一中学2021-2022学年高一上学期期末考试化学试题
名校
解题方法
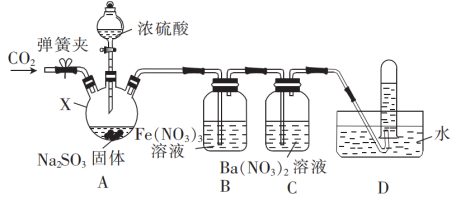
7 . 某小组设计实验探究SO2的还原性(部分夹持仪器省略)。
回答下列问题:
(1)分液漏斗中浓硫酸的浓度宜选择_______ (填标号)。
a.98.3% b.70% c.30% d.10%
(2)仪器X的名称是_______ ,装置A中发生反应的化学方程式为_______ 。
(3)为了探究装置B中 、
、 是否与SO2发生反应,设计如下实验:
是否与SO2发生反应,设计如下实验:
由操作I及其现象可知
_______ (填“部分”或“全部”,下同)参与了反应,由操作II及其现象可知
_______ 参与了反应。
(4)测定装置B溶液中 的浓度(只考虑
的浓度(只考虑 与
与 的反应)。用
的反应)。用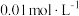 的酸性
的酸性 溶液滴定20mL装置B中溶液,共消耗酸性
溶液滴定20mL装置B中溶液,共消耗酸性 溶液16mL,则装置B溶液中
溶液16mL,则装置B溶液中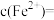
_______  。
。
(5)经分析,装置C中反应可能有两种情况:
①若通入少量SO2,则反应为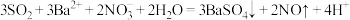 ;
;
②若通入过量SO2,则反应为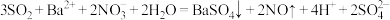 。
。
为了探究发生了哪一种情况,取装置C中溶液分别装入甲、乙、丙、丁四支试管中,进行如下实验:
能说明发生的是情况①的实验是____ (填标号,下同),能说明发生的是情况②的实验是_____ 。

回答下列问题:
(1)分液漏斗中浓硫酸的浓度宜选择
a.98.3% b.70% c.30% d.10%
(2)仪器X的名称是
(3)为了探究装置B中
 、
、 是否与SO2发生反应,设计如下实验:
是否与SO2发生反应,设计如下实验:| 实验操作 | 现象 |
| I.取装置B中溶液于试管,滴加KSCN溶液 | 溶液不变红 |
| II.取装置B中溶液于试管,加入适量浓硫酸,再加入铜粉 | 铜粉不溶解,溶液不变蓝 |
III.取装置B中溶液于试管,滴加 溶液和盐酸 溶液和盐酸 | 产生白色沉淀 |


(4)测定装置B溶液中
 的浓度(只考虑
的浓度(只考虑 与
与 的反应)。用
的反应)。用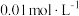 的酸性
的酸性 溶液滴定20mL装置B中溶液,共消耗酸性
溶液滴定20mL装置B中溶液,共消耗酸性 溶液16mL,则装置B溶液中
溶液16mL,则装置B溶液中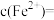
 。
。(5)经分析,装置C中反应可能有两种情况:
①若通入少量SO2,则反应为
 ;
;②若通入过量SO2,则反应为
 。
。为了探究发生了哪一种情况,取装置C中溶液分别装入甲、乙、丙、丁四支试管中,进行如下实验:
| 实验 | 操作及现象 |
| a | 向甲中加入锌粒,产生气泡 |
| b | 向乙中加入铜粉,溶液颜色发生了变化 |
| c | 向丙中加入 粉末,产生气泡 粉末,产生气泡 |
| d | 向丁中加入 溶液,产生沉淀 溶液,产生沉淀 |
您最近一年使用:0次
2022-07-07更新
|
355次组卷
|
4卷引用:甘肃省白银市2012-2022学年高一下学期期末考试化学试题
解题方法
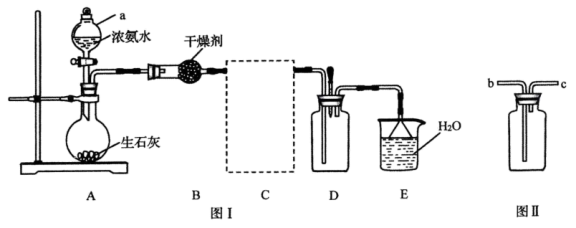
8 . 已知生石灰与水反应生成 并放出热量,实验室利用此原理向生石灰中滴加浓氨水制取氨气并探究其性质(部分夹持装置已略去)。
并放出热量,实验室利用此原理向生石灰中滴加浓氨水制取氨气并探究其性质(部分夹持装置已略去)。
回答下列问题:
(1)仪器 的名称为
的名称为____________ ;装置 中的干燥剂为
中的干燥剂为___________ 。
(2)装置 如图Ⅱ所示,用于收集氨气,装置
如图Ⅱ所示,用于收集氨气,装置 应连接
应连接__________ (填“ ”或“
”或“ ”)。
”)。
(3)装置 中倒置漏斗的作用为
中倒置漏斗的作用为___________ 。
(4)实验进行一段时间后,挤压装置 中的胶头滴管,滴入1~2滴浓盐酸,可观察到的现象为
中的胶头滴管,滴入1~2滴浓盐酸,可观察到的现象为___________ ;向装置 中滴入1~2滴酚酞溶液,装置
中滴入1~2滴酚酞溶液,装置 中溶液颜色为
中溶液颜色为____________ 。
 并放出热量,实验室利用此原理向生石灰中滴加浓氨水制取氨气并探究其性质(部分夹持装置已略去)。
并放出热量,实验室利用此原理向生石灰中滴加浓氨水制取氨气并探究其性质(部分夹持装置已略去)。
回答下列问题:
(1)仪器
 的名称为
的名称为 中的干燥剂为
中的干燥剂为(2)装置
 如图Ⅱ所示,用于收集氨气,装置
如图Ⅱ所示,用于收集氨气,装置 应连接
应连接 ”或“
”或“ ”)。
”)。(3)装置
 中倒置漏斗的作用为
中倒置漏斗的作用为(4)实验进行一段时间后,挤压装置
 中的胶头滴管,滴入1~2滴浓盐酸,可观察到的现象为
中的胶头滴管,滴入1~2滴浓盐酸,可观察到的现象为 中滴入1~2滴酚酞溶液,装置
中滴入1~2滴酚酞溶液,装置 中溶液颜色为
中溶液颜色为
您最近一年使用:0次
2021-10-09更新
|
589次组卷
|
3卷引用:甘肃省白银市白银区大成学校2021-2022学年高一下学期6月月考化学试题
名校
解题方法
9 . K2FeO4是一种绿色净水剂,易溶于水。某小组在实验室条件下制备K2FeO4并探究其性质。回答下列问题:
实验(一)制备K2FeO4。
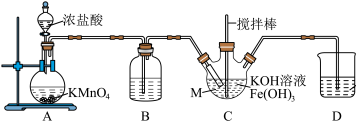
(1)仪器M的名称是_______ ,装置B的作用是________ 。
(2)装置C中生成K2FeO4的化学方程式为_______ 。
(3)实验得知装置D中吸收的Cl2为装置A中生成Cl2的25%,不考虑其他消耗,若装置D中生成的氧化产物只有0.01molNaClO,则生成________ gK2FeO4。
实验(二)探究K2FeO4的性质。
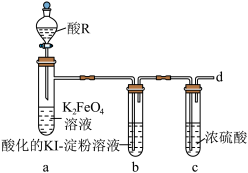
实验中观察到b中溶液变为蓝色,a中溶液由紫红色变为黄色,并产生气泡。
(4)酸R选择稀硫酸,不选择盐酸,其主要原因是_______ ,从d口逸出的气体_______ (填“可以”或“不可以”)直接排放至大气中。
(5)当选用硫酸时,装置a中的离子方程式为_______ 。
(6)另设计一种方案确认有O2产生:_______ 。
实验(一)制备K2FeO4。

(1)仪器M的名称是
(2)装置C中生成K2FeO4的化学方程式为
(3)实验得知装置D中吸收的Cl2为装置A中生成Cl2的25%,不考虑其他消耗,若装置D中生成的氧化产物只有0.01molNaClO,则生成
实验(二)探究K2FeO4的性质。

实验中观察到b中溶液变为蓝色,a中溶液由紫红色变为黄色,并产生气泡。
(4)酸R选择稀硫酸,不选择盐酸,其主要原因是
(5)当选用硫酸时,装置a中的离子方程式为
(6)另设计一种方案确认有O2产生:
您最近一年使用:0次
名校
解题方法
10 . FeBr2是有机催化剂,易潮解。在加热条件下Fe与HBr反应可生成FeBr2。某实验小组用下列装置设计实验制备FeBr2(F的加热装置已省略)。
已知:银氨溶液中存在平衡[Ag(NH3)2]+(aq) Ag+(aq)+2NH3(aq)。
Ag+(aq)+2NH3(aq)。
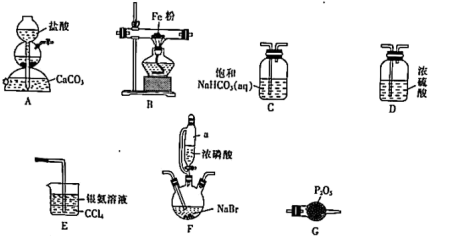
请回答下列问题:
(1)装置A的名称是___ 。
(2)气流从左到右,装置连接顺序为A→______→_____→F→______→______→E(填标号)___ 。
(3)实验中观察到装置E中银氨溶液变浑浊,其原因是____ (用必要的文字和化学用语解释)。
(4)实验室不用浓硝酸与溴化钠反应制备溴化氢,其主要原因是____ 。
(5)设计简易实验检验FeBr2中是否混有Fe单质:___ 。
(6)为了探究FeBr2的性质,设计如下实验:
取21.6gFeBr2溶于水,缓慢通入V1mLCl2 (标准状况),充分反应后,加入适量CCl4,振荡、静置。四氯化碳层呈无色,在水层中滴加KSCN溶液,溶液变红色。由此推知,还原性:Fe2+___ (填“>”“<”或“=”)Br-,V1的最大值为___ 。
(7)测定FeBr2产品纯度:取xgFeBr2产品溶于水,配成250mL溶液,取25.00mL配制的溶液,加入过量的AgNO3溶液中,充分反应后过滤、洗涤、干燥、称重,固体质量为m1g。产品纯度为____ (只列计算式)。
已知:银氨溶液中存在平衡[Ag(NH3)2]+(aq)
 Ag+(aq)+2NH3(aq)。
Ag+(aq)+2NH3(aq)。
请回答下列问题:
(1)装置A的名称是
(2)气流从左到右,装置连接顺序为A→______→_____→F→______→______→E(填标号)
(3)实验中观察到装置E中银氨溶液变浑浊,其原因是
(4)实验室不用浓硝酸与溴化钠反应制备溴化氢,其主要原因是
(5)设计简易实验检验FeBr2中是否混有Fe单质:
(6)为了探究FeBr2的性质,设计如下实验:
取21.6gFeBr2溶于水,缓慢通入V1mLCl2 (标准状况),充分反应后,加入适量CCl4,振荡、静置。四氯化碳层呈无色,在水层中滴加KSCN溶液,溶液变红色。由此推知,还原性:Fe2+
(7)测定FeBr2产品纯度:取xgFeBr2产品溶于水,配成250mL溶液,取25.00mL配制的溶液,加入过量的AgNO3溶液中,充分反应后过滤、洗涤、干燥、称重,固体质量为m1g。产品纯度为
您最近一年使用:0次
2021-10-01更新
|
177次组卷
|
3卷引用:甘肃省白银市靖远县第四中学2022届高三10月月考化学试题



