名校
解题方法
1 . 某小组同学用如图所示装置进行铜与浓硫酸的反应,并探究产物的性质 (夹持装置已略去)。______ ;
(2)若试管②中的试剂为品红溶液,实验中观察到的现象是______ ;
若试管②中的试剂为酸性KMnO4溶液,实验时,观察到溶液褪色,则说明生成的气体具有______ 性。
(3)试管③中的试剂为NaOH溶液,其作用是______ ,反应的离子方程式是______ 。
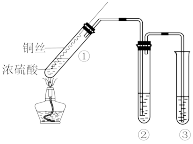
(2)若试管②中的试剂为品红溶液,实验中观察到的现象是
若试管②中的试剂为酸性KMnO4溶液,实验时,观察到溶液褪色,则说明生成的气体具有
(3)试管③中的试剂为NaOH溶液,其作用是
您最近一年使用:0次
2019-12-29更新
|
236次组卷
|
5卷引用:湖北省鄂州市泽林高中2019-2020学年高一上学期期末联考化学试题
2 . 科学的实验方法为我们探索物质世界提供了一把金钥匙。下列实验能达到目的的是( )
| 选项 | 实验目的 | 实验步骤及现象 |
| A | 探究铁与水在高温下发生反应 | 将水蒸气通过灼热的铁粉,观察粉末变为红褐色 |
| B | 证明溶液中含有Fe3+ | 向溶液中加入KSCN溶液,观察到溶液变红 |
| C | 证明钠与氧气反应会生成过氧化钠 | 切开金属钠,钠表面的银白色会逐渐褪去 |
| D | 证明二氧化硫具有漂白性 | 将SO2通入酸性KMnO4溶液中,溶液褪色 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2019-11-28更新
|
188次组卷
|
3卷引用:湖北省咸宁市2018~2019学年高一上学期期末考试化学试题
3 . 已知单质硫是淡黄色固体粉末,难溶于水。实验室制氯气的反应原理为: ,为了比较氯元素和硫元素的非金属性强弱,某化学实验小组设计了如下实验,请回答下列问题:
,为了比较氯元素和硫元素的非金属性强弱,某化学实验小组设计了如下实验,请回答下列问题:

(1)仪器X的名称:_______ 。
(2)用饱和食盐水除去A中生成Cl2中的杂质气体_____ 。(填杂质气体化学式)
(3)碳元素比氯元素的非金属性______ (填“强”或者“弱”)。
(4)装置B中盛放的试剂是Na2S溶液,实验中可观察到的现象是______ 。
(5)装置C燃烧碱稀释液,目的是吸收剩余气体,原因是________ 。
 ,为了比较氯元素和硫元素的非金属性强弱,某化学实验小组设计了如下实验,请回答下列问题:
,为了比较氯元素和硫元素的非金属性强弱,某化学实验小组设计了如下实验,请回答下列问题:
(1)仪器X的名称:
(2)用饱和食盐水除去A中生成Cl2中的杂质气体
(3)碳元素比氯元素的非金属性
(4)装置B中盛放的试剂是Na2S溶液,实验中可观察到的现象是
(5)装置C燃烧碱稀释液,目的是吸收剩余气体,原因是
您最近一年使用:0次
4 . 实验室可用如下装置 略去部分夹持仪器
略去部分夹持仪器 制取
制取 并验证其性质.
并验证其性质.
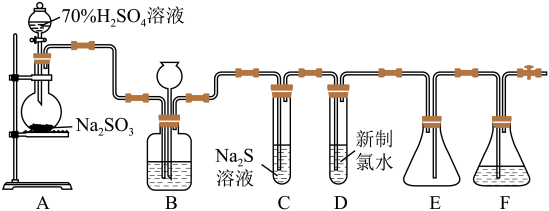
(1)盛装亚硫酸钠的仪器名称为__________ 若将亚硫酸钠改为铜片制取二氧化硫,还缺少的玻璃仪器是________ ,用铜片制取二氧化硫的化学方程式_______ .
(2)装置B的作用之一是通过观察产生气泡的多少判断 生成的快慢,其中的液体最好选择
生成的快慢,其中的液体最好选择____  填代号
填代号 .
.
a. 饱和 溶液 b. 饱和
溶液 b. 饱和 溶液
溶液
c. 饱和 溶液 d. 饱和NaHSO3溶液
溶液 d. 饱和NaHSO3溶液
(3)验证二氧化硫的氧化性的装置是______ ,现象为_______________ .
(4)为验证二氧化硫的还原性,充分反应后,取该试管中的溶液分成三份,分别进行如下实验:
方案I:向第一份溶液中加入 溶液,有白色沉淀生成;
溶液,有白色沉淀生成;
方案Ⅱ:向第二份溶液中加入品红溶液,红色褪去;
方案Ⅲ:向第三份溶液中加入 溶液,产生白色沉淀.
溶液,产生白色沉淀.
上述方案合理的是方案________  填“I”、“Ⅱ”或“Ⅲ”
填“I”、“Ⅱ”或“Ⅲ” ;若将试管D中新制氯水改为酸性高锰酸钾溶液,则发生反应的离子方程式为
;若将试管D中新制氯水改为酸性高锰酸钾溶液,则发生反应的离子方程式为____________________ .
(5)装置F的作用是___________________ 
 略去部分夹持仪器
略去部分夹持仪器 制取
制取 并验证其性质.
并验证其性质.
(1)盛装亚硫酸钠的仪器名称为
(2)装置B的作用之一是通过观察产生气泡的多少判断
 生成的快慢,其中的液体最好选择
生成的快慢,其中的液体最好选择 填代号
填代号 .
.a. 饱和
 溶液 b. 饱和
溶液 b. 饱和 溶液
溶液 c. 饱和
 溶液 d. 饱和NaHSO3溶液
溶液 d. 饱和NaHSO3溶液 (3)验证二氧化硫的氧化性的装置是
(4)为验证二氧化硫的还原性,充分反应后,取该试管中的溶液分成三份,分别进行如下实验:
方案I:向第一份溶液中加入
 溶液,有白色沉淀生成;
溶液,有白色沉淀生成; 方案Ⅱ:向第二份溶液中加入品红溶液,红色褪去;
方案Ⅲ:向第三份溶液中加入
 溶液,产生白色沉淀.
溶液,产生白色沉淀.上述方案合理的是方案
 填“I”、“Ⅱ”或“Ⅲ”
填“I”、“Ⅱ”或“Ⅲ” ;若将试管D中新制氯水改为酸性高锰酸钾溶液,则发生反应的离子方程式为
;若将试管D中新制氯水改为酸性高锰酸钾溶液,则发生反应的离子方程式为(5)装置F的作用是

您最近一年使用:0次
名校
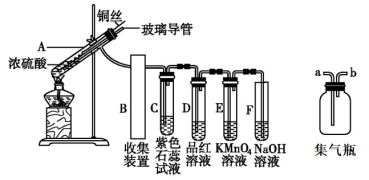
5 . 已知:2FeSO4 Fe2O3+SO2↑+SO3↑,利用下图所示装置检验硫酸亚铁的分解产物(乙、丙、丁中的试剂是足量的)。下列说法中不正确的是
Fe2O3+SO2↑+SO3↑,利用下图所示装置检验硫酸亚铁的分解产物(乙、丙、丁中的试剂是足量的)。下列说法中不正确的是
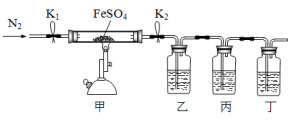
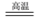 Fe2O3+SO2↑+SO3↑,利用下图所示装置检验硫酸亚铁的分解产物(乙、丙、丁中的试剂是足量的)。下列说法中不正确的是
Fe2O3+SO2↑+SO3↑,利用下图所示装置检验硫酸亚铁的分解产物(乙、丙、丁中的试剂是足量的)。下列说法中不正确的是
| A.乙、丙、丁中依次盛装的试剂可以是BaCl2溶液、品红溶液、NaOH溶液 |
| B.实验开始时,先打开K1和K2,缓缓通入N2一段时间,再点燃酒精喷灯加热 |
| C.若丙中盛装的是酸性KMnO4溶液检验SO2气体时,则SO2表现出还原性 |
| D.为了检验甲中残留固体中含有Fe3+,取少量固体加入稀硝酸溶解,再滴加KSCN溶液 |
您最近一年使用:0次
名校
6 . 某小组同学欲研究SO2的性质。
(1)将相关的含硫物质分为如下表所示3组,第2组中物质X的化学式是________ 。
(2)利用下图所示的装置研究SO2的性质:(熔点:SO2 -76.1 ℃,SO3 16.8 ℃;沸点:SO2 -10 ℃,SO3 45 ℃)

①装置Ⅰ模拟工业生产中SO2催化氧化的反应,其化学方程式是__________________ 。
②甲同学按Ⅰ、Ⅱ、Ⅲ、Ⅳ的顺序连接装置,装置Ⅱ的作用是_____________________ ;装置Ⅳ的作用是_________________ 。
③装置Ⅲ中溶液逐渐褪色,说明SO2具有__________ 性
(1)将相关的含硫物质分为如下表所示3组,第2组中物质X的化学式是
| 第1组 | 第2组 | 第3组 |
| S(单质) | SO2、X、Na2SO3、NaHSO3 | SO3、H2SO4、Na2SO4、NaHSO4 |
(2)利用下图所示的装置研究SO2的性质:(熔点:SO2 -76.1 ℃,SO3 16.8 ℃;沸点:SO2 -10 ℃,SO3 45 ℃)

①装置Ⅰ模拟工业生产中SO2催化氧化的反应,其化学方程式是
②甲同学按Ⅰ、Ⅱ、Ⅲ、Ⅳ的顺序连接装置,装置Ⅱ的作用是
③装置Ⅲ中溶液逐渐褪色,说明SO2具有
您最近一年使用:0次
2019-02-06更新
|
932次组卷
|
3卷引用:【全国百强校】湖北省荆州中学2018-2019学年高一上学期期末考试化学试题
【全国百强校】湖北省荆州中学2018-2019学年高一上学期期末考试化学试题人教版2019必修第二册 第五章 第一节 第1课时 硫和二氧化硫(已下线)第01讲 硫、二氧化硫-【帮课堂】2021-2022学年高一化学同步精品讲义(人教版2019必修第二册)
7 . 实验室常下图装置进行铜跟浓硫酸反应等一系列实验。请回答下列问题
(1)装置B就是右上图的集气瓶,则装置A的导管应连接集气瓶的____ (填“a”或“b”)进口;
(2)用装置A制备SO2的优点主要是_________________________ 。【任答一条即可】;
(3)装置A中的反应方程式为______________________________________________ ;
(4)装置C中的现象是________________ ;反应结束后加热D中溶液,现象是___________ ;
(5)装置E中出现的现象可以说明SO2具有__________ 性;
(6)装置F中的反应的离子方程式为____________________________________________ ;

(1)装置B就是右上图的集气瓶,则装置A的导管应连接集气瓶的
(2)用装置A制备SO2的优点主要是
(3)装置A中的反应方程式为
(4)装置C中的现象是
(5)装置E中出现的现象可以说明SO2具有
(6)装置F中的反应的离子方程式为
您最近一年使用:0次
2019-02-01更新
|
151次组卷
|
2卷引用:【校级联考】湖北省宜昌市协作体2018-2019学年高一上学期期末考试化学试题
8 . 绿矾在高温下易分解,用右图装置检验绿矾的分解产物【加热装置已略去】。化学方程式为:2FeSO4·7H2O Fe2O3+SO2↑+SO3↑+14H2O。二氧化硫的沸点为-10℃,三氧化硫的沸点为44.8℃。其中b为干燥的试管。下列有关说法不正确的是
Fe2O3+SO2↑+SO3↑+14H2O。二氧化硫的沸点为-10℃,三氧化硫的沸点为44.8℃。其中b为干燥的试管。下列有关说法不正确的是
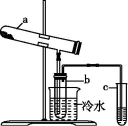
 Fe2O3+SO2↑+SO3↑+14H2O。二氧化硫的沸点为-10℃,三氧化硫的沸点为44.8℃。其中b为干燥的试管。下列有关说法不正确的是
Fe2O3+SO2↑+SO3↑+14H2O。二氧化硫的沸点为-10℃,三氧化硫的沸点为44.8℃。其中b为干燥的试管。下列有关说法不正确的是
| A.SO2是还原产物,Fe2O3是氧化产物 |
| B.b中所得到的硫酸的质量分数理论上为29.5% |
| C.将反应后的气体通入氯化钡溶液中,产生的沉淀为BaSO3、BaSO4 |
| D.将反应后的气体通入硝酸钡溶液中,产生的沉淀为只有BaSO4 |
您最近一年使用:0次
名校
9 . 某研究性学习小组的同学想通过下图实验装置探究SO2与Na2O2反应的产物(夹持装置已略去,装置的气密性良好)。
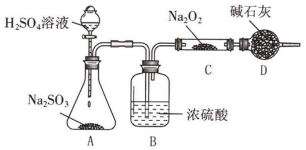
(1)装置A中盛装H2SO4溶液的仪器名称是_____________ 。装置D除了吸收过量的SO2,避免污染空气外,还起到的作用是_________________ 。
(2)对C中固体产物提出如下假设(假设Na2O2已全部反应):
假设1:只有Na2SO3。假设2:__________ ;假设3:既有Na2SO3又有Na2SO4。
①甲同学认为SO2与Na2O2的反应不同于CO2,认为假设2成立。请据此写出C中所发生反应的化学方程式:_____________________ 。
②乙同学为证明假设3成立,设计如下实验。实验步骤和结论为:取少量C中固体产物于试管中,加入适量的蒸馏水溶解;滴加过量的1mol•L-1BaCl2溶液,若产生白色沉淀,则证明C中固体产物中有____________ ;滴加适量的1mol•L-1稀盐酸,若白色沉淀部分溶解,并产生刺激性气味气体,则证明C中固体产物中有___________ 。

(1)装置A中盛装H2SO4溶液的仪器名称是
(2)对C中固体产物提出如下假设(假设Na2O2已全部反应):
假设1:只有Na2SO3。假设2:
①甲同学认为SO2与Na2O2的反应不同于CO2,认为假设2成立。请据此写出C中所发生反应的化学方程式:
②乙同学为证明假设3成立,设计如下实验。实验步骤和结论为:取少量C中固体产物于试管中,加入适量的蒸馏水溶解;滴加过量的1mol•L-1BaCl2溶液,若产生白色沉淀,则证明C中固体产物中有
您最近一年使用:0次
10 . 隔绝空气加热至500℃时绿矾(硫酸亚铁晶体)能完全分解,某化学小组为探究分解产物的成分,选用下图所示装置进行实验(夹持装置略),A中固体完全分解后变为红棕色粉末。
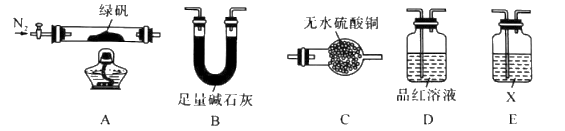
下列说法不正确的是

下列说法不正确的是
| A.所选用装置的正确连接顺序为A-C-E-D-B |
| B.E装置是用来检验SO3,则X可以是硝酸酸化的硝酸钡溶液 |
| C.可选用酸性KMnO4溶液检验A装置中残留固体是否为Fe2O3 |
| D.该反应的化学方程式可能是2FeSO4·7H2O=Fe2O3+SO2↑+SO3↑+14H2O |
您最近一年使用:0次
2018-07-02更新
|
344次组卷
|
2卷引用:【全国市级联考】湖北省天门市、仙桃市、潜江市2017-2018学年高一下学期期末联考化学试题



