1 .  可用于催化剂、光学材料和电子材料等领域。现以氟碳铈矿的烧渣(含
可用于催化剂、光学材料和电子材料等领域。现以氟碳铈矿的烧渣(含 等)为原料制备
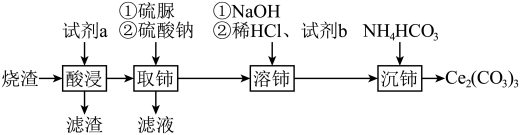
等)为原料制备 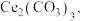 其工艺流程如图所示:
其工艺流程如图所示:
已知:① 易与
易与  成复盐沉淀。
成复盐沉淀。
②硫脲 具有还原性,酸性条件下易被氧化为
具有还原性,酸性条件下易被氧化为 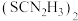 。
。
③一定条件下, 在空气中易被氧化为
在空气中易被氧化为 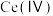 。
。
回答下列问题:
(1)铈为58号元素,其某种核素含有82个中子,该核素的符号为_____________ 。
(2)滤渣中含 元素,试剂
元素,试剂  为
为_________ (填化学式,下同),滤渣的主要成分是_________________ 。
(3)酸浸后得到的酸性滤液中含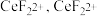 中化学键类型可能为 。
中化学键类型可能为 。
(4)①请写出加入硫脲将 还原为
还原为  的离子方程式
的离子方程式_____________________ 。
②“取铈”时,加入过量硫酸钠的目的是_________________________ 。
(5)“溶铈”时,加入稀 溶解
溶解 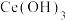 ,同时须加入试剂
,同时须加入试剂 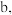 根据题中信息推测,试剂
根据题中信息推测,试剂 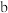 的作用为
的作用为_________________________ 。
(6)①“沉铈”过程中,生成 的离子方程式为
的离子方程式为_________________________ 。
②若常温下,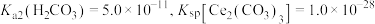 ,溶液中
,溶液中  ,则要使
,则要使  完全沉淀,理论上溶液的
完全沉淀,理论上溶液的  不低于
不低于_________ (金属离子完全沉淀时浓度不高于  )。
)。
 可用于催化剂、光学材料和电子材料等领域。现以氟碳铈矿的烧渣(含
可用于催化剂、光学材料和电子材料等领域。现以氟碳铈矿的烧渣(含 等)为原料制备
等)为原料制备  其工艺流程如图所示:
其工艺流程如图所示:
已知:①
 易与
易与  成复盐沉淀。
成复盐沉淀。②硫脲
 具有还原性,酸性条件下易被氧化为
具有还原性,酸性条件下易被氧化为 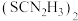 。
。③一定条件下,
 在空气中易被氧化为
在空气中易被氧化为 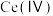 。
。回答下列问题:
(1)铈为58号元素,其某种核素含有82个中子,该核素的符号为
(2)滤渣中含
 元素,试剂
元素,试剂  为
为(3)酸浸后得到的酸性滤液中含
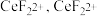 中化学键类型可能为 。
中化学键类型可能为 。| A.离子键 | B. 键 键 | C. 键 键 | D.共价键 |
(4)①请写出加入硫脲将
 还原为
还原为  的离子方程式
的离子方程式②“取铈”时,加入过量硫酸钠的目的是
(5)“溶铈”时,加入稀
 溶解
溶解 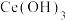 ,同时须加入试剂
,同时须加入试剂 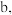 根据题中信息推测,试剂
根据题中信息推测,试剂 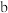 的作用为
的作用为(6)①“沉铈”过程中,生成
 的离子方程式为
的离子方程式为②若常温下,
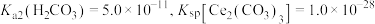 ,溶液中
,溶液中  ,则要使
,则要使  完全沉淀,理论上溶液的
完全沉淀,理论上溶液的  不低于
不低于 )。
)。
您最近半年使用:0次
名校
2 . 某实验小组利用如图装置模拟古法制硫酸并进行 性质探究。
性质探究。
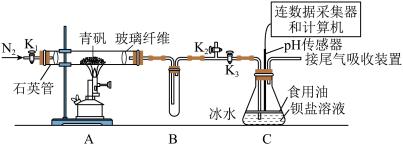
已知:①“青矾”是指 ,高温受热可完全分解得到红棕色固体和气体混合物;
,高温受热可完全分解得到红棕色固体和气体混合物;
② 熔点
熔点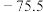 ℃,沸点
℃,沸点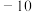 ℃:
℃: 熔点16.8℃,沸点44.8℃。
熔点16.8℃,沸点44.8℃。
请回答下列问题:
Ⅰ.制取硫酸
实验开始前打开活塞 、
、 ,关闭活塞
,关闭活塞 ,通入一段时间
,通入一段时间 后,关闭活塞
后,关闭活塞 、
、 ,打开活塞
,打开活塞 ,用酒精喷灯高温加热青矾。
,用酒精喷灯高温加热青矾。
(1)加热时A装置中发生反应的化学方程式为_____ 。
(2)B装置的作用是_____ 。
(3)将一定量的青矾在500℃时隔绝空气加热一段时间后检验其固体产物,请设计实验证明此固体产物不含二价铁:_____ 。
Ⅱ.探究 的性质
的性质
在装置C中先后三次加入同浓度同体积不同情况的钡盐溶液。控制食用油油层厚度一致、通入 流速一致。三次实验现象如下表:
流速一致。三次实验现象如下表:
分别得到如下 图:
图:

(4)实验①中,曲线呈缓慢下降趋势,原因是_____ 。(用方程式表示)
(5)对比分析②③数据,可得出的结论是_____ 。
Ⅲ. 含量的测定
含量的测定
(6)为对排气法收集到的 气体进行含量测定,将
气体进行含量测定,将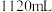 气体(已折算为标准状况)通入足量的
气体(已折算为标准状况)通入足量的 溶液中,经过滤、洗涤、烘干,最终得到沉淀
溶液中,经过滤、洗涤、烘干,最终得到沉淀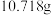 ,则
,则 体的体积分数为
体的体积分数为_____ 。若该实验数据较实际值偏大,则可能的原因是_____ 。
①气体通入速率过快②沉淀未进行恒重操作③收集的气体中有 ④未用食用油覆盖液面
④未用食用油覆盖液面
Ⅳ、 的应用
的应用
 可用于制备硫代硫酸钠晶体
可用于制备硫代硫酸钠晶体 。已知
。已知 易溶于水,在酸性或高温环境下不稳定。主要用作还原剂、定影剂等。
易溶于水,在酸性或高温环境下不稳定。主要用作还原剂、定影剂等。
实验室制备硫代硫酸钠晶体的装置如图所示。

(7)反应结束时,必须控制溶液的pH不能小于7,否则会造成的后果是_____ (用离子方程式表示)。
(8)实验结束后,进行样品纯度的测定。称取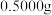 硫代硫酸钠晶体
硫代硫酸钠晶体 样品加水溶解,加几滴淀粉溶液,然后用
样品加水溶解,加几滴淀粉溶液,然后用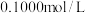 的标准碘液滴定,测得消耗标准碘液体积的平均值为
的标准碘液滴定,测得消耗标准碘液体积的平均值为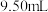 ,则该样品的纯度为
,则该样品的纯度为_____ (保留四位小数)。
已知: ,样品中杂质不参与反应。
,样品中杂质不参与反应。
(9)若滴定前未用标准碘液润洗滴定管,则测定样品中硫代硫酸钠晶体纯度_____ (“偏高”、“偏低”或“无影响”)。
 性质探究。
性质探究。
已知:①“青矾”是指
 ,高温受热可完全分解得到红棕色固体和气体混合物;
,高温受热可完全分解得到红棕色固体和气体混合物;②
 熔点
熔点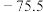 ℃,沸点
℃,沸点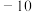 ℃:
℃: 熔点16.8℃,沸点44.8℃。
熔点16.8℃,沸点44.8℃。请回答下列问题:
Ⅰ.制取硫酸
实验开始前打开活塞
 、
、 ,关闭活塞
,关闭活塞 ,通入一段时间
,通入一段时间 后,关闭活塞
后,关闭活塞 、
、 ,打开活塞
,打开活塞 ,用酒精喷灯高温加热青矾。
,用酒精喷灯高温加热青矾。(1)加热时A装置中发生反应的化学方程式为
(2)B装置的作用是
(3)将一定量的青矾在500℃时隔绝空气加热一段时间后检验其固体产物,请设计实验证明此固体产物不含二价铁:
Ⅱ.探究
 的性质
的性质在装置C中先后三次加入同浓度同体积不同情况的钡盐溶液。控制食用油油层厚度一致、通入
 流速一致。三次实验现象如下表:
流速一致。三次实验现象如下表:| 实验 | ① | ② | ③ |
| 所加试剂 | 已煮沸的 溶液 溶液 | 未煮沸的 溶液 溶液 | 已煮沸的 溶液 溶液 |
| 实验现象 | 无白色沉淀生成 | 有白色沉淀生成 | 有白色沉淀生成 |
 图:
图:
(4)实验①中,曲线呈缓慢下降趋势,原因是
(5)对比分析②③数据,可得出的结论是
Ⅲ.
 含量的测定
含量的测定(6)为对排气法收集到的
 气体进行含量测定,将
气体进行含量测定,将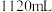 气体(已折算为标准状况)通入足量的
气体(已折算为标准状况)通入足量的 溶液中,经过滤、洗涤、烘干,最终得到沉淀
溶液中,经过滤、洗涤、烘干,最终得到沉淀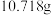 ,则
,则 体的体积分数为
体的体积分数为①气体通入速率过快②沉淀未进行恒重操作③收集的气体中有
 ④未用食用油覆盖液面
④未用食用油覆盖液面Ⅳ、
 的应用
的应用 可用于制备硫代硫酸钠晶体
可用于制备硫代硫酸钠晶体 。已知
。已知 易溶于水,在酸性或高温环境下不稳定。主要用作还原剂、定影剂等。
易溶于水,在酸性或高温环境下不稳定。主要用作还原剂、定影剂等。实验室制备硫代硫酸钠晶体的装置如图所示。

(7)反应结束时,必须控制溶液的pH不能小于7,否则会造成的后果是
(8)实验结束后,进行样品纯度的测定。称取
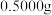 硫代硫酸钠晶体
硫代硫酸钠晶体 样品加水溶解,加几滴淀粉溶液,然后用
样品加水溶解,加几滴淀粉溶液,然后用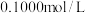 的标准碘液滴定,测得消耗标准碘液体积的平均值为
的标准碘液滴定,测得消耗标准碘液体积的平均值为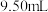 ,则该样品的纯度为
,则该样品的纯度为已知:
 ,样品中杂质不参与反应。
,样品中杂质不参与反应。(9)若滴定前未用标准碘液润洗滴定管,则测定样品中硫代硫酸钠晶体纯度
您最近半年使用:0次
2023-07-13更新
|
666次组卷
|
3卷引用:重庆市万州第二高级中学2023-2024学年高三上学期8月月考化学试题
解题方法
3 . 一维结构氧化钇( )在光学和陶瓷等领域有重要用途。研究小组制备该
)在光学和陶瓷等领域有重要用途。研究小组制备该 的实验过程如下所示。
的实验过程如下所示。

(1)配制100mL2mol/L硝酸需用到的玻璃仪器有___________ 。
A.烧杯 B.量筒 C.温度计 D.玻璃棒 E.漏斗
(2)滴加浓氨水时,用pH试纸测试的具体操作为___________ 。
(3)洗涤时,先用蒸馏水后用乙醇的目的是___________ 。
(4)探究前驱体化学组成的实验装置如图所示(夹持装置略)。
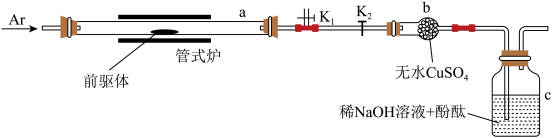
①加热前,打开 关闭
关闭 ,先通入Ar气一段时间;开始加热后,再打开
,先通入Ar气一段时间;开始加热后,再打开 关闭
关闭 ,继续通入Ar气至反应结束后一段时间,使用Ar气的目的除了排出a中的空气之外,其作用还有
,继续通入Ar气至反应结束后一段时间,使用Ar气的目的除了排出a中的空气之外,其作用还有___________ 。
②前驱体受热分解过程中:a中气体略有红棕色,说明产物含有___________ ;b中试剂变蓝,说明产物含有___________ ;c中溶液颜色变化的过程为___________ 。
(5)前驱体不含结晶水,其摩尔质量是587g/mol,阴离子与阳离子(仅有 )的个数比为2.75,则由前驱体生成
)的个数比为2.75,则由前驱体生成 的化学反应方程式为
的化学反应方程式为___________ 。
 )在光学和陶瓷等领域有重要用途。研究小组制备该
)在光学和陶瓷等领域有重要用途。研究小组制备该 的实验过程如下所示。
的实验过程如下所示。
(1)配制100mL2mol/L硝酸需用到的玻璃仪器有
A.烧杯 B.量筒 C.温度计 D.玻璃棒 E.漏斗
(2)滴加浓氨水时,用pH试纸测试的具体操作为
(3)洗涤时,先用蒸馏水后用乙醇的目的是
(4)探究前驱体化学组成的实验装置如图所示(夹持装置略)。

①加热前,打开
 关闭
关闭 ,先通入Ar气一段时间;开始加热后,再打开
,先通入Ar气一段时间;开始加热后,再打开 关闭
关闭 ,继续通入Ar气至反应结束后一段时间,使用Ar气的目的除了排出a中的空气之外,其作用还有
,继续通入Ar气至反应结束后一段时间,使用Ar气的目的除了排出a中的空气之外,其作用还有②前驱体受热分解过程中:a中气体略有红棕色,说明产物含有
(5)前驱体不含结晶水,其摩尔质量是587g/mol,阴离子与阳离子(仅有
 )的个数比为2.75,则由前驱体生成
)的个数比为2.75,则由前驱体生成 的化学反应方程式为
的化学反应方程式为
您最近半年使用:0次
名校
解题方法
4 . 钼酸锂(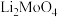 )主要用于溴化锂中央空调的缓冲剂。以精选钼矿(主要成分为
)主要用于溴化锂中央空调的缓冲剂。以精选钼矿(主要成分为 ,含少量
,含少量 等杂质)为原料制备
等杂质)为原料制备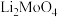 并回收副产品的工艺流程图如下所示:
并回收副产品的工艺流程图如下所示:
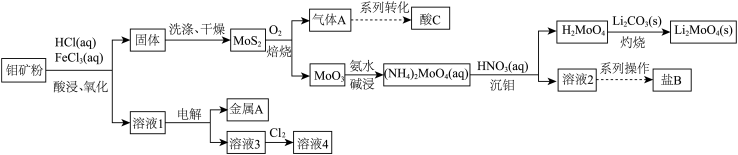
回答下列问题:
(1)酸C是___________ (填化学式,下同),盐B是___________ 。
(2)溶液4可循环用于“酸浸、氧化”,通入氯气的目的是___________ (用离子方程式表示)。
(3)“灼烧”制备钼酸锂的化学方程式为___________ 。
如果在实验室里完成“灼烧”,宜选择___________ (填字母)。
A.石英坩埚 B.铁坩埚 C.陶瓷坩埚 D.蒸发皿
(4)溶液1主要含 、
、 、
、 、
、 、
、 等,“电解”中阴极最先发生的电极反应式为
等,“电解”中阴极最先发生的电极反应式为___________ 。下列试剂不能检验 洗涤干净的是
洗涤干净的是___________ (填序号)。
①铁氰化钾溶液 ②酚酞溶液 ③ 溶液 ④
溶液 ④ 溶液
溶液
(5)钼矿粉在一定量浓度的盐酸、氯化铁混合液中的“浸取率”与温度的关系如图所示。
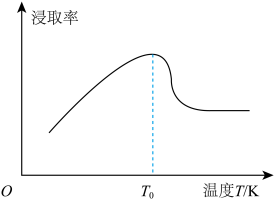
简述温度高于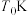 时“浸取率”急剧下降的主要原因:
时“浸取率”急剧下降的主要原因:___________ (答两点)。
(6)已知常温下,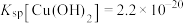 ,
,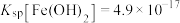 ,若溶液1中
,若溶液1中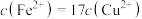 ,
,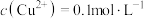 。向溶液1中滴加稀
。向溶液1中滴加稀 溶液使
溶液使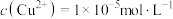 时,此时是否有
时,此时是否有 生成?
生成?___________ (通过计算说明)。
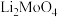 )主要用于溴化锂中央空调的缓冲剂。以精选钼矿(主要成分为
)主要用于溴化锂中央空调的缓冲剂。以精选钼矿(主要成分为 ,含少量
,含少量 等杂质)为原料制备
等杂质)为原料制备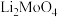 并回收副产品的工艺流程图如下所示:
并回收副产品的工艺流程图如下所示:
回答下列问题:
(1)酸C是
(2)溶液4可循环用于“酸浸、氧化”,通入氯气的目的是
(3)“灼烧”制备钼酸锂的化学方程式为
如果在实验室里完成“灼烧”,宜选择
A.石英坩埚 B.铁坩埚 C.陶瓷坩埚 D.蒸发皿
(4)溶液1主要含
 、
、 、
、 、
、 、
、 等,“电解”中阴极最先发生的电极反应式为
等,“电解”中阴极最先发生的电极反应式为 洗涤干净的是
洗涤干净的是①铁氰化钾溶液 ②酚酞溶液 ③
 溶液 ④
溶液 ④ 溶液
溶液(5)钼矿粉在一定量浓度的盐酸、氯化铁混合液中的“浸取率”与温度的关系如图所示。

简述温度高于
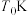 时“浸取率”急剧下降的主要原因:
时“浸取率”急剧下降的主要原因:(6)已知常温下,
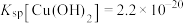 ,
,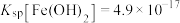 ,若溶液1中
,若溶液1中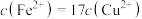 ,
,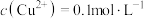 。向溶液1中滴加稀
。向溶液1中滴加稀 溶液使
溶液使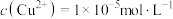 时,此时是否有
时,此时是否有 生成?
生成?
您最近半年使用:0次
名校
解题方法
5 . 已知Na2SO3 +S= Na2S2O3,实验室用下述方法制备 固体:①铜和浓硫酸加热产生
固体:①铜和浓硫酸加热产生 ;②将
;②将 通入含
通入含 和
和 的混合溶液,溶液先变浑浊,后逐渐澄清,反应结束;③将溶液经浓缩结晶、过滤洗涤等操作得到
的混合溶液,溶液先变浑浊,后逐渐澄清,反应结束;③将溶液经浓缩结晶、过滤洗涤等操作得到 产品。下列说法错误的是
产品。下列说法错误的是
 固体:①铜和浓硫酸加热产生
固体:①铜和浓硫酸加热产生 ;②将
;②将 通入含
通入含 和
和 的混合溶液,溶液先变浑浊,后逐渐澄清,反应结束;③将溶液经浓缩结晶、过滤洗涤等操作得到
的混合溶液,溶液先变浑浊,后逐渐澄清,反应结束;③将溶液经浓缩结晶、过滤洗涤等操作得到 产品。下列说法错误的是
产品。下列说法错误的是A.①中消耗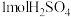 转移 转移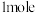 |
| B.②中溶液先变浑浊的原因:2Na2S+3SO2= 2Na2SO3+3S↓ |
C.为提高产品的纯度,混合液中 的最佳比例为1∶2 的最佳比例为1∶2 |
D.用适量 溶液吸收②中逸出的 溶液吸收②中逸出的 、 、 气体,吸收液可直接返回到步骤② 气体,吸收液可直接返回到步骤② |
您最近半年使用:0次
2023-01-14更新
|
2846次组卷
|
9卷引用:重庆市渝北中学2023-2024学年高三9月月考质量监测化学试题
6 . 四氧化三锰是一种重要的电子和新能源基础原材料,可以用于生产软磁锰锌铁氧体、锂电正极材料锰酸锂和负温度系数热敏电阻等。以软锰矿(主要成分为 还含少量Fe、Si、Al等的氧化物)和硫铁矿(主要成分
还含少量Fe、Si、Al等的氧化物)和硫铁矿(主要成分 )为原料制备大颗粒的电池
)为原料制备大颗粒的电池 。
。
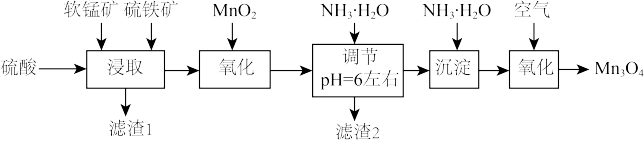
说明:
Ⅰ.“浸取”:研究发现,酸浸时 和
和 颗粒反应的原理如图1所示(部分产物未标出)。
颗粒反应的原理如图1所示(部分产物未标出)。
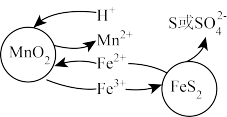
图1
Ⅱ.通空气“氧化”:将“沉淀”步骤所得含少量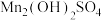 的
的 固体滤出,洗净,加水打成浆,浆液边加热边持续通入空气,制得
固体滤出,洗净,加水打成浆,浆液边加热边持续通入空气,制得 。
。
Ⅲ.氢氧化物形式完全沉淀时溶液的pH见表:
(1)滤渣1中主要成分的化学式为_______ 。
(2)随硫铁矿的增加,锰的浸出率降低,可能的原因是_______ 。
(3)写出“浸取”时 与
与 反应的离子方程式为
反应的离子方程式为_______ 。
(4)加入 “氧化”的目的是
“氧化”的目的是_______ 。
(5)检验“沉淀”已洗净的操作是_______ 。
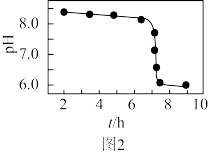
(6)“沉淀”加热通空气过程中溶液pH随时间变化如图2所示,其中pH先基本不变后迅速下降的原因是_______ 。
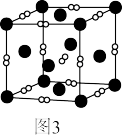
(7)一个立方体结构的 晶胞如图3所示,距离
晶胞如图3所示,距离 最近的
最近的 有
有_______ 个,已知阿伏加德罗数值为 ,则
,则 的晶体密度为
的晶体密度为 ,则晶胞的边长为
,则晶胞的边长为_______ nm(用含ρ、 的代数式表示)。
的代数式表示)。
 还含少量Fe、Si、Al等的氧化物)和硫铁矿(主要成分
还含少量Fe、Si、Al等的氧化物)和硫铁矿(主要成分 )为原料制备大颗粒的电池
)为原料制备大颗粒的电池 。
。
说明:
Ⅰ.“浸取”:研究发现,酸浸时
 和
和 颗粒反应的原理如图1所示(部分产物未标出)。
颗粒反应的原理如图1所示(部分产物未标出)。
图1
Ⅱ.通空气“氧化”:将“沉淀”步骤所得含少量
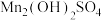 的
的 固体滤出,洗净,加水打成浆,浆液边加热边持续通入空气,制得
固体滤出,洗净,加水打成浆,浆液边加热边持续通入空气,制得 。
。Ⅲ.氢氧化物形式完全沉淀时溶液的pH见表:
| 沉淀物 |  |  |  |  |
| 开始沉淀的pH | 3.4 | 2.2 | 6.3 | 8.1 |
| 完全沉淀的pH | 5.2 | 3.2 | 9.7 | 10.4 |
(2)随硫铁矿的增加,锰的浸出率降低,可能的原因是
(3)写出“浸取”时
 与
与 反应的离子方程式为
反应的离子方程式为(4)加入
 “氧化”的目的是
“氧化”的目的是(5)检验“沉淀”已洗净的操作是
(6)“沉淀”加热通空气过程中溶液pH随时间变化如图2所示,其中pH先基本不变后迅速下降的原因是

(7)一个立方体结构的
 晶胞如图3所示,距离
晶胞如图3所示,距离 最近的
最近的 有
有 ,则
,则 的晶体密度为
的晶体密度为 ,则晶胞的边长为
,则晶胞的边长为 的代数式表示)。
的代数式表示)。
您最近半年使用:0次
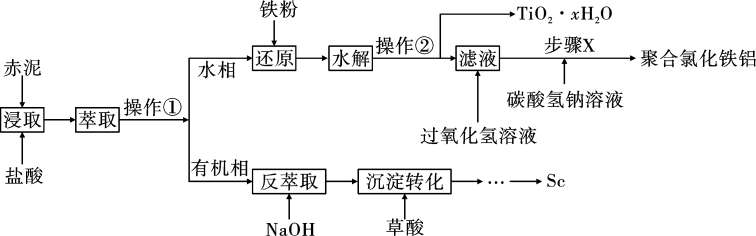
7 . 钪(Sc)是一种重要的稀土金属,常用来制特种玻璃、轻质耐高温合金。从“赤泥”矿(主要成分为 、
、 、
、 、
、 )中回收钪,同时生产聚合氯化铁铝[
)中回收钪,同时生产聚合氯化铁铝[ ]具有极其重要的工业价值,一种工艺流程如图所示:
]具有极其重要的工业价值,一种工艺流程如图所示:
已知:钪离子可以在不同pH下生成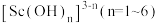 。请回答以下问题:
。请回答以下问题:
(1)基态钪原子的核外电子排布式为______ ,草酸的沸点比醋酸______ (填“高”或“低”)。
(2)操作①的名称为______ 。
(3)“反萃取”时若加入的氢氧化钠过量则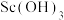 沉淀会溶解。写出
沉淀会溶解。写出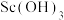 与过量NaOH溶液反应生成
与过量NaOH溶液反应生成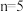 的含钪产物的离子方程式:
的含钪产物的离子方程式:_______ 。
(4)水解步骤中利于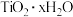 形成的措施有
形成的措施有________ 。(写两条即可)
(5)步骤X中生成聚合氯化铁铝[ ]的化学方程式为
]的化学方程式为_______ 。
(6)已知:常温下,在有 存在时,三价Sc的存在形式与
存在时,三价Sc的存在形式与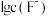 、pH的关系如图所示。请判断当
、pH的关系如图所示。请判断当 ,
, 时三价Sc的存在形式为
时三价Sc的存在形式为______ (填化学式)( )。
)。
(7)常用 将
将 转化为草酸钪沉淀。向含
转化为草酸钪沉淀。向含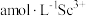 溶液中加入一定量
溶液中加入一定量 溶液,调节溶液的
溶液,调节溶液的 ,当
,当 浓度为
浓度为 -时,
-时, 开始沉淀,则
开始沉淀,则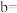
______ 。{已知: 的
的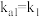 ,
,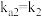 ;
;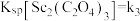 (用含a、c、
(用含a、c、 、
、 和
和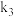 的计算式表示)
的计算式表示)
 、
、 、
、 、
、 )中回收钪,同时生产聚合氯化铁铝[
)中回收钪,同时生产聚合氯化铁铝[ ]具有极其重要的工业价值,一种工艺流程如图所示:
]具有极其重要的工业价值,一种工艺流程如图所示:
已知:钪离子可以在不同pH下生成
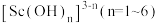 。请回答以下问题:
。请回答以下问题:(1)基态钪原子的核外电子排布式为
(2)操作①的名称为
(3)“反萃取”时若加入的氢氧化钠过量则
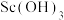 沉淀会溶解。写出
沉淀会溶解。写出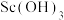 与过量NaOH溶液反应生成
与过量NaOH溶液反应生成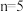 的含钪产物的离子方程式:
的含钪产物的离子方程式:(4)水解步骤中利于
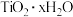 形成的措施有
形成的措施有(5)步骤X中生成聚合氯化铁铝[
 ]的化学方程式为
]的化学方程式为(6)已知:常温下,在有
 存在时,三价Sc的存在形式与
存在时,三价Sc的存在形式与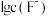 、pH的关系如图所示。请判断当
、pH的关系如图所示。请判断当 ,
, 时三价Sc的存在形式为
时三价Sc的存在形式为 )。
)。
(7)常用
 将
将 转化为草酸钪沉淀。向含
转化为草酸钪沉淀。向含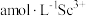 溶液中加入一定量
溶液中加入一定量 溶液,调节溶液的
溶液,调节溶液的 ,当
,当 浓度为
浓度为 -时,
-时, 开始沉淀,则
开始沉淀,则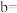
 的
的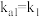 ,
,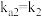 ;
;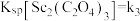 (用含a、c、
(用含a、c、 、
、 和
和 的计算式表示)
的计算式表示)
您最近半年使用:0次
2022-08-16更新
|
748次组卷
|
2卷引用:重庆市巴蜀中学2023届高三第一次高考适应性月考化学试题
2020·吉林延边·一模
8 . 草酸亚铁晶体(FeC2O4·2H2O,M=180g/mol)呈淡黄色,可用于晒制蓝图。某实验小组对其进行了一系列探究。
Ⅰ.纯净草酸亚铁晶体热分解产物的探究
(1)气体产物成分的探究。小组成员采用如图装置进行实验:
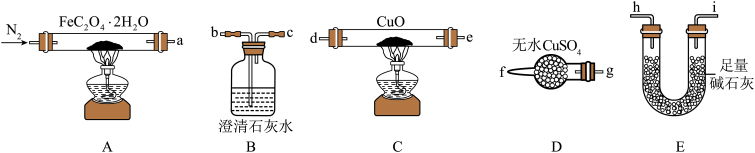
①按照气流从左到右的方向,上述装置的接口顺序为a→g→f→___ →尾气处理装置(仪器可重复使用)。
②检查装置气密性后,先通入一段时间N2,其目的为__ 。
③实验证明了气体产物中含有CO,依据的实验现象为__ 。
④结束实验时先熄灭A、C处的酒精灯再停止通入N2,其目的是__ 。
(2)小组成员设计实验证明了A中分解后的固体成分为FeO,则草酸亚铁晶体分解的化学方程式为__ 。
(3)晒制蓝图时,草酸亚铁晶体是感光剂,会失去结晶水转化为FeC2O4,现以K3[Fe(CN)6]溶液为显色剂,该显色反应的化学方程式为__ 。
Ⅱ.草酸亚铁晶体样品纯度的测定
工业制得的草酸亚铁晶体中常含有FeSO4杂质,测定其纯度的步骤如下:
步骤1:称取mg草酸亚铁晶体样品并溶于稀H2SO4中,配成250mL溶液;
步骤2:取上述溶液25.00mL,用cmol·L-1KMnO4标准液滴定至终点,消耗标准液V1mL;
步骤3:向反应后溶液中加入适量锌粉,充分反应后,加入适量稀H2SO4,再用cmol·L-1KMnO4标准溶液滴定至终点,消耗标准液V2mL。
(4)步骤2中滴定终点的现象为__ ;步骤3中加入锌粉的目的为___ 。
(5)若步骤 配制溶液时部分Fe2+被氧化变质,则测定结果将
配制溶液时部分Fe2+被氧化变质,则测定结果将__ (填“偏高”、“偏低”或“不变”)
Ⅰ.纯净草酸亚铁晶体热分解产物的探究
(1)气体产物成分的探究。小组成员采用如图装置进行实验:

①按照气流从左到右的方向,上述装置的接口顺序为a→g→f→
②检查装置气密性后,先通入一段时间N2,其目的为
③实验证明了气体产物中含有CO,依据的实验现象为
④结束实验时先熄灭A、C处的酒精灯再停止通入N2,其目的是
(2)小组成员设计实验证明了A中分解后的固体成分为FeO,则草酸亚铁晶体分解的化学方程式为
(3)晒制蓝图时,草酸亚铁晶体是感光剂,会失去结晶水转化为FeC2O4,现以K3[Fe(CN)6]溶液为显色剂,该显色反应的化学方程式为
Ⅱ.草酸亚铁晶体样品纯度的测定
工业制得的草酸亚铁晶体中常含有FeSO4杂质,测定其纯度的步骤如下:
步骤1:称取mg草酸亚铁晶体样品并溶于稀H2SO4中,配成250mL溶液;
步骤2:取上述溶液25.00mL,用cmol·L-1KMnO4标准液滴定至终点,消耗标准液V1mL;
步骤3:向反应后溶液中加入适量锌粉,充分反应后,加入适量稀H2SO4,再用cmol·L-1KMnO4标准溶液滴定至终点,消耗标准液V2mL。
(4)步骤2中滴定终点的现象为
(5)若步骤
 配制溶液时部分Fe2+被氧化变质,则测定结果将
配制溶液时部分Fe2+被氧化变质,则测定结果将
您最近半年使用:0次
2020-06-12更新
|
1208次组卷
|
3卷引用:实验探究题
20-21高三上·四川绵阳·阶段练习
名校
解题方法
9 . 三氯乙醛(CCl3CHO)是生产农药、医药的重要中间体,实验室制备三氯乙醛的反应装置示意图(加热装置未画出)和有关数据如下:
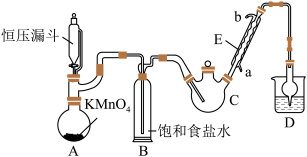
①制备反应原理:C2H5OH+4Cl2→CCl3CHO+5HCl
②相关物质的相对分子质量及部分物理性质:
(1)恒压漏斗中盛放的试剂的名称是_____ ,盛放KMnO4仪器的名称是_____ 。
(2)反应过程中C2H5OH和HCl可能会生成副产物C2H5Cl,同时CCl3CHO(三氯乙醛)也能被次氯酸继续氧化生成CCl3COOH(三氯乙酸),写出三氯乙醛被次氯酸氧化生成三氯乙酸的化学方程式______ 。
(3)该设计流程中存在一处缺陷是______ ,导致引起的后果是______ ,装置B的作用是____ 。
(4)反应结束后,有人提出先将C中的混合物冷却到室温,再用分液的方法分离出三氯乙酸。你认为此方案是否可行____ (填是或否),原因是______ 。
(5)测定产品纯度:称取产品0.36g配成待测溶液,加入0.1000mol•L −1碘标准溶液 20.00mL,再加适量Na2CO3溶液,反应完全后加盐酸调溶液pH,立即用0.02000mol•L −1Na2S2O3溶液滴定至终点。进行三次平行实验,测得平均消耗Na2S2O3溶液20.00mL。则产品的纯度为_____ (计算结果保留四位有效数字)。滴定原理:CCl3CHO+OH-=CHCl3+HCOO-、HCOO-+I2=H++2I-+CO2、I2+2S2O32-=2I-+S4O62-

①制备反应原理:C2H5OH+4Cl2→CCl3CHO+5HCl
②相关物质的相对分子质量及部分物理性质:
相对分子质量 | 熔点/℃ | 沸点/℃ | 溶解性 | |
C2H5OH | 46 | -114. 1 | 78.3 | 与水互溶 |
CC13CHO | 147. 5 | -57. 5 | 97.8 | 可溶于水、乙醇 |
CC13COOH | 163. 5 | 58 | 198 | 可溶于水、乙醇、三氯乙醛 |
C2H5C1 | 64. 5 | -138.7 | 12.3 | 微溶于水,可溶于乙醇 |
(2)反应过程中C2H5OH和HCl可能会生成副产物C2H5Cl,同时CCl3CHO(三氯乙醛)也能被次氯酸继续氧化生成CCl3COOH(三氯乙酸),写出三氯乙醛被次氯酸氧化生成三氯乙酸的化学方程式
(3)该设计流程中存在一处缺陷是
(4)反应结束后,有人提出先将C中的混合物冷却到室温,再用分液的方法分离出三氯乙酸。你认为此方案是否可行
(5)测定产品纯度:称取产品0.36g配成待测溶液,加入0.1000mol•L −1碘标准溶液 20.00mL,再加适量Na2CO3溶液,反应完全后加盐酸调溶液pH,立即用0.02000mol•L −1Na2S2O3溶液滴定至终点。进行三次平行实验,测得平均消耗Na2S2O3溶液20.00mL。则产品的纯度为
您最近半年使用:0次
解题方法
10 . 钼酸钠(Na2MoO4)具有广泛的用途.可做新型水处理荆、优良的金属缓蚀剂及可用于局部过热的循环水系统;Al(OH)3工业和医药上都具有重要用途.现从某废钼催化剂(主要成分MoO3、Al2O3、Fe2O3等)中回收Na2MoO4和Al(OH)3,其工艺如图:
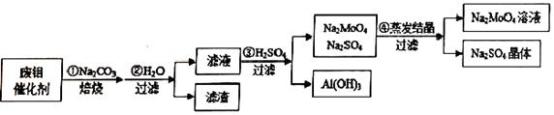
回答下列问题:
(1)已知MoO3、Al2O3与SiO2相似,均能在高温下跟Na2CO3发生类似反应,试写出MoO3与Na2CO3反应的化学方程式:__________________ 。
(2)第②步操作所后的滤液中,溶质有Na2MoO4、_________ 和过量的Na2CO3;检验第②步操作所得滤渣中含有三价铁的方法是___________________ 。
(3)第③步操作H2SO4需要适量,通常是通过_________ 来调控H2SO4的用量;与Na2SO4相比,Na2MoO4的溶解度受温度的影响变化__________ (填“较大”或“较小”)。
(4)利用铝热反应可回收金属钼。将所得钼酸钠溶液用酸处理得到沉淀,再加热可得MoO3。写出MoO3发生铝热反应的化学方程式:_________________ 。
(5)取废钼催化剂5.00g,加入5.30gNa2CO3(足量),经上述实验操作后,最终得到2.34g Al(OH)3和6.39gNa2SO4晶体,则废钼催化剂中Al2O3、MoO3的物质的量的比值为_______ 。

回答下列问题:
(1)已知MoO3、Al2O3与SiO2相似,均能在高温下跟Na2CO3发生类似反应,试写出MoO3与Na2CO3反应的化学方程式:
(2)第②步操作所后的滤液中,溶质有Na2MoO4、
(3)第③步操作H2SO4需要适量,通常是通过
(4)利用铝热反应可回收金属钼。将所得钼酸钠溶液用酸处理得到沉淀,再加热可得MoO3。写出MoO3发生铝热反应的化学方程式:
(5)取废钼催化剂5.00g,加入5.30gNa2CO3(足量),经上述实验操作后,最终得到2.34g Al(OH)3和6.39gNa2SO4晶体,则废钼催化剂中Al2O3、MoO3的物质的量的比值为
您最近半年使用:0次



