1 . 对氯甲苯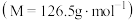 常作为染料、医药、有机合成的中间体,也可用作溶剂。其制取原理是:先用芳胺在一定条件下制成芳香重氮盐,然后在CuCl催化下,芳香重氮盐中的重氮基被氯原子取代生成芳香族氯化物。其原理如下:
常作为染料、医药、有机合成的中间体,也可用作溶剂。其制取原理是:先用芳胺在一定条件下制成芳香重氮盐,然后在CuCl催化下,芳香重氮盐中的重氮基被氯原子取代生成芳香族氯化物。其原理如下:
I.CuCl沉淀的制备
(1)将 、NaCl、
、NaCl、 、NaOH在水溶液中加热一段时间后,即可得到CuCl沉淀。
、NaOH在水溶液中加热一段时间后,即可得到CuCl沉淀。 俗称
俗称________ ,请写出该反应的离子方程式________ 。
Ⅱ.重氮盐溶液的制备 溶液过量可能带来的弊端是
溶液过量可能带来的弊端是________ ;可用尿素 将其除去,生成的气体无污染,请写出该反应的离子方程式
将其除去,生成的气体无污染,请写出该反应的离子方程式________ 。
Ⅲ.对氯甲苯的制备________ ;________ (填序号)。
①熄灭酒精灯 ②打开旋塞 ③停止通冷凝水
(4)CuCl催化机理分两步进行,请补充完整:________ 。
(5)对氯甲苯粗品经过精制后,得到1.50g产品,本实验的产率最接近于________(填标号)。
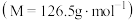 常作为染料、医药、有机合成的中间体,也可用作溶剂。其制取原理是:先用芳胺在一定条件下制成芳香重氮盐,然后在CuCl催化下,芳香重氮盐中的重氮基被氯原子取代生成芳香族氯化物。其原理如下:
常作为染料、医药、有机合成的中间体,也可用作溶剂。其制取原理是:先用芳胺在一定条件下制成芳香重氮盐,然后在CuCl催化下,芳香重氮盐中的重氮基被氯原子取代生成芳香族氯化物。其原理如下: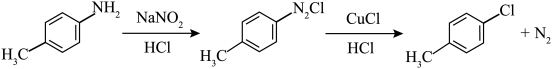
I.CuCl沉淀的制备
(1)将
 、NaCl、
、NaCl、 、NaOH在水溶液中加热一段时间后,即可得到CuCl沉淀。
、NaOH在水溶液中加热一段时间后,即可得到CuCl沉淀。 俗称
俗称Ⅱ.重氮盐溶液的制备
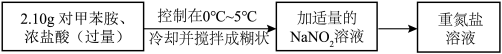
 溶液过量可能带来的弊端是
溶液过量可能带来的弊端是 将其除去,生成的气体无污染,请写出该反应的离子方程式
将其除去,生成的气体无污染,请写出该反应的离子方程式Ⅲ.对氯甲苯的制备
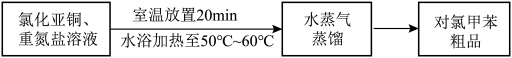
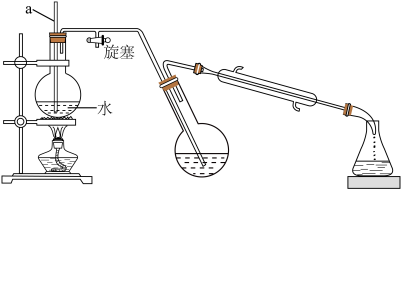
①熄灭酒精灯 ②打开旋塞 ③停止通冷凝水
(4)CuCl催化机理分两步进行,请补充完整:
①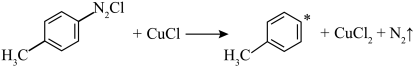
(5)对氯甲苯粗品经过精制后,得到1.50g产品,本实验的产率最接近于________(填标号)。
| A.55% | B.60% | C.65% | D.70% |
您最近一年使用:0次
名校
2 . 金属矿物常以硫化物形式存在,如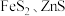 等。
等。
Ⅰ.掺烧 和
和 ,用于制铁精粉和硫酸
,用于制铁精粉和硫酸
(1)已知: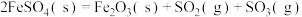 为吸热反应。
为吸热反应。 时,
时, 固体在
固体在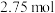 氧气中完全燃烧生成气态
氧气中完全燃烧生成气态 和
和 固体,放出
固体,放出 热量。
热量。
① 与
与 反应的热化学方程式为
反应的热化学方程式为_________ 。
②将 与
与 掺烧(混合燃烧),其目的包括
掺烧(混合燃烧),其目的包括_________ (填字母)。
 节约燃料和能量
节约燃料和能量  为制备硫酸提供原料
为制备硫酸提供原料  减少空气污染
减少空气污染
(2) 常带一定量的结晶水。
常带一定量的结晶水。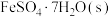 分解脱水反应的能量变化如图所示。
分解脱水反应的能量变化如图所示。
_________  。
。
②为维持炉内温度基本不变, 所带结晶水越多,掺烧比
所带结晶水越多,掺烧比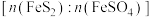 应
应_________ 。(填“增大”“减小”或“不变”)。
Ⅱ.浸出法处理
(3) 难溶于水,处理
难溶于水,处理 常使用酸浸法,两步反应依次为:
常使用酸浸法,两步反应依次为:
ⅰ.
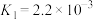
ⅱ.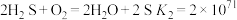
①平衡常数 的表达式为
的表达式为_________ 。
②仅发生反应ⅰ时, 酸浸效果不好,结合平衡常数说明原因:
酸浸效果不好,结合平衡常数说明原因:_________ 。
(4)从平衡移动角度解释通入 在
在 酸浸过程中的作用:
酸浸过程中的作用:_________ 。
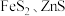 等。
等。Ⅰ.掺烧
 和
和 ,用于制铁精粉和硫酸
,用于制铁精粉和硫酸(1)已知:
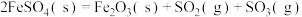 为吸热反应。
为吸热反应。 时,
时, 固体在
固体在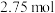 氧气中完全燃烧生成气态
氧气中完全燃烧生成气态 和
和 固体,放出
固体,放出 热量。
热量。①
 与
与 反应的热化学方程式为
反应的热化学方程式为②将
 与
与 掺烧(混合燃烧),其目的包括
掺烧(混合燃烧),其目的包括 节约燃料和能量
节约燃料和能量  为制备硫酸提供原料
为制备硫酸提供原料  减少空气污染
减少空气污染(2)
 常带一定量的结晶水。
常带一定量的结晶水。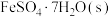 分解脱水反应的能量变化如图所示。
分解脱水反应的能量变化如图所示。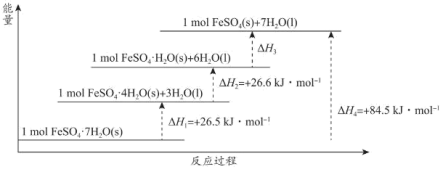

 。
。②为维持炉内温度基本不变,
 所带结晶水越多,掺烧比
所带结晶水越多,掺烧比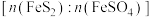 应
应Ⅱ.浸出法处理

(3)
 难溶于水,处理
难溶于水,处理 常使用酸浸法,两步反应依次为:
常使用酸浸法,两步反应依次为:ⅰ.

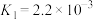
ⅱ.
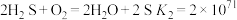
①平衡常数
 的表达式为
的表达式为②仅发生反应ⅰ时,
 酸浸效果不好,结合平衡常数说明原因:
酸浸效果不好,结合平衡常数说明原因:(4)从平衡移动角度解释通入
 在
在 酸浸过程中的作用:
酸浸过程中的作用:
您最近一年使用:0次
名校
解题方法
3 .  (二氯化一氯五氨合钴)是一种易溶于热水、常温下难溶于水和乙醇的紫红色晶体。因在离子鉴定、电镀、医学方面的广泛应用受到人们的关注。
(二氯化一氯五氨合钴)是一种易溶于热水、常温下难溶于水和乙醇的紫红色晶体。因在离子鉴定、电镀、医学方面的广泛应用受到人们的关注。
某化学兴趣小组完成了部分该实验的实验报告:
Ⅰ.将适量氯化铵溶于浓氨水中,充分搅拌下,分批次加入 晶体,得到
晶体,得到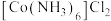 沉淀。
沉淀。
Ⅱ.边搅拌边慢慢滴入足量 溶液,得到
溶液,得到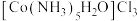 溶液。
溶液。
Ⅲ.慢慢注入适量浓盐酸,得到沉淀,水浴加热,冷却至室温,得到紫红色晶体,减压过滤。
Ⅳ.依次用不同试剂洗涤晶体,烘干,得到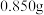 产品。
产品。
查阅资料显示: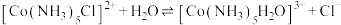
二、实验装置(部分)
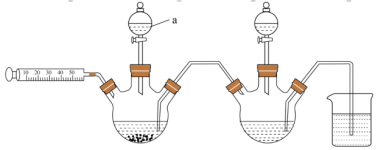
三、实验反思
(1)仪器a的名称是________ 。
(2)本实验涉及钴配合物的配体有________________ (填化学式),步骤Ⅱ所得钴配合物溶液中外界离子的检验方法是__________________________________________________ 。
(3)本实验应在通风橱中进行,原因是___________________________________ 。
(4)步骤Ⅰ中分批次加入 晶体,原因是
晶体,原因是________________________ 。
(5)步骤Ⅱ中加入双氧水的目的是________________________ ;步骤Ⅲ中加入适量浓盐酸的目的是______________________ 。
(6)步骤Ⅳ洗涤操作为:先用冷水洗涤,再用乙醇洗涤。其中,乙醇洗涤的目的是__________________ 。
四、数据处理
评分标准:(已知:产率 )
)
(7)通过计算判断该兴趣小组本次实验的评分等第_______ 。(写出计算过程)
 (二氯化一氯五氨合钴)是一种易溶于热水、常温下难溶于水和乙醇的紫红色晶体。因在离子鉴定、电镀、医学方面的广泛应用受到人们的关注。
(二氯化一氯五氨合钴)是一种易溶于热水、常温下难溶于水和乙醇的紫红色晶体。因在离子鉴定、电镀、医学方面的广泛应用受到人们的关注。某化学兴趣小组完成了部分该实验的实验报告:
化学实验报告
题目:制备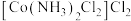
Ⅰ.将适量氯化铵溶于浓氨水中,充分搅拌下,分批次加入
 晶体,得到
晶体,得到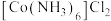 沉淀。
沉淀。Ⅱ.边搅拌边慢慢滴入足量
 溶液,得到
溶液,得到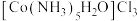 溶液。
溶液。Ⅲ.慢慢注入适量浓盐酸,得到沉淀,水浴加热,冷却至室温,得到紫红色晶体,减压过滤。
Ⅳ.依次用不同试剂洗涤晶体,烘干,得到
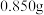 产品。
产品。查阅资料显示:
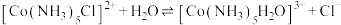
二、实验装置(部分)

三、实验反思
(1)仪器a的名称是
(2)本实验涉及钴配合物的配体有
(3)本实验应在通风橱中进行,原因是
(4)步骤Ⅰ中分批次加入
 晶体,原因是
晶体,原因是(5)步骤Ⅱ中加入双氧水的目的是
(6)步骤Ⅳ洗涤操作为:先用冷水洗涤,再用乙醇洗涤。其中,乙醇洗涤的目的是
四、数据处理
评分标准:(已知:产率
 )
)| 产率 | 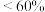 |  |  |
| 评分等第 | 需努力 | 良好 | 优秀 |
(7)通过计算判断该兴趣小组本次实验的评分等第
您最近一年使用:0次
4 . 碘微溶于水,若水中含I﹣,碘溶解度增大,因为存在平衡: 。某同学设计如下实验测定该反应的平衡常数,并从某废碘液(Ⅰ2、
。某同学设计如下实验测定该反应的平衡常数,并从某废碘液(Ⅰ2、 、
、 和淀粉)回收Ⅰ2。回答下列问题:
和淀粉)回收Ⅰ2。回答下列问题:
(1)反应 平衡常数测定,步骤如下:
平衡常数测定,步骤如下:
I.将一定质量的单质Ⅰ2完全溶于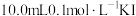 溶液中(假定溶液体积不变),加入10mLCCl4,振荡,静置后分液;
溶液中(假定溶液体积不变),加入10mLCCl4,振荡,静置后分液;
Ⅱ.实验测得上层溶液中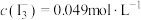 ;
;
Ⅲ.滴定下层溶液至终点时,消耗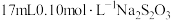 溶液
溶液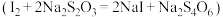 。
。
已知: 、
、 不溶于CCl4;一定温度下碘单质在四氯化碳和水混合液体中,碘单质的浓度比值即
不溶于CCl4;一定温度下碘单质在四氯化碳和水混合液体中,碘单质的浓度比值即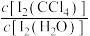 是一个常数(用KD表示,称为分配系数),且室温条件下KD=85。
是一个常数(用KD表示,称为分配系数),且室温条件下KD=85。
①分液时,使用的玻璃仪器有___________ 。
②该条件下反应 的平衡常数K=
的平衡常数K=___________ (保留三位有效数字)。
(2)某废碘液(含有Ⅰ2、 、
、 和淀粉)回收Ⅰ2的实验过程如下:
和淀粉)回收Ⅰ2的实验过程如下:
i.还原:取100mL废碘液,加入Na2S2O3将Ⅰ2、Ⅰ3还原为 ;
;
ii.浓缩:加热浓缩到原体积的50%;
iii.氧化:向浓缩液中加入稍过量的研细的FeCl3固体,充分搅拌,静置;
iv.过滤:得粗碘和碘水;
v.升华:粗碘中含有FeCl3等杂质,用升华法提纯得精碘。
①还原时判断Ⅰ2、 全部还原为
全部还原为 的实验现象是
的实验现象是___________ 。
②还原和浓缩的顺序不能交换,可能原因是___________ 。
③氧化时发生反应的离子方程式为___________ 。
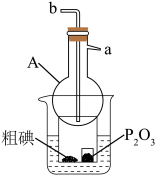
④升华法提纯粗碘的装置如图所示(加热装置已省略)。使用仪器A进行回流水冷却,仪器A的名称是___________ ,进水口为___________ (填“a”或“b”),小烧杯中放置P2O5的作用是___________ 。
⑤碘水可用乙醚一四氯化碳的混合溶剂萃取进一步回收碘,萃取剂总体积为10mL时四氯化碳与乙醚不同比例下的实验对比结果如下表:
由此得出的结论是___________ 。
 。某同学设计如下实验测定该反应的平衡常数,并从某废碘液(Ⅰ2、
。某同学设计如下实验测定该反应的平衡常数,并从某废碘液(Ⅰ2、 、
、 和淀粉)回收Ⅰ2。回答下列问题:
和淀粉)回收Ⅰ2。回答下列问题:(1)反应
 平衡常数测定,步骤如下:
平衡常数测定,步骤如下:I.将一定质量的单质Ⅰ2完全溶于
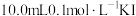 溶液中(假定溶液体积不变),加入10mLCCl4,振荡,静置后分液;
溶液中(假定溶液体积不变),加入10mLCCl4,振荡,静置后分液;Ⅱ.实验测得上层溶液中
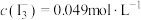 ;
;Ⅲ.滴定下层溶液至终点时,消耗
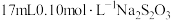 溶液
溶液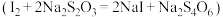 。
。已知:
 、
、 不溶于CCl4;一定温度下碘单质在四氯化碳和水混合液体中,碘单质的浓度比值即
不溶于CCl4;一定温度下碘单质在四氯化碳和水混合液体中,碘单质的浓度比值即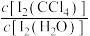 是一个常数(用KD表示,称为分配系数),且室温条件下KD=85。
是一个常数(用KD表示,称为分配系数),且室温条件下KD=85。①分液时,使用的玻璃仪器有
②该条件下反应
 的平衡常数K=
的平衡常数K=(2)某废碘液(含有Ⅰ2、
 、
、 和淀粉)回收Ⅰ2的实验过程如下:
和淀粉)回收Ⅰ2的实验过程如下:i.还原:取100mL废碘液,加入Na2S2O3将Ⅰ2、Ⅰ3还原为
 ;
;ii.浓缩:加热浓缩到原体积的50%;
iii.氧化:向浓缩液中加入稍过量的研细的FeCl3固体,充分搅拌,静置;
iv.过滤:得粗碘和碘水;
v.升华:粗碘中含有FeCl3等杂质,用升华法提纯得精碘。
①还原时判断Ⅰ2、
 全部还原为
全部还原为 的实验现象是
的实验现象是②还原和浓缩的顺序不能交换,可能原因是
③氧化时发生反应的离子方程式为
④升华法提纯粗碘的装置如图所示(加热装置已省略)。使用仪器A进行回流水冷却,仪器A的名称是

⑤碘水可用乙醚一四氯化碳的混合溶剂萃取进一步回收碘,萃取剂总体积为10mL时四氯化碳与乙醚不同比例下的实验对比结果如下表:
| 比例 | 1:0 | 1:1 | 1:2 | 1:3 | 1:4 | 1:5 |
| 萃取后碘水 | 红 | 浅黄红 | 浅黄 | 浅黄红 | 较浅黄色 | 接近无色 |
您最近一年使用:0次
名校
解题方法
5 . 实验室模拟“镁法工业烟气脱硫”并制备 ,其实验过程可表示为
,其实验过程可表示为
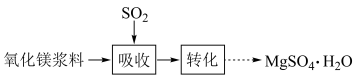
(1)向氧化镁浆料中匀速通入 气体以生成
气体以生成 ,常温下,能提高氧化镁浆料转化效率的措施有
,常温下,能提高氧化镁浆料转化效率的措施有___________ (写出一种即可)
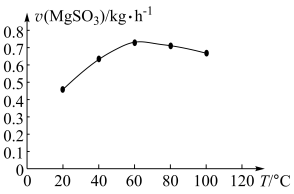
(2)在“转化”步骤中,其他条件相同时,以负载钴的分子篮为催化剂,浆料中 被
被 氧化的速率随温度的变化如图所示。当温度高于
氧化的速率随温度的变化如图所示。当温度高于 ,升温,浆料中
,升温,浆料中 的氧化速率减慢,其主要原因是
的氧化速率减慢,其主要原因是___________ 。
(3)在如图所示的实验装置中制取 :用滴液漏斗向盛有
:用滴液漏斗向盛有 浆料的三颈烧瓶中缓慢滴加硫酸溶液,得到含有少量
浆料的三颈烧瓶中缓慢滴加硫酸溶液,得到含有少量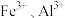 的
的 溶液(此时
溶液(此时 的浓度为
的浓度为 ),再分批加入少量试剂
),再分批加入少量试剂 ,搅拌,调节溶液的
,搅拌,调节溶液的 至合理范围,过滤,将滤液蒸发浓缩、降温至室温结晶,所得晶体在
至合理范围,过滤,将滤液蒸发浓缩、降温至室温结晶,所得晶体在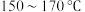 干燥即可得到
干燥即可得到 。
。
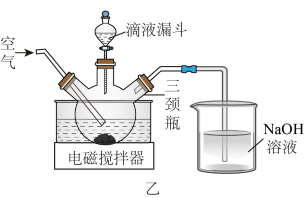
注:有关金属离子沉淀完全的 见下表,回答下列问题:
见下表,回答下列问题:
①试剂X可以是:___________ (填化学式,1种即可)
② 的合理范围为
的合理范围为___________ 。
③用化学用语及必要的文字说明解释用试剂X除去杂质的原理:___________
(4)上述流程中的重要一步是生成 的反应:
的反应: ,则该反应的平衡常数
,则该反应的平衡常数 与
与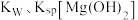 、
、 的代数关系式为
的代数关系式为
___________ 。
 ,其实验过程可表示为
,其实验过程可表示为
(1)向氧化镁浆料中匀速通入
 气体以生成
气体以生成 ,常温下,能提高氧化镁浆料转化效率的措施有
,常温下,能提高氧化镁浆料转化效率的措施有(2)在“转化”步骤中,其他条件相同时,以负载钴的分子篮为催化剂,浆料中
 被
被 氧化的速率随温度的变化如图所示。当温度高于
氧化的速率随温度的变化如图所示。当温度高于 ,升温,浆料中
,升温,浆料中 的氧化速率减慢,其主要原因是
的氧化速率减慢,其主要原因是
(3)在如图所示的实验装置中制取
 :用滴液漏斗向盛有
:用滴液漏斗向盛有 浆料的三颈烧瓶中缓慢滴加硫酸溶液,得到含有少量
浆料的三颈烧瓶中缓慢滴加硫酸溶液,得到含有少量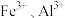 的
的 溶液(此时
溶液(此时 的浓度为
的浓度为 ),再分批加入少量试剂
),再分批加入少量试剂 ,搅拌,调节溶液的
,搅拌,调节溶液的 至合理范围,过滤,将滤液蒸发浓缩、降温至室温结晶,所得晶体在
至合理范围,过滤,将滤液蒸发浓缩、降温至室温结晶,所得晶体在 干燥即可得到
干燥即可得到 。
。
注:有关金属离子沉淀完全的
 见下表,回答下列问题:
见下表,回答下列问题:| 金属离子 |  |  |  |
沉淀完全 的 的 | 3.2 | 4.7 | 11.0 |
②
 的合理范围为
的合理范围为③用化学用语及必要的文字说明解释用试剂X除去杂质的原理:
(4)上述流程中的重要一步是生成
 的反应:
的反应: ,则该反应的平衡常数
,则该反应的平衡常数 与
与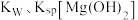 、
、 的代数关系式为
的代数关系式为
您最近一年使用:0次
6 . 钴属于稀缺性金属。利用“微波辅助低共熔溶剂”浸取某废旧锂离子电池中钴酸锂粗品制备 产品,实现资源的循环利用。主要工艺流程如下:
产品,实现资源的循环利用。主要工艺流程如下: 是一种铵盐;
是一种铵盐;
② 在溶液中常以
在溶液中常以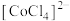 (蓝色)和
(蓝色)和 (粉红色)形式存在;
(粉红色)形式存在;
③ 时,
时, 。
。
回答下列问题:
(1) 中
中 的化合价为
的化合价为_______ 。
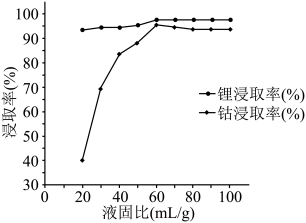
(2)下图为“微波共熔”中氯化胆碱-草酸和 粗品以不同的液固比在
粗品以不同的液固比在 下微波处理
下微波处理 后锂和钴的浸取率图,则最佳液固比为
后锂和钴的浸取率图,则最佳液固比为_______  。
。_______ 。
(4) 时,“沉钴”反应完成后,溶液
时,“沉钴”反应完成后,溶液 ,此时
,此时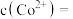
_______  。
。
(5)“滤饼2”在高温烧结前需要洗涤、干燥,检验“滤饼2”是否洗涤干净的操作及现象是_______ 。
(6)“高温烧结”中需要通入空气,其作用是_______ 。
(7)锂离子电池正极材料 在多次充放电后由于可循环锂的损失,结构发生改变生成
在多次充放电后由于可循环锂的损失,结构发生改变生成 ,导致电化学性能下降。
,导致电化学性能下降。
① 晶体(常式尖晶石型)的晶胞示意图如图所示,则顶点上的离子为
晶体(常式尖晶石型)的晶胞示意图如图所示,则顶点上的离子为_______ (用离子符号表示)。
②使用 和
和 溶液可以实现
溶液可以实现 的修复,则修复过程中的化学反应方程式为
的修复,则修复过程中的化学反应方程式为_______ 。
 产品,实现资源的循环利用。主要工艺流程如下:
产品,实现资源的循环利用。主要工艺流程如下:
 是一种铵盐;
是一种铵盐;②
 在溶液中常以
在溶液中常以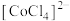 (蓝色)和
(蓝色)和 (粉红色)形式存在;
(粉红色)形式存在;③
 时,
时, 。
。回答下列问题:
(1)
 中
中 的化合价为
的化合价为(2)下图为“微波共熔”中氯化胆碱-草酸和
 粗品以不同的液固比在
粗品以不同的液固比在 下微波处理
下微波处理 后锂和钴的浸取率图,则最佳液固比为
后锂和钴的浸取率图,则最佳液固比为 。
。
(4)
 时,“沉钴”反应完成后,溶液
时,“沉钴”反应完成后,溶液 ,此时
,此时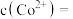
 。
。(5)“滤饼2”在高温烧结前需要洗涤、干燥,检验“滤饼2”是否洗涤干净的操作及现象是
(6)“高温烧结”中需要通入空气,其作用是
(7)锂离子电池正极材料
 在多次充放电后由于可循环锂的损失,结构发生改变生成
在多次充放电后由于可循环锂的损失,结构发生改变生成 ,导致电化学性能下降。
,导致电化学性能下降。①
 晶体(常式尖晶石型)的晶胞示意图如图所示,则顶点上的离子为
晶体(常式尖晶石型)的晶胞示意图如图所示,则顶点上的离子为②使用
 和
和 溶液可以实现
溶液可以实现 的修复,则修复过程中的化学反应方程式为
的修复,则修复过程中的化学反应方程式为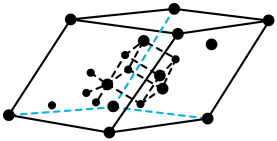
您最近一年使用:0次
2024-01-22更新
|
1110次组卷
|
5卷引用:辽宁省沈阳市东北育才学校高中部2023-2024学年高三下学期第六次模拟考试化学试题
辽宁省沈阳市东北育才学校高中部2023-2024学年高三下学期第六次模拟考试化学试题2024年1月贵州普通高等学校招生考试适应性测试化学试题(已下线)2024年1月“九省联考”贵州卷真题完全解读与考后提升(已下线)T16-工业流程题(已下线)专题08 工艺流程综合题-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)
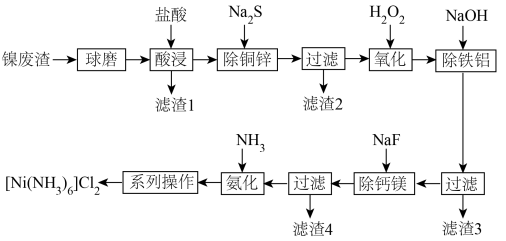
7 . [Ni(NH3)6]Cl2在有机合成中有广泛应用。以镍废渣(主要含Ni、CuO、FeO、ZnO、Al2O3、MgO、CaCO3和SiO2)为原料制备[Ni(NH3)6]Cl2的工艺流程如下。回答下列问题: 都不能氧化
都不能氧化 。
。
②25℃时,几种氢氧化物和氟化物的 如表所示:
如表所示:
③25℃时,几种金属硫化物的 如表所示:
如表所示:
(1)“酸浸”之前“球磨”,目的是___________ ,“酸浸”时适当加热可以提高反应速率,但是温度过高,速率反而减小,其原因是___________ 。
(2)“除铜锌”时,测得溶液中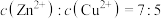 ,最先沉淀的离子是
,最先沉淀的离子是___________ (填离子符号,下同),若溶液中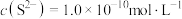 ,此时溶液中被除干净的离子是
,此时溶液中被除干净的离子是___________ (当溶液中某离子的浓度小于或等于 时,认为该离子已被除干净)。
时,认为该离子已被除干净)。
(3)Na2S溶液呈碱性的原因是___________ (用离子方程式表示)。
(4)“除铁铝”中, 时,
时,
___________  。
。
(5)已知常温下, ,则NaF的水解常数
,则NaF的水解常数
___________ ;“除钙镁”时,不能选用玻璃仪器,其原因是___________ 。
 都不能氧化
都不能氧化 。
。②25℃时,几种氢氧化物和氟化物的
 如表所示:
如表所示:| 物质 | Fe(OH)3 | Al(OH)3 | Ni(OH)2 | CaF2 | MgF2 |
 | 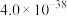 | 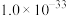 | 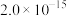 |  |  |
 如表所示:
如表所示:| 金属硫化物 | FeS | NiS | CuS | ZnS |
 | 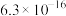 |  |  | 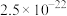 |
(1)“酸浸”之前“球磨”,目的是
(2)“除铜锌”时,测得溶液中
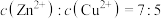 ,最先沉淀的离子是
,最先沉淀的离子是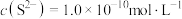 ,此时溶液中被除干净的离子是
,此时溶液中被除干净的离子是 时,认为该离子已被除干净)。
时,认为该离子已被除干净)。(3)Na2S溶液呈碱性的原因是
(4)“除铁铝”中,
 时,
时,
 。
。(5)已知常温下,
 ,则NaF的水解常数
,则NaF的水解常数
您最近一年使用:0次
2024-01-19更新
|
123次组卷
|
2卷引用:江西省部分学校2023-2024学年高三上学期12月月考化学试题
名校
8 . 纳米银粒是一种杀菌剂,对沙眼衣原体等数十种致病微生物都有强烈的抑制和杀灭作用,而且不会产生耐药性。可通过肼(N2H4)还原银氨溶液制备纳米颗粒。具体步骤如下:
Ⅰ.在洁净的试管中加入2%AgNO3溶液10mL,逐滴加入2%稀氨水,边滴边振荡至沉淀恰好完全溶解。
Ⅱ.取10mLN2H4溶液于大烧杯中并加入5g分散剂混合均匀,加热至55~60℃。
Ⅲ.将Ⅰ中所得溶液滴加到Ⅱ中所得的分散系中,反应15min。
Ⅳ.冷却、分离、洗涤、干燥得纳米银粉。
已知:AgOH是白色难溶于水的物质,常温下极不稳定,分解生成棕色微溶于水的Ag2O。
回答下列问题:
(1)N2H4是一种常用还原剂,写出N2H4的电子式:___________ 。
(2)步骤Ⅲ发生反应的离子方程式为___________ ;验证纳米银颗粒生成的方法是___________ 。
(3)下列有关说法错误的是___________(填字母)。
(4)步骤I使用的AgNO3溶液需用HNO3酸化,其主要目的是___________ 。
(5)若用AgNO3溶液与维生素C以及明胶在一定条件下也可制得纳米银颗粒。
①该体系中维生素C的作用为___________ 。
②已知明胶可与溶液中Ag+形成如下配合物,[Ag(明胶)]+得电子后,明胶继续吸附在银核表面。
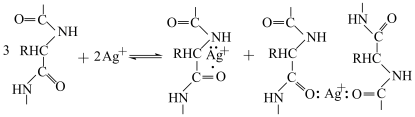
明胶在该体系中充当___________ 。
Ⅰ.在洁净的试管中加入2%AgNO3溶液10mL,逐滴加入2%稀氨水,边滴边振荡至沉淀恰好完全溶解。
Ⅱ.取10mLN2H4溶液于大烧杯中并加入5g分散剂混合均匀,加热至55~60℃。
Ⅲ.将Ⅰ中所得溶液滴加到Ⅱ中所得的分散系中,反应15min。
Ⅳ.冷却、分离、洗涤、干燥得纳米银粉。
已知:AgOH是白色难溶于水的物质,常温下极不稳定,分解生成棕色微溶于水的Ag2O。
回答下列问题:
(1)N2H4是一种常用还原剂,写出N2H4的电子式:
(2)步骤Ⅲ发生反应的离子方程式为
(3)下列有关说法错误的是___________(填字母)。
| A.步骤Ⅰ,银氨溶液也可用AgCl与氨水反应制得 |
| B.步骤Ⅱ,可采用水浴加热 |
| C.步骤Ⅲ,为了加快反应速度,可以一次性加入银氨溶液 |
| D.步骤Ⅳ,洗涤时可先水洗,再用乙醇洗涤 |
(4)步骤I使用的AgNO3溶液需用HNO3酸化,其主要目的是
(5)若用AgNO3溶液与维生素C以及明胶在一定条件下也可制得纳米银颗粒。
①该体系中维生素C的作用为
②已知明胶可与溶液中Ag+形成如下配合物,[Ag(明胶)]+得电子后,明胶继续吸附在银核表面。

明胶在该体系中充当
您最近一年使用:0次
解题方法
9 .  是一种重要的有机化工原料,是一种金黄色液体,沸点为138℃。学习小组在实验室利用下述装置制备
是一种重要的有机化工原料,是一种金黄色液体,沸点为138℃。学习小组在实验室利用下述装置制备 并测定其纯度(加热和夹持装置略)。
并测定其纯度(加热和夹持装置略)。

已知:①单质硫沸点为445℃;
② 能被
能被 氧化为
氧化为 ,
, (是一种暗红色液体)沸点为59℃;
(是一种暗红色液体)沸点为59℃;
③ 和
和 均易水解,
均易水解, 水解生成S、
水解生成S、 和HCl,
和HCl, 水解生成S和两种强酸。
水解生成S和两种强酸。
回答下列问题:
(1)组装仪器,装置合理的连接顺序是a→___________ (按气流顺序填各接口编号)。仪器m的作用为___________ 。
(2)检查装置气密性后开始实验:①打开 ,通
,通 一段时间;②关闭
一段时间;②关闭 ,加热装置B,控制温度为140℃;③加热A处蒸馏烧瓶,当观察到F处U形管内出现大量金黄色液体,停止加热A;④打开
,加热装置B,控制温度为140℃;③加热A处蒸馏烧瓶,当观察到F处U形管内出现大量金黄色液体,停止加热A;④打开 ,继续通一段时间
,继续通一段时间 。
。
加热装置B采用的加热方式为___________ ,当B处三颈烧瓶内充满黄绿色气体时,停止加热B,反应仍可以继续进行,可能的原因是___________ ,停止加热A后继续通一段时间 的目的是
的目的是___________ 。
(3)学习小组若长时间未观察到F处有金黄色液体生成,可以采取的措施为___________ ;最终所得粗产品需经过___________ (填操作名称)进一步提纯。
(4)测定粗产品纯度:称量mg产品,加稀盐酸振荡保证反应充分,通水蒸气将 和HCl全部蒸出后,配成100mL溶液,取25mL于锥形瓶中,用
和HCl全部蒸出后,配成100mL溶液,取25mL于锥形瓶中,用 溶液滴定至终点,消耗VmLNaOH溶液。则样品中
溶液滴定至终点,消耗VmLNaOH溶液。则样品中 纯度的表达式为
纯度的表达式为___________ 。
 是一种重要的有机化工原料,是一种金黄色液体,沸点为138℃。学习小组在实验室利用下述装置制备
是一种重要的有机化工原料,是一种金黄色液体,沸点为138℃。学习小组在实验室利用下述装置制备 并测定其纯度(加热和夹持装置略)。
并测定其纯度(加热和夹持装置略)。
已知:①单质硫沸点为445℃;
②
 能被
能被 氧化为
氧化为 ,
, (是一种暗红色液体)沸点为59℃;
(是一种暗红色液体)沸点为59℃;③
 和
和 均易水解,
均易水解, 水解生成S、
水解生成S、 和HCl,
和HCl, 水解生成S和两种强酸。
水解生成S和两种强酸。回答下列问题:
(1)组装仪器,装置合理的连接顺序是a→
(2)检查装置气密性后开始实验:①打开
 ,通
,通 一段时间;②关闭
一段时间;②关闭 ,加热装置B,控制温度为140℃;③加热A处蒸馏烧瓶,当观察到F处U形管内出现大量金黄色液体,停止加热A;④打开
,加热装置B,控制温度为140℃;③加热A处蒸馏烧瓶,当观察到F处U形管内出现大量金黄色液体,停止加热A;④打开 ,继续通一段时间
,继续通一段时间 。
。加热装置B采用的加热方式为
 的目的是
的目的是(3)学习小组若长时间未观察到F处有金黄色液体生成,可以采取的措施为
(4)测定粗产品纯度:称量mg产品,加稀盐酸振荡保证反应充分,通水蒸气将
 和HCl全部蒸出后,配成100mL溶液,取25mL于锥形瓶中,用
和HCl全部蒸出后,配成100mL溶液,取25mL于锥形瓶中,用 溶液滴定至终点,消耗VmLNaOH溶液。则样品中
溶液滴定至终点,消耗VmLNaOH溶液。则样品中 纯度的表达式为
纯度的表达式为
您最近一年使用:0次
名校
解题方法
10 . 工业上用软锰矿(主要成分是MnO2,含有Al2O3、SiO2等杂质),制备KMnO4的流程如下:
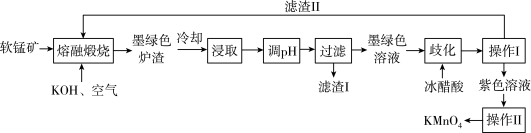
已知:①软锰矿中MnO2质量分数为52.2%
②K2MnO4固体和溶液均为墨绿色;酸性环境下能发生歧化反应。
(1)K2MnO4中Mn的化合价是___________ 。
(2)为了提高煅烧速率,可采取的措施有___________ 。(答一点即可)
(3)熔融煅烧时将空气改用KClO也能达到目的,写出KClO与软锰矿反应的主要化学方程式___________ 。
(4)向浸取后的溶液中通入CO2,调节其pH,经过滤得滤渣Ⅰ,滤渣Ⅰ的成分是___________ 。整个流程中可以循环利用的物质是___________ 。
(5)写出歧化一步发生的离子反应方程式:___________ 。
(6)不用盐酸代替冰醋酸的原因:___________ 。
(7)若不考虑物质循环与制备过程中的损失,1t软锰矿理论上可制得KMnO4固体___________ kg。

已知:①软锰矿中MnO2质量分数为52.2%
②K2MnO4固体和溶液均为墨绿色;酸性环境下能发生歧化反应。
(1)K2MnO4中Mn的化合价是
(2)为了提高煅烧速率,可采取的措施有
(3)熔融煅烧时将空气改用KClO也能达到目的,写出KClO与软锰矿反应的主要化学方程式
(4)向浸取后的溶液中通入CO2,调节其pH,经过滤得滤渣Ⅰ,滤渣Ⅰ的成分是
(5)写出歧化一步发生的离子反应方程式:
(6)不用盐酸代替冰醋酸的原因:
(7)若不考虑物质循环与制备过程中的损失,1t软锰矿理论上可制得KMnO4固体
您最近一年使用:0次



