1 . 我国拥有很长的海岸线,具有丰富的海洋资源。
Ⅰ.盐卤是海水晒盐后的富含镁盐的溶液,其中除含镁盐外,还含有其他盐类(如图甲所示)。
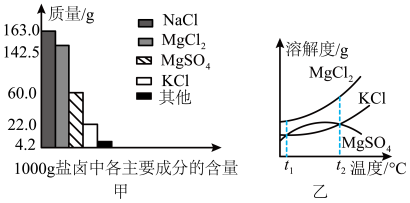
(1)根据图甲所示,写出盐卤中含量最多的盐为__________ 。(填化学式)
(2)图乙是盐卤中某些物质的溶解度曲线,将盐卤加热到 以上,根据溶解度曲线,首先析出的晶体应是
以上,根据溶解度曲线,首先析出的晶体应是__________ 。(填化学式)
(3)如图是常用于混合物的分离和提纯的装置:
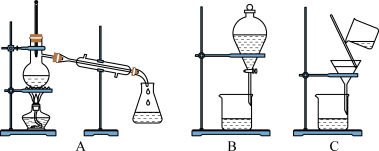
粗盐的提纯应选择图__________ (填字母,下同)装置,若实验中为了除去粗盐中的 、
、 、
、 等杂质离子加入试剂的顺序可以是
等杂质离子加入试剂的顺序可以是__________ 。
A.NaOH、 、
、 、HCl B.NaOH、
、HCl B.NaOH、 、
、 、HCl
、HCl
C. 、
、 、NaOH、HCl D.
、NaOH、HCl D. 、NaOH、
、NaOH、 、HCl
、HCl
Ⅱ.海带是一种含碘量很高的海藻,从中提取的碘广泛应用于医药、食品和化工。实验室里从海带中提取碘的流程如图。

(4)实验步骤①会用到下列仪器中的__________ (填字母)
a.酒精灯 b.蒸发皿 c.坩埚 d.泥三角
(5)设计实验证明第③步操作后滤液中 的存在,
的存在,______________________________ 。
(6)“提取碘”存在以下两种方案。
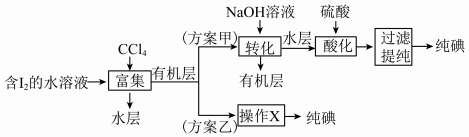
①方案乙中“操作X”的名称是__________ 。
②该流程可循环利用的物质是__________ 。
③采用方案乙得到纯碘的产率较低,原因是______________________________ 。
Ⅰ.盐卤是海水晒盐后的富含镁盐的溶液,其中除含镁盐外,还含有其他盐类(如图甲所示)。

(1)根据图甲所示,写出盐卤中含量最多的盐为
(2)图乙是盐卤中某些物质的溶解度曲线,将盐卤加热到
 以上,根据溶解度曲线,首先析出的晶体应是
以上,根据溶解度曲线,首先析出的晶体应是(3)如图是常用于混合物的分离和提纯的装置:

粗盐的提纯应选择图
 、
、 、
、 等杂质离子加入试剂的顺序可以是
等杂质离子加入试剂的顺序可以是A.NaOH、
 、
、 、HCl B.NaOH、
、HCl B.NaOH、 、
、 、HCl
、HClC.
 、
、 、NaOH、HCl D.
、NaOH、HCl D. 、NaOH、
、NaOH、 、HCl
、HClⅡ.海带是一种含碘量很高的海藻,从中提取的碘广泛应用于医药、食品和化工。实验室里从海带中提取碘的流程如图。

(4)实验步骤①会用到下列仪器中的
a.酒精灯 b.蒸发皿 c.坩埚 d.泥三角
(5)设计实验证明第③步操作后滤液中
 的存在,
的存在,(6)“提取碘”存在以下两种方案。

①方案乙中“操作X”的名称是
②该流程可循环利用的物质是
③采用方案乙得到纯碘的产率较低,原因是
您最近一年使用:0次
2023-12-27更新
|
170次组卷
|
2卷引用:河北省保定市1+3联考2023-2024学年高一上学期12月月考化学试题
2 . 海带中含有碘元素,从海带中提取碘的实验过程如下图所示。
(2)海带灰悬浊液含有 。步骤④的试剂选用
。步骤④的试剂选用 、稀硫酸,离子方程式是
、稀硫酸,离子方程式是_______ 。
(3)检验步骤④产生了 的方法是
的方法是_______ 。
(4)步骤⑤“提取”包含以下四个过程。 体积明显小于含
体积明显小于含 溶液,即可使
溶液,即可使 几乎完全地转移至
几乎完全地转移至 中,推测
中,推测 在
在_______ (填“ ”或“
”或“ ”)中的溶解度更大。
”)中的溶解度更大。
b. 与
与 浓溶液反应的离子方程式是
浓溶液反应的离子方程式是_______ 。
c.过程Ⅰ→过程Ⅲ的目的是_______ 。
d.过程Ⅳ的操作是_______ 。

| A.酒精灯 | B.漏斗 | C.坩埚 | D.泥三角 |
 。步骤④的试剂选用
。步骤④的试剂选用 、稀硫酸,离子方程式是
、稀硫酸,离子方程式是(3)检验步骤④产生了
 的方法是
的方法是(4)步骤⑤“提取”包含以下四个过程。
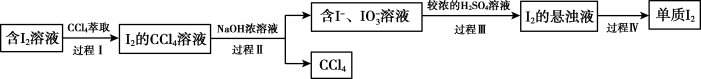
 体积明显小于含
体积明显小于含 溶液,即可使
溶液,即可使 几乎完全地转移至
几乎完全地转移至 中,推测
中,推测 在
在 ”或“
”或“ ”)中的溶解度更大。
”)中的溶解度更大。b.
 与
与 浓溶液反应的离子方程式是
浓溶液反应的离子方程式是c.过程Ⅰ→过程Ⅲ的目的是
d.过程Ⅳ的操作是
您最近一年使用:0次
3 . 我国拥有很长的海岸线,海洋资源的开发利用具有广阔前景。
(1)工业上海水淡化的方法有___________ 、___________ 。(填两种)
(2)空气吹出法是用于工业规模海水提溴的常用方法。其工艺流程如下:
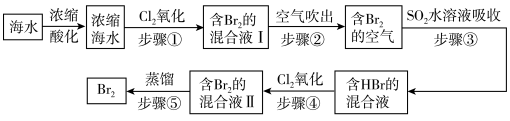
①步骤①中获得 的离子方程式为
的离子方程式为___________ 。
②根据上述反应可判断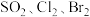 三种物质氧化性由强到弱的顺序是
三种物质氧化性由强到弱的顺序是___________ 。
③步骤③中若吸收剂为饱和 溶液(足量),则完全吸收
溶液(足量),则完全吸收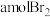 共有
共有___________ 个电子转移(用a和 的代数式表示)。
的代数式表示)。
(3)某化学兴趣小组按如下实验流程提取海带中的碘,请回答相关问题。
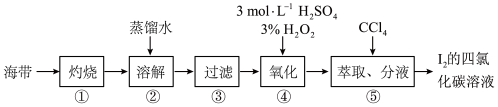
i.第①步是将海带放入_______ (填仪器名称)中,用酒精灯充分加热灰化。
ii.实验第④步骤后应检验碘单质的存在,具体方法是________ 。
iii.海带灰中还含有其他无机盐类(硫酸盐、硝酸盐、碳酸盐等),这些盐类是在流程图中的第_____ 步(填编号)与碘分离的。
iv.写出④中在酸性溶液下反应的离子方程式_______ 。
(1)工业上海水淡化的方法有
(2)空气吹出法是用于工业规模海水提溴的常用方法。其工艺流程如下:

①步骤①中获得
 的离子方程式为
的离子方程式为②根据上述反应可判断
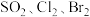 三种物质氧化性由强到弱的顺序是
三种物质氧化性由强到弱的顺序是③步骤③中若吸收剂为饱和
 溶液(足量),则完全吸收
溶液(足量),则完全吸收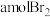 共有
共有 的代数式表示)。
的代数式表示)。(3)某化学兴趣小组按如下实验流程提取海带中的碘,请回答相关问题。

i.第①步是将海带放入
ii.实验第④步骤后应检验碘单质的存在,具体方法是
iii.海带灰中还含有其他无机盐类(硫酸盐、硝酸盐、碳酸盐等),这些盐类是在流程图中的第
iv.写出④中在酸性溶液下反应的离子方程式
您最近一年使用:0次
4 . 海洋植物海带中含有丰富的碘元素,某化学学习小组为了验证海带中含有碘,在实验室从海带中提取碘的流程如图:
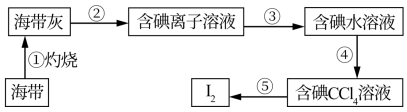
(1)第②步的操作名称是_____ ,用到的玻璃仪器有烧杯、玻璃棒和_____ ,检验溶液中含I-的方法是______ ,海带中碘元素主要以NaI或KI的形式存在,设计实验证明含碘离子溶液中K+的存在______ 。
(2)第③步:氧化。向含 的溶液中加入过量的H2O2和稀H2SO4。配平其离子反应方程式。
的溶液中加入过量的H2O2和稀H2SO4。配平其离子反应方程式。______
 I-+
I-+ H++
H++ H2O2=
H2O2= I2+
I2+ H2O
H2O
(3)第④步:萃取与分液。分液时若打开玻璃活塞后发现液体流不出,原因可能是_____ 。分液后上层液体中是否还有碘单质可以取少许溶液加入_____ 试剂来进行检验。
(4)第⑤步:通过蒸馏从碘的CCl4溶液中提取碘并回收CCl4。蒸馏操作前蒸馏烧瓶内需放几片碎瓷片的目的是______ ,温度计水银球的位置是_____ ,冷凝管水流方向是_____ 。

(1)第②步的操作名称是
(2)第③步:氧化。向含
 的溶液中加入过量的H2O2和稀H2SO4。配平其离子反应方程式。
的溶液中加入过量的H2O2和稀H2SO4。配平其离子反应方程式。 I-+
I-+ H++
H++ H2O2=
H2O2= I2+
I2+ H2O
H2O(3)第④步:萃取与分液。分液时若打开玻璃活塞后发现液体流不出,原因可能是
(4)第⑤步:通过蒸馏从碘的CCl4溶液中提取碘并回收CCl4。蒸馏操作前蒸馏烧瓶内需放几片碎瓷片的目的是
您最近一年使用:0次
2022-01-12更新
|
308次组卷
|
2卷引用:河北省唐山市2021-2022学年高一上学期期末考试化学试题
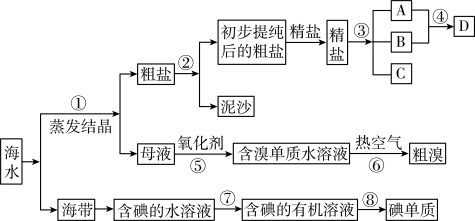
5 . 开发和利用海洋资源是当前科学研究的一项重要任务,如图是某化工厂对海洋资源综合利用的流程图:
请根据以上信息回答下列问题:
(1)写出流程中⑦所用的方法:_______ 。
(2)初步提纯后的粗盐中含有Ca2+、Mg2+、 等杂质,精制时一般步骤如下:
等杂质,精制时一般步骤如下:

加入的试剂①、②分别是:_______ 、_______ 。
(3)步骤③的条件是通直流电,其离子方程式为_______ 。D具有杀菌消毒的作用,在喷洒前需要在空气中晾置一会,这样做的原因是_______ 。
(4)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力(即得电子数)相当于多少克Cl2的氧化能力(氯元素均被还原至-1价)。则亚氯酸钠NaClO2的有效氯含量为_______ (保留两位小数)。
(5)若用来提取Br2,反应⑤所用的氧化剂的来源较合理的是_______ 。
A.从外地购买 B.在当地新建生产厂 C.从本厂生产烧碱处循环
(6)流程⑥将溴单质从水溶液中分离出来是基于溴单质具有_______ 性。对粗溴一般做如下处理:
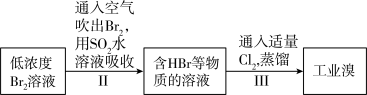
其中步骤Ⅱ、Ⅲ起到的作用是_______ 。
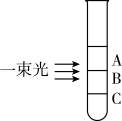
向盛有NaCl溶液的试管中滴加AgNO3溶液,静置后用一束光照射试管,发现试管的三个不同区域中只有一个区域具有明显的丁达尔效应。
(7)写出制备氯化银胶体的方程式:_______ 。
(8)具有明显的丁达尔效应的是区域_______ (填字母),该区域中分散质的粒径大小为_______ 。
(9)分离出C区域的分散质的方法是_______ 。

请根据以上信息回答下列问题:
(1)写出流程中⑦所用的方法:
(2)初步提纯后的粗盐中含有Ca2+、Mg2+、
 等杂质,精制时一般步骤如下:
等杂质,精制时一般步骤如下:
加入的试剂①、②分别是:
(3)步骤③的条件是通直流电,其离子方程式为
(4)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力(即得电子数)相当于多少克Cl2的氧化能力(氯元素均被还原至-1价)。则亚氯酸钠NaClO2的有效氯含量为
(5)若用来提取Br2,反应⑤所用的氧化剂的来源较合理的是
A.从外地购买 B.在当地新建生产厂 C.从本厂生产烧碱处循环
(6)流程⑥将溴单质从水溶液中分离出来是基于溴单质具有

其中步骤Ⅱ、Ⅲ起到的作用是
向盛有NaCl溶液的试管中滴加AgNO3溶液,静置后用一束光照射试管,发现试管的三个不同区域中只有一个区域具有明显的丁达尔效应。

(7)写出制备氯化银胶体的方程式:
(8)具有明显的丁达尔效应的是区域
(9)分离出C区域的分散质的方法是
您最近一年使用:0次
名校
解题方法
6 . 海带中含有丰富的碘,某校化学兴趣小组的同学们设计联合氯碱工业,以海带灰为原料提碘的工艺流程如图:
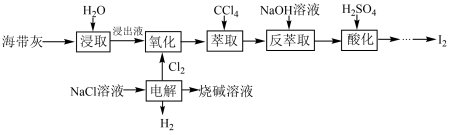
回答下列问题:
(1)“浸取”操作需要进行2~3次,将所得浸取液合并后进入下一流程,其目的是_____ ;请你设计实验证明“浸取”已经进行完全:_____ (需要用到的实验药品有:淀粉溶液、硫酸酸化的H2O2溶液,写出具体实验操作和现象)。
(2)“电解”反应的化学方程式为_____ 。
(3)“萃取”时,CCl4层的颜色为______ 色;“反萃取”时生成NaI和NaIO3,写出该反应的离子方程式:______ 。
(4)“酸化”后生成含I2的悬浊液,需要经过_____ (填操作名称)操作得到I2。
(5)该工艺流程实际操作中,碘的损失率为23.8%。若以2.5t海带灰为原料,最终制得I2物质的量为3×103mol,则该原料中含碘量为______ %
(6)该工艺流程中,除了H2O和NaCl以外,可以循环利用的物质有_____ (填化学式)。

回答下列问题:
(1)“浸取”操作需要进行2~3次,将所得浸取液合并后进入下一流程,其目的是
(2)“电解”反应的化学方程式为
(3)“萃取”时,CCl4层的颜色为
(4)“酸化”后生成含I2的悬浊液,需要经过
(5)该工艺流程实际操作中,碘的损失率为23.8%。若以2.5t海带灰为原料,最终制得I2物质的量为3×103mol,则该原料中含碘量为
(6)该工艺流程中,除了H2O和NaCl以外,可以循环利用的物质有
您最近一年使用:0次
名校
解题方法
7 . 海洋是巨大的资源宝库,可以制取多种物质。
I.海水提溴
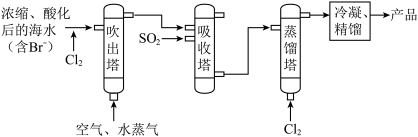
(1)吹出塔中采用气-液逆流的方式(液体从塔顶喷淋,气体从塔底进入),其目的是_______ 。
(2)请写出吸收塔中反应的离子方程式___________ 。
II.海带提碘(海带中碘元素以I-形式存在)
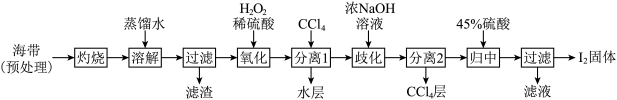
(3)“氧化”过程涉及到的离子方程式是_________ ,请设计一种检验所得溶液含I2的方法:___________ 。
(4)加入浓NaOH溶液充分振荡,发生的歧化反应中氧化剂和还原剂物质的量之比为________ ;向分离得到的含I-和 的水溶液中加入45%硫酸,发生归中反应的离子方程式为
的水溶液中加入45%硫酸,发生归中反应的离子方程式为________ 。
(5)图1是制取碘单质的原电池装置,图2是利用碘研制的新型的锌-碘溴液流电池(图中贮液器可储存电解质溶液,增加电池容量)。
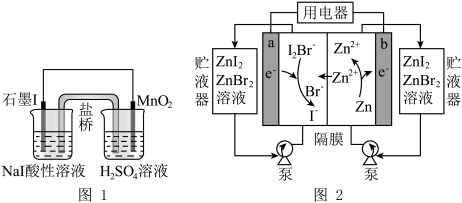
图1中,MnO2极发生的电极反应式为_______ ;图2中,放电时,a电极反应式为________ ,b电极质量减少6.5g时,a电极室增加________ mol离子(不考虑电极室与贮液器的溶液交换)。
I.海水提溴

(1)吹出塔中采用气-液逆流的方式(液体从塔顶喷淋,气体从塔底进入),其目的是
(2)请写出吸收塔中反应的离子方程式
II.海带提碘(海带中碘元素以I-形式存在)

(3)“氧化”过程涉及到的离子方程式是
(4)加入浓NaOH溶液充分振荡,发生的歧化反应中氧化剂和还原剂物质的量之比为
 的水溶液中加入45%硫酸,发生归中反应的离子方程式为
的水溶液中加入45%硫酸,发生归中反应的离子方程式为(5)图1是制取碘单质的原电池装置,图2是利用碘研制的新型的锌-碘溴液流电池(图中贮液器可储存电解质溶液,增加电池容量)。

图1中,MnO2极发生的电极反应式为
您最近一年使用:0次
名校
解题方法
8 . 碘( Godine)是人体必需的微量元素,是维持人体甲状腺正常功能所必需的元素, 人体缺碘时就会患甲状腺肿大,人们主要从饮水、粮食、蔬菜和周围环境中获取碘。多食海带,海鱼等含碘丰富的食品,对于防治甲状腺肿大很有效。某化学课外活动小组在实验室以海带为原料获得少量碘水,并以四氯化碳(沸点76.8℃)为溶剂将碘从碘水中提取出来,甲同学设计实验流程如图所示。请回答下列问题:
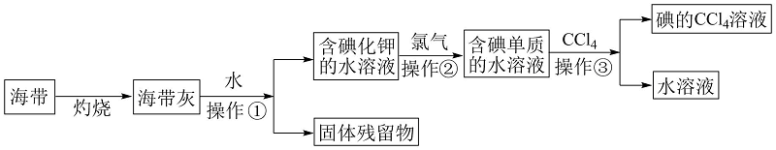
(1)上述流程中灼烧时必须用到最主要 的实验仪器有酒精灯、泥三角和___________ (填名称)。
(2)操作①的名称为___________ ;
(3)操作②中发生反应的离子方程式为______________________ ,乙同学对操作②进行了改进,用绿色氧化剂H2O2代替氯气并加适量稀盐酸,则所发生的离子反应方程式是____________________________________ 。
(4)操作③的实验名称为___________ ,最主要的 实验仪器的名称为___________ ;
(5)丙同学补充增加了一步操作:从碘的CCl4溶液中经过___________ 提取了碘单质并回收CCl4(填该操作名称)
(6)目前,我国推行全民食用的加碘盐是在食盐中加入___________ 这一物质(填写化学式)。

(1)上述流程中灼烧时
(2)操作①的名称为
(3)操作②中发生反应的离子方程式为
(4)操作③的实验名称为
(5)丙同学补充增加了一步操作:从碘的CCl4溶液中经过
(6)目前,我国推行全民食用的加碘盐是在食盐中加入
您最近一年使用:0次
名校
9 . 碘是动植物和人体必需的微量元素,I-的氧化和单质I2的分离是海带中碘元素分离的关键步骤。某学习小组在实验室对海带中碘元素进行分离和含量测定,并进行实验改进。
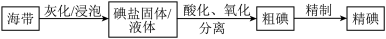
(1)海带中的碘元素以碘化物的形式存在,在酸化、氧化操作中,该小组首先选用氯水作为氧化剂,当氯水过量时碘单质被继续氧化成IO ,与该过程相关的离子方程式为
,与该过程相关的离子方程式为______ 、_____ 。
(2)针对以上出现的问题,该小组对实验进行改进,采用双氧水做氧化剂,逐滴滴加到过量I-溶液中,溶液颜色逐渐由黄色变为棕色。其反应原理为:①2I-+2H++H2O2=I2+2H2O②I-+I2=I (低浓度为黄色,高浓度为棕色)。过氧化氢过量时:③I2+5H2O2=HIO3(无色溶液)+4H2O。如果双氧水滴加过量,造成的影响为
(低浓度为黄色,高浓度为棕色)。过氧化氢过量时:③I2+5H2O2=HIO3(无色溶液)+4H2O。如果双氧水滴加过量,造成的影响为_____ 。而且该反应过程放出大量热,会对I2的提取造成的影响是_____ 。
(3)该小组针对问题又提出新的解决办法,采用溶液反加法,将I-溶液缓慢滴加到足量酸酸化的H2O2中,其反应如下:①2I-+2H++H2O2=I2+2H2O②I2+5H2O2=2HIO3+4H2O③4HI+2HIO3=3I2+6H2O。缓慢滴加过程中至反应结束,可观察到混合液颜色变化和现象为_____ 。
A.黄色逐渐加深,直到紫色沉淀析出
B.紫色逐渐加深,直到紫色沉淀析出
C.黄色逐渐变为棕色,直到紫色沉淀析出
D.黄色变无色,再变为黄色,搅拌后变为无色……,直到紫色沉淀析出
该实验改进措施最大的优点为_____ 。

(1)海带中的碘元素以碘化物的形式存在,在酸化、氧化操作中,该小组首先选用氯水作为氧化剂,当氯水过量时碘单质被继续氧化成IO
 ,与该过程相关的离子方程式为
,与该过程相关的离子方程式为(2)针对以上出现的问题,该小组对实验进行改进,采用双氧水做氧化剂,逐滴滴加到过量I-溶液中,溶液颜色逐渐由黄色变为棕色。其反应原理为:①2I-+2H++H2O2=I2+2H2O②I-+I2=I
 (低浓度为黄色,高浓度为棕色)。过氧化氢过量时:③I2+5H2O2=HIO3(无色溶液)+4H2O。如果双氧水滴加过量,造成的影响为
(低浓度为黄色,高浓度为棕色)。过氧化氢过量时:③I2+5H2O2=HIO3(无色溶液)+4H2O。如果双氧水滴加过量,造成的影响为(3)该小组针对问题又提出新的解决办法,采用溶液反加法,将I-溶液缓慢滴加到足量酸酸化的H2O2中,其反应如下:①2I-+2H++H2O2=I2+2H2O②I2+5H2O2=2HIO3+4H2O③4HI+2HIO3=3I2+6H2O。缓慢滴加过程中至反应结束,可观察到混合液颜色变化和现象为
A.黄色逐渐加深,直到紫色沉淀析出
B.紫色逐渐加深,直到紫色沉淀析出
C.黄色逐渐变为棕色,直到紫色沉淀析出
D.黄色变无色,再变为黄色,搅拌后变为无色……,直到紫色沉淀析出
该实验改进措施最大的优点为
您最近一年使用:0次
10 . 根据流程回答问题
Ⅰ.从海带(含KI)中提取碘,某研究性学习小组设计了如图流程:
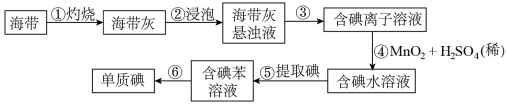
(1)步骤①中灼烧海带是在_______ (填仪器名称)中进行
(2)步骤③、⑤、⑥的实验操作分别为_______
(3)反应④的离子方程式为_______
(4)步骤⑤向碘水中加入苯,振荡静置后的现象为_______
Ⅱ.工业上用铝土矿(含有 杂质的
杂质的 ,
, 的含量a %)为原料冶炼铝的工艺流程如(所加试剂均过量):
的含量a %)为原料冶炼铝的工艺流程如(所加试剂均过量):
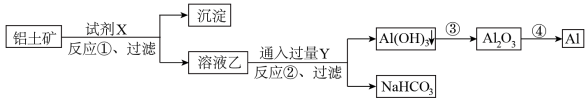
(5)试剂X是_______ (填化学式),上述反应过程中耗能最多的是_______ (填序号)
(6)反应②的离子方程式_______
(7)工业上生产1t Al,在生产过程中Al的损失率为b %,理论上需投入铝土矿_______ t(列出计算表达式即可)
Ⅰ.从海带(含KI)中提取碘,某研究性学习小组设计了如图流程:

(1)步骤①中灼烧海带是在
(2)步骤③、⑤、⑥的实验操作分别为
(3)反应④的离子方程式为
(4)步骤⑤向碘水中加入苯,振荡静置后的现象为
Ⅱ.工业上用铝土矿(含有
 杂质的
杂质的 ,
, 的含量a %)为原料冶炼铝的工艺流程如(所加试剂均过量):
的含量a %)为原料冶炼铝的工艺流程如(所加试剂均过量):
(5)试剂X是
(6)反应②的离子方程式
(7)工业上生产1t Al,在生产过程中Al的损失率为b %,理论上需投入铝土矿
您最近一年使用:0次



