1 . 碘是人体生长发育不可缺少的微量元素,海带中富含碘元素,从海带中提取碘的工艺流程如下。回答下列问题:

(1)步骤①中发生反应的离子方程式为_______ ,当生成0.3molI2时,转移电子的物质的量为_______ mol。
(2)向含有I2的水溶液中加入CCl4振荡静置后的实验现象为_______ 。
(3)步骤③中发生反应的化学方程式为_______ 。
(4)步骤⑤的实验操作名称为_______ 。
(5)步骤③④是利用化学转化法将富集在四氯化碳中的碘单质重新富集在水中,该方法称为_______ 法。

(1)步骤①中发生反应的离子方程式为
(2)向含有I2的水溶液中加入CCl4振荡静置后的实验现象为
(3)步骤③中发生反应的化学方程式为
(4)步骤⑤的实验操作名称为
(5)步骤③④是利用化学转化法将富集在四氯化碳中的碘单质重新富集在水中,该方法称为
您最近一年使用:0次
2 . 资源丰富的海水是工业生产中的重要原料。请按要求回答下列问题。
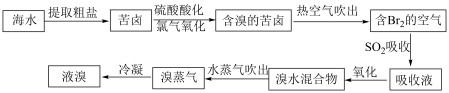
(1)海水中溴含量约为65 ,从海水中提取溴的工艺流程如下:
,从海水中提取溴的工艺流程如下:

①步骤ⅰ反应的化学方程式为_______ 。
②步骤ⅱ目的是_______ ;其中“通入热空气吹出 ”,利用了溴的性质是
”,利用了溴的性质是_______ 。步骤ⅱ 参与反应的离子方程式为
参与反应的离子方程式为_______ 。
③步骤ⅲ氧化 的粒子为
的粒子为_______ ;
④步骤ⅳ分离提纯的方法是_______ ;其依据是_______ 。
(2)海带中碘含量丰富。从海带中提取碘的实验如下装置中,不能达到目的的有A_______ (填选项字母),解释A不能达到目的的原因:_______ 。
(3)海水电池在海洋能源领域备受关注。
①图1为一种锂-海水电池构造示意图。N极反应式为_______ 。
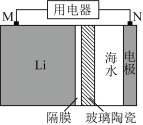
②欲用图2电解装置制得漂白液(NaClO为有效成分)可将其a极与锂-海水电池图1的_______ (填“M”或“N”)极连接;理论上该电解总反应的生成物中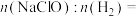
_______ 。
(1)海水中溴含量约为65
 ,从海水中提取溴的工艺流程如下:
,从海水中提取溴的工艺流程如下:
①步骤ⅰ反应的化学方程式为
②步骤ⅱ目的是
 ”,利用了溴的性质是
”,利用了溴的性质是 参与反应的离子方程式为
参与反应的离子方程式为③步骤ⅲ氧化
 的粒子为
的粒子为④步骤ⅳ分离提纯的方法是
(2)海带中碘含量丰富。从海带中提取碘的实验如下装置中,不能达到目的的有A
| A | B | C |
 | 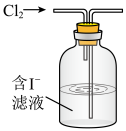 | 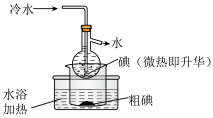 |
| 灼烧碎海带 | 获得碘水 | 提纯碘 |
(3)海水电池在海洋能源领域备受关注。
①图1为一种锂-海水电池构造示意图。N极反应式为

②欲用图2电解装置制得漂白液(NaClO为有效成分)可将其a极与锂-海水电池图1的
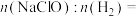

您最近一年使用:0次
3 . Ⅰ.海水中的氯化钠被提纯和精制后,可通过电解饱和食盐水制取氯气、氢气和氢氧化钠。实验室电解饱和食盐水所用装置如下图所示:___________ 。
A.试管 B.离心试管 C.U形管 D.Y形试管
②在a的两端滴加酚酞试液,通电后左边电极周围出现红色,写出该电极的电极反应式说明溶液变红的原因___________ 。
(2)通电后试管b中淀粉KI溶液由无色变为蓝色,结合离子方程式说明变化原因。___________ 。
(3)c处出来的气体可以点燃,其燃烧的现象是___________ 。
Ⅱ.地球上99%的溴元素分布在海洋中。空气吹出法工艺是目前“海水提溴”的主要方法之一,工艺流程如下图所示:
(5)上述流程中热空气吹出已经得到了粗溴,为什么还要添加“SO2吸收、氧化、水蒸气吹出”三个步骤,其目的是___________ 。
Ⅲ.海洋中的海带等海藻类植物具有富集碘的能力,工业上获取碘的主要流程如下图所示:
Ⅳ.硫元素和氮元素也存在于海洋中。
(7) 是海洋中硫元素的主要存在形式之一,其存在会干扰海水中Cl-的检验。检验海水中Cl-的方法是
是海洋中硫元素的主要存在形式之一,其存在会干扰海水中Cl-的检验。检验海水中Cl-的方法是___________ 。
(8)氮元素在海洋中的循环,是整个海洋生态系统的基础和关键。海洋中无机氮的循环起始于氮的固定,过程可用下图表示。下列关于海洋氮循环的说法正确的是___________。
(9)N、O、S三种元素第一电离能由大到小的顺序为___________ 。
A.O > S > N B.S > N > O C.N > O > S D.O > N > S
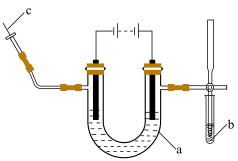
A.试管 B.离心试管 C.U形管 D.Y形试管
②在a的两端滴加酚酞试液,通电后左边电极周围出现红色,写出该电极的电极反应式说明溶液变红的原因
(2)通电后试管b中淀粉KI溶液由无色变为蓝色,结合离子方程式说明变化原因。
(3)c处出来的气体可以点燃,其燃烧的现象是
Ⅱ.地球上99%的溴元素分布在海洋中。空气吹出法工艺是目前“海水提溴”的主要方法之一,工艺流程如下图所示:
| A.溴离子的还原性 | B.溴单质的还原性 | C.溴的沸点高 | D.HBr极易溶于水 |
(5)上述流程中热空气吹出已经得到了粗溴,为什么还要添加“SO2吸收、氧化、水蒸气吹出”三个步骤,其目的是
Ⅲ.海洋中的海带等海藻类植物具有富集碘的能力,工业上获取碘的主要流程如下图所示:
| A.酒精 | B.裂化汽油 | C.四氯化碳 | D.乙酸 |
Ⅳ.硫元素和氮元素也存在于海洋中。
(7)
 是海洋中硫元素的主要存在形式之一,其存在会干扰海水中Cl-的检验。检验海水中Cl-的方法是
是海洋中硫元素的主要存在形式之一,其存在会干扰海水中Cl-的检验。检验海水中Cl-的方法是(8)氮元素在海洋中的循环,是整个海洋生态系统的基础和关键。海洋中无机氮的循环起始于氮的固定,过程可用下图表示。下列关于海洋氮循环的说法正确的是___________。
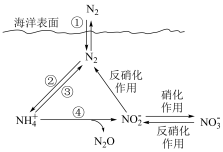
| A.海洋中的氮循环起始于氮的氧化 | B.海洋中的氮循环属于固氮作用的是③ |
| C.海洋中的硝化作用可能有氧气的参与 | D.NH4NO3中只含离子键 |
(9)N、O、S三种元素第一电离能由大到小的顺序为
A.O > S > N B.S > N > O C.N > O > S D.O > N > S
您最近一年使用:0次
2024-03-16更新
|
153次组卷
|
2卷引用:上海市宝山区2024届高三一模化学试题
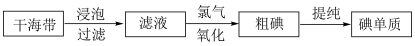
4 . 海带具有从海水中富集碘的能力,下面是从海带中提取碘单质的流程:
海带 海带灰
海带灰 悬浊液
悬浊液 含I-的水溶液
含I-的水溶液 含I2的溶液
含I2的溶液 含I2的CCl4溶液
含I2的CCl4溶液 晶体碘
晶体碘
(1)步骤c的操作方法是___________ ;除烧杯外,还需要使用的玻璃仪器是___________ 、___________ 。
(2)最后的蒸馏通常用水浴加热而不是用酒精灯火焰直接加热,其原因为___________ 。
(3)骤e的操作方法叫做___________ ,所用的主要实验仪器是___________ ,最初从该仪器流出的液体颜色为___________ 色。

海带
 海带灰
海带灰 悬浊液
悬浊液 含I-的水溶液
含I-的水溶液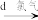 含I2的溶液
含I2的溶液 含I2的CCl4溶液
含I2的CCl4溶液 晶体碘
晶体碘(1)步骤c的操作方法是
(2)最后的蒸馏通常用水浴加热而不是用酒精灯火焰直接加热,其原因为
(3)骤e的操作方法叫做
您最近一年使用:0次
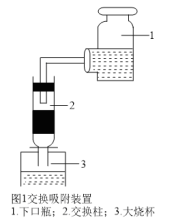
5 . 用离子交换法从海带中提取碘是一种较为先进的制碘工艺应用技术。
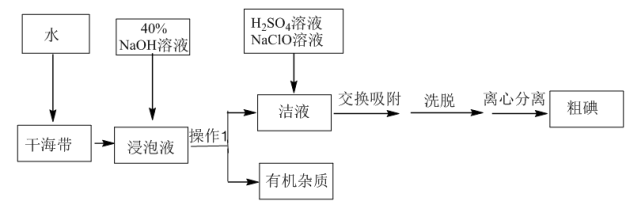
已知: 交换吸附原理:
交换吸附原理: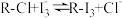 。试回答下列问题:
。试回答下列问题:
(1)操作Ⅰ的正确图示为_______。
(2)在清液中加入 和
和 溶液后,溶液最终变为棕红色,该步骤中
溶液后,溶液最终变为棕红色,该步骤中 的量要适中,请说明原因
的量要适中,请说明原因_______ 。
(3)其中交换吸附装置如图1所示,交换柱内装有氯型阴离子交换树脂( 表示),待溶液转化原理为:
表示),待溶液转化原理为: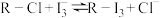 ,全部通过后,树脂颜色变为黑红色,再通过洗脱,离心分离后得到粗碘。已知洗脱分两步进行
,全部通过后,树脂颜色变为黑红色,再通过洗脱,离心分离后得到粗碘。已知洗脱分两步进行
第一步:取8~10%的 溶液
溶液 注入交换柱中。碱性洗脱原理为:
注入交换柱中。碱性洗脱原理为:
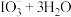 。往碱性洗脱液中滴加
。往碱性洗脱液中滴加 溶液,烧杯底部会析出一层泥状粗碘。
溶液,烧杯底部会析出一层泥状粗碘。
第二步:取10%的 溶液
溶液 注入上述交换柱中。氯化钠洗脱原理为:
注入上述交换柱中。氯化钠洗脱原理为: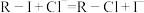 。再往氯化钠洗脱液中滴加
。再往氯化钠洗脱液中滴加 溶液使之酸化,再滴加
溶液使之酸化,再滴加 溶液,溶液由无色转变棕黑色浑浊。
溶液,溶液由无色转变棕黑色浑浊。
①根据交换吸附及洗脱过程可知强碱性阴离子交换树脂也可以对 进行交换吸附,那实验中将
进行交换吸附,那实验中将 转化成
转化成 的原因可能是
的原因可能是_______ 。
②往氯化钠洗脱液中滴加 溶液使之酸化,再滴加
溶液使之酸化,再滴加 溶液反应的离子方程式
溶液反应的离子方程式_______ 。
(4)置换碘量法是分析氧化性试剂的一种常用分析方法,基本过程如下:
a.取3只碘量瓶,用移液管分别量取一定体积的供试品(氧化性物质)溶液于碘量瓶(图2)中
b.加入稍过量的碘化钾溶液,盖上盖子,并加纯水液封,静置或微热一段时间
c.打开瓶塞,按图3方式用标准 溶液进行滴定,重复3次
溶液进行滴定,重复3次
d.另取3只碘量瓶,用移液管分别量取一定体积准确浓度的基准液 溶液于其中
溶液于其中
e.计算标准液的浓度
f.空白实验
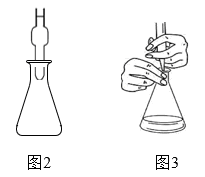
过程中涉及的反应过程如下:
供试品(氧化性物质)
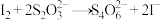

①上述操作合理的顺序是:_______ 。
 _______
_______ _______
_______ _______
_______ _______
_______ _______
_______ (部分步骤可以重复)
(部分步骤可以重复)
②碘量瓶加盖并加纯水液封的主要目的是_______ 。
③已知 易受空气和微生物作用而分解,若无上述操作中的d步骤及相关操作,则测定的供试品的含量会
易受空气和微生物作用而分解,若无上述操作中的d步骤及相关操作,则测定的供试品的含量会_______ 。(填“偏大”、“偏小”或“不变”)

已知:
 交换吸附原理:
交换吸附原理: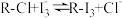 。试回答下列问题:
。试回答下列问题:(1)操作Ⅰ的正确图示为_______。
A.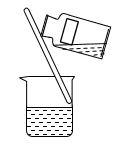 | B.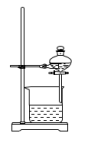 | C.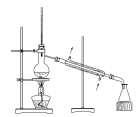 | D.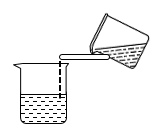 |
 和
和 溶液后,溶液最终变为棕红色,该步骤中
溶液后,溶液最终变为棕红色,该步骤中 的量要适中,请说明原因
的量要适中,请说明原因(3)其中交换吸附装置如图1所示,交换柱内装有氯型阴离子交换树脂(
 表示),待溶液转化原理为:
表示),待溶液转化原理为: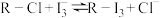 ,全部通过后,树脂颜色变为黑红色,再通过洗脱,离心分离后得到粗碘。已知洗脱分两步进行
,全部通过后,树脂颜色变为黑红色,再通过洗脱,离心分离后得到粗碘。已知洗脱分两步进行第一步:取8~10%的
 溶液
溶液 注入交换柱中。碱性洗脱原理为:
注入交换柱中。碱性洗脱原理为:
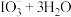 。往碱性洗脱液中滴加
。往碱性洗脱液中滴加 溶液,烧杯底部会析出一层泥状粗碘。
溶液,烧杯底部会析出一层泥状粗碘。第二步:取10%的
 溶液
溶液 注入上述交换柱中。氯化钠洗脱原理为:
注入上述交换柱中。氯化钠洗脱原理为: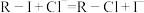 。再往氯化钠洗脱液中滴加
。再往氯化钠洗脱液中滴加 溶液使之酸化,再滴加
溶液使之酸化,再滴加 溶液,溶液由无色转变棕黑色浑浊。
溶液,溶液由无色转变棕黑色浑浊。
①根据交换吸附及洗脱过程可知强碱性阴离子交换树脂也可以对
 进行交换吸附,那实验中将
进行交换吸附,那实验中将 转化成
转化成 的原因可能是
的原因可能是②往氯化钠洗脱液中滴加
 溶液使之酸化,再滴加
溶液使之酸化,再滴加 溶液反应的离子方程式
溶液反应的离子方程式(4)置换碘量法是分析氧化性试剂的一种常用分析方法,基本过程如下:
a.取3只碘量瓶,用移液管分别量取一定体积的供试品(氧化性物质)溶液于碘量瓶(图2)中
b.加入稍过量的碘化钾溶液,盖上盖子,并加纯水液封,静置或微热一段时间
c.打开瓶塞,按图3方式用标准
 溶液进行滴定,重复3次
溶液进行滴定,重复3次d.另取3只碘量瓶,用移液管分别量取一定体积准确浓度的基准液
 溶液于其中
溶液于其中e.计算标准液的浓度
f.空白实验

过程中涉及的反应过程如下:
供试品(氧化性物质)

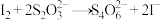

①上述操作合理的顺序是:
 _______
_______ _______
_______ _______
_______ _______
_______ _______
_______ (部分步骤可以重复)
(部分步骤可以重复)②碘量瓶加盖并加纯水液封的主要目的是
③已知
 易受空气和微生物作用而分解,若无上述操作中的d步骤及相关操作,则测定的供试品的含量会
易受空气和微生物作用而分解,若无上述操作中的d步骤及相关操作,则测定的供试品的含量会
您最近一年使用:0次
名校
6 . 海带中含有较多的碘元素,某化学兴趣小组通过以下步骤提取海带中的碘:
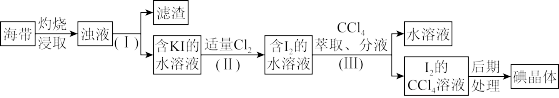
(1)步骤(Ⅰ)中分离操作的名称是_______ ,该操作中用到的玻璃仪器有漏斗、烧杯和_______ 。
(2)写出步骤(Ⅱ)中KI和Cl2反应的离子方程式_______ ,取少量反应后的溶液滴入淀粉试液,溶液呈_______ 色;
(3)步骤(Ⅲ)中萃取后分层, 的
的 溶液在
溶液在_______ (填“上层”或“下层”)。
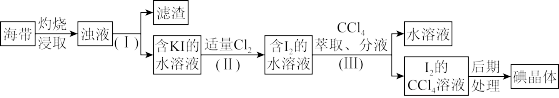
(1)步骤(Ⅰ)中分离操作的名称是
(2)写出步骤(Ⅱ)中KI和Cl2反应的离子方程式
(3)步骤(Ⅲ)中萃取后分层,
 的
的 溶液在
溶液在
您最近一年使用:0次
2022-04-20更新
|
117次组卷
|
2卷引用:福建省泉州市第七中学 2020--2021 学年高二上学期期末化学学业水平合格性测试二
2022高一·全国·专题练习
解题方法
7 . 工业上用活性炭吸附海带提碘后废水中的I-制取I2,其流程如下图:

(1)向废水中加入NaNO2并调节pH<4,写出反应的离子方程式_______ 。
(2)用活性炭吸附生成的单质碘的目的是_______ ,用浓、热NaOH洗脱吸附的碘的化学方程式为_______ 。
(3)从调节pH后所得的溶液中获取碘,工业上可用热空气吹出,其原因是_______ ;若取少量该溶液在实验室中分离得到单质碘,需要进行的操作为_______ 。
(4)流程中生成的NO尾气有毒,工业上将其与O2按一定比例通入NaOH制备NaNO2,写出反应的化学方程式:_______ 。
(5)工业上虚框内流程还可用如下图操作代替,评价该图流程的优点_______ (写出一条)。


(1)向废水中加入NaNO2并调节pH<4,写出反应的离子方程式
(2)用活性炭吸附生成的单质碘的目的是
(3)从调节pH后所得的溶液中获取碘,工业上可用热空气吹出,其原因是
(4)流程中生成的NO尾气有毒,工业上将其与O2按一定比例通入NaOH制备NaNO2,写出反应的化学方程式:
(5)工业上虚框内流程还可用如下图操作代替,评价该图流程的优点

您最近一年使用:0次
名校
解题方法
8 . Ⅰ.将海水淡化与浓海水资源化结合起来是综合利用海水的重要途径之一,一般是先将海水淡化获得淡水,再从剩余的浓海水中通过一系列工艺流程提取其他产品。回答下问题:
(1)请列举一种海水淡化的方法:_______ 。
(2)海水提溴中将Br2从苦卤中吹出,利用了Br2的_______ 性。
Ⅱ.通过传统的海带提碘工艺提取单质碘后,其所得废水中尚残留部分的I2,可用活性炭吸附法加以回收利用。具体流程如图:
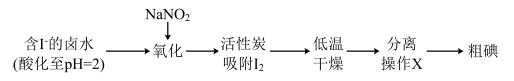
已知:i.pH=2时,NaNO2溶液只能将I-氧化为I2,同时生成NO
ii.将湿润的淀粉-KI试纸伸入盛满氯气的集气瓶中,试纸先变蓝,后褪色
(3)写出氧化含I-的卤水中发生的离子方程式:________ 。
(4)在分离操作X的装置如图所示,电加热器的作用是________ ,得到I2的位置位于该装置中________ 处(填图中选项)。

(5)已知Cl2的氧化性强于NaNO2,但该方法中却选择了价格较高的NaNO2,原因是_______ 。
(6)某工厂排出的废水,经测定含0.012mol/L的游离I2和8×10-4mol/L的H+,若改用加Na2SO3的方法除去I2,发生的化学反应为:Na2SO3+I2+H2O=Na2SO4+2HI,该反应中氧化产物与还原产物的物质的量之比为_______ ,现需处理5L该废水,则需加入0.05mol/L的Na2SO3溶液_______ L才能把I2除尽。
(1)请列举一种海水淡化的方法:
(2)海水提溴中将Br2从苦卤中吹出,利用了Br2的
Ⅱ.通过传统的海带提碘工艺提取单质碘后,其所得废水中尚残留部分的I2,可用活性炭吸附法加以回收利用。具体流程如图:

已知:i.pH=2时,NaNO2溶液只能将I-氧化为I2,同时生成NO
ii.将湿润的淀粉-KI试纸伸入盛满氯气的集气瓶中,试纸先变蓝,后褪色
(3)写出氧化含I-的卤水中发生的离子方程式:
(4)在分离操作X的装置如图所示,电加热器的作用是

(5)已知Cl2的氧化性强于NaNO2,但该方法中却选择了价格较高的NaNO2,原因是
(6)某工厂排出的废水,经测定含0.012mol/L的游离I2和8×10-4mol/L的H+,若改用加Na2SO3的方法除去I2,发生的化学反应为:Na2SO3+I2+H2O=Na2SO4+2HI,该反应中氧化产物与还原产物的物质的量之比为
您最近一年使用:0次
解题方法
9 . 碘是人体必需的微量元素,幼儿缺碘可导致发育迟缓、呆傻等多种疾病。海带中含有较多的碘元素,以下是从海带中提取碘并测定碘含量的实验方案。
提示:海带灰中碘元素以 形式存在。
形式存在。
实验一:海带中碘元素的检验
步骤Ⅰ:准确称取20.0g干海带,去除表面附着物、洗净、剪碎,用酒精浸润,灼烧完全至灰烬,停止加热、冷却。
步骤Ⅱ:将海带灰全部转移到小烧杯中,加入 蒸馏水搅拌,煮沸2~3分钟,过滤,洗涤,将滤液转移至
蒸馏水搅拌,煮沸2~3分钟,过滤,洗涤,将滤液转移至 容量瓶中定容。
容量瓶中定容。
步骤Ⅲ:取步骤IⅡ容量瓶中的溶液 于试管中,加入几滴
于试管中,加入几滴
 溶液酸化,再加入
溶液酸化,再加入 3%的
3%的 溶液和几滴淀粉溶液,观察现象。
溶液和几滴淀粉溶液,观察现象。
实验二:海带中碘元素含量的测定
步骤Ⅳ:取步骤Ⅱ容量瓶中溶液 于锥形瓶中,逐滴加入饱和溴水到呈浅黄色,放置一段时间使其充分反应后加热煮沸至黄色褪去,冷却后加入
于锥形瓶中,逐滴加入饱和溴水到呈浅黄色,放置一段时间使其充分反应后加热煮沸至黄色褪去,冷却后加入 10%
10% 溶液,摇匀,立即用
溶液,摇匀,立即用 的
的 标准溶液滴定反应至浅黄色,加入几滴淀粉溶液作指示剂,继续滴定到溶液刚好褪色,达到反应终点。重复以上操作2~3次,测得平均消耗
标准溶液滴定反应至浅黄色,加入几滴淀粉溶液作指示剂,继续滴定到溶液刚好褪色,达到反应终点。重复以上操作2~3次,测得平均消耗 标准溶液
标准溶液 。
。
涉及的有关反应有:①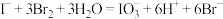
②
③
请按要求完成下列问题:
(1)步骤Ⅰ中用酒精浸润海带的作用是_______ ,灼烧海带的实验中需要的实验仪器有酒精灯、铁架台、泥三角、玻璃棒和_______ (填仪器名称)。
(2)说明海带中有碘元素的实验现象是_______ ,写出步骤中发生的离子反应方程式_______ 。
(3)根据以上数据计算每千克海带中含碘量约为_______  。
。
提示:海带灰中碘元素以
 形式存在。
形式存在。实验一:海带中碘元素的检验
步骤Ⅰ:准确称取20.0g干海带,去除表面附着物、洗净、剪碎,用酒精浸润,灼烧完全至灰烬,停止加热、冷却。
步骤Ⅱ:将海带灰全部转移到小烧杯中,加入
 蒸馏水搅拌,煮沸2~3分钟,过滤,洗涤,将滤液转移至
蒸馏水搅拌,煮沸2~3分钟,过滤,洗涤,将滤液转移至 容量瓶中定容。
容量瓶中定容。步骤Ⅲ:取步骤IⅡ容量瓶中的溶液
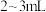 于试管中,加入几滴
于试管中,加入几滴
 溶液酸化,再加入
溶液酸化,再加入 3%的
3%的 溶液和几滴淀粉溶液,观察现象。
溶液和几滴淀粉溶液,观察现象。实验二:海带中碘元素含量的测定
步骤Ⅳ:取步骤Ⅱ容量瓶中溶液
 于锥形瓶中,逐滴加入饱和溴水到呈浅黄色,放置一段时间使其充分反应后加热煮沸至黄色褪去,冷却后加入
于锥形瓶中,逐滴加入饱和溴水到呈浅黄色,放置一段时间使其充分反应后加热煮沸至黄色褪去,冷却后加入 10%
10% 溶液,摇匀,立即用
溶液,摇匀,立即用 的
的 标准溶液滴定反应至浅黄色,加入几滴淀粉溶液作指示剂,继续滴定到溶液刚好褪色,达到反应终点。重复以上操作2~3次,测得平均消耗
标准溶液滴定反应至浅黄色,加入几滴淀粉溶液作指示剂,继续滴定到溶液刚好褪色,达到反应终点。重复以上操作2~3次,测得平均消耗 标准溶液
标准溶液 。
。涉及的有关反应有:①
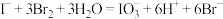
②

③

请按要求完成下列问题:
(1)步骤Ⅰ中用酒精浸润海带的作用是
(2)说明海带中有碘元素的实验现象是
(3)根据以上数据计算每千克海带中含碘量约为
 。
。
您最近一年使用:0次
2022高一·全国·专题练习
名校
解题方法
10 . 通过以下步骤可从干海带中提取碘:
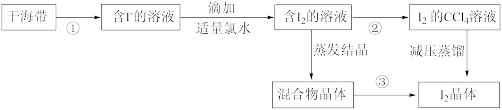
(1)操作②的名称是_______ 。
(2)向含I-(假设全部以NaI形式存在)的溶液中滴加适量氯水时反应的化学方程式为:_______ 。
(3)操作③的名称是_______ 。

(1)操作②的名称是
(2)向含I-(假设全部以NaI形式存在)的溶液中滴加适量氯水时反应的化学方程式为:
(3)操作③的名称是
您最近一年使用:0次



