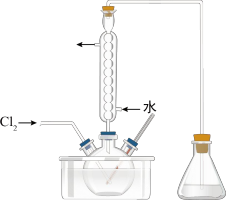
1 . 海带中含有丰富的碘元素。海带灼烧后的海带灰中,碘元素主要以I-形式存在。实验室里,从海带灰中提取碘的甲、乙两种方案如下:
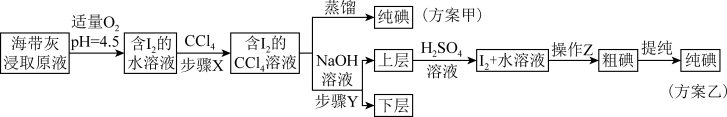
已知:3I2+6NaOH=5NaI+NaIO3+3H2O;酸性条件下,I2在水中的溶解度很小。
回答下列问题:
(1)灼烧海带实验用到的主要仪器有酒精灯、三脚架、泥三角、玻璃棒、___________ 等。
(2)“适量O2”也可以用双氧水替代,酸性条件下双氧水氧化碘离子的离子方程式为___________ 。
(3)上述方案乙中,“含I2的水溶液”经三步转化为含“I2+水溶液”,主要目的是___________ 。
(4)步骤X中,萃取后分液漏斗内观察到的现象是___________ 。
(5)下列有关步骤Y的说法中正确的是___________(填标号)
(6)方案甲中采用蒸馏分离效果不佳,原因是___________ ;方案乙中操作Z的名称是___________ 。

已知:3I2+6NaOH=5NaI+NaIO3+3H2O;酸性条件下,I2在水中的溶解度很小。
回答下列问题:
(1)灼烧海带实验用到的主要仪器有酒精灯、三脚架、泥三角、玻璃棒、
(2)“适量O2”也可以用双氧水替代,酸性条件下双氧水氧化碘离子的离子方程式为
(3)上述方案乙中,“含I2的水溶液”经三步转化为含“I2+水溶液”,主要目的是
(4)步骤X中,萃取后分液漏斗内观察到的现象是
(5)下列有关步骤Y的说法中正确的是___________(填标号)
| A.主要是除浸取原液中的有机杂质 |
| B.将碘转化成离子进入水层 |
| C.应控制NaOH溶液的浓度和体积 |
| D.NaOH溶液可由乙醇代替 |
您最近一年使用:0次
名校
解题方法
2 . 海水资源的利用具有非常广阔的前景。
I.情景1——实验室模拟海带提碘
某化学兴趣小组在实验室模拟从海带中提取碘的实验,实验流程如图所示。
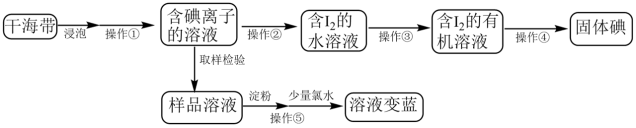
(1)提碘的原料一般选择海带或海藻,是因为_______ ,操作①的名称是_______ 。
(2)操作②为氧化,实验室一般选用氯水。工业上生产企业可以按照自己的实际情况,选择合适的氧化剂。若某企业在酸性条件下选择NaNO2为氧化剂,反应生成一种无色气体,遇空气立即变为红棕色,请写出该步骤中发生反应的离子方程式是_________ 。
(3)操作③用到的主要仪器是________ ;该步骤中加入石油醚能提取碘水中的碘,说明石油醚不溶于水,不与水反应,且______ 。操作④通过敞口挥发就能得到固体碘。
(4)操作⑤取样检验时,最好是先加入数滴淀粉溶液再逐滴加入少量氯水,请解释这样做的原因____________ 。
II.情景2——离子交换法从海带中提取碘
用离子交换法从海带中提取碘是一种较为先进的制碘工艺应用技术。下图是使用离子交换树脂的“离子交换法”从海带中提取碘的主要流程。
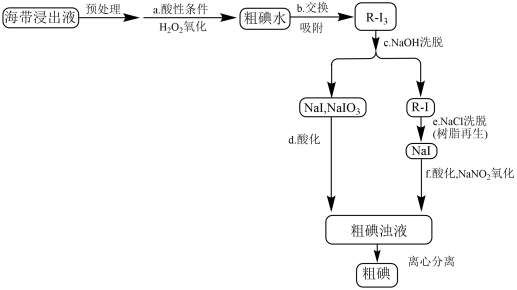
已知:①I2+I-⇌
②强碱性阴离子树脂(用R-Cl表示)对多碘离子( )有很强的交换吸附能力。
)有很强的交换吸附能力。
③步骤b交换吸附时发生的反应:R-Cl+ =R-I+Cl-。
=R-I+Cl-。
试回答下列问题:
(5)图中a、b、c、d、e、f各步反应中,属于氧化还原反应的有:___________ (填序号)
(6)酸性条件下,原料被H2O2氧化时发生的反应有:①2I-+H2O2+2H+=I2+2H2O;②I2+I-⇌ 。依据整个生产流程分析是否可以加足量H2O2?说明理由。
。依据整个生产流程分析是否可以加足量H2O2?说明理由。___________
(7)图中在NaCl洗脱时离子交换树脂(表示为R-Cl)可以得到再生,并重复使用,请用化学方程式表示离子交换树脂再生的原理___________ 。
III.情景3——海水提镁
目前世界上60%的镁是从海水中提取的。已知海水提镁的主要步骤如下:
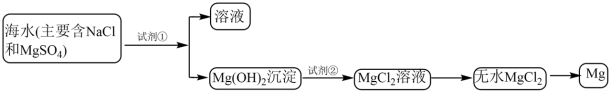
(8)为了使镁离子沉淀下来,加入的足量试剂①________ 。加入的足量试剂②是________ (填化学式)。
(9)无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,该反应的化学方程式为:MgCl2(熔融) Mg+Cl2↑,标出电子转移的方向和数目
Mg+Cl2↑,标出电子转移的方向和数目_______ 。
(10)氯气是MgCl2转化为Mg时获得的副产品,用化学方程式表示该物质的某种用途______ 。
I.情景1——实验室模拟海带提碘
某化学兴趣小组在实验室模拟从海带中提取碘的实验,实验流程如图所示。

(1)提碘的原料一般选择海带或海藻,是因为
(2)操作②为氧化,实验室一般选用氯水。工业上生产企业可以按照自己的实际情况,选择合适的氧化剂。若某企业在酸性条件下选择NaNO2为氧化剂,反应生成一种无色气体,遇空气立即变为红棕色,请写出该步骤中发生反应的离子方程式是
(3)操作③用到的主要仪器是
(4)操作⑤取样检验时,最好是先加入数滴淀粉溶液再逐滴加入少量氯水,请解释这样做的原因
II.情景2——离子交换法从海带中提取碘
用离子交换法从海带中提取碘是一种较为先进的制碘工艺应用技术。下图是使用离子交换树脂的“离子交换法”从海带中提取碘的主要流程。

已知:①I2+I-⇌

②强碱性阴离子树脂(用R-Cl表示)对多碘离子(
 )有很强的交换吸附能力。
)有很强的交换吸附能力。③步骤b交换吸附时发生的反应:R-Cl+
 =R-I+Cl-。
=R-I+Cl-。试回答下列问题:
(5)图中a、b、c、d、e、f各步反应中,属于氧化还原反应的有:
(6)酸性条件下,原料被H2O2氧化时发生的反应有:①2I-+H2O2+2H+=I2+2H2O;②I2+I-⇌
 。依据整个生产流程分析是否可以加足量H2O2?说明理由。
。依据整个生产流程分析是否可以加足量H2O2?说明理由。(7)图中在NaCl洗脱时离子交换树脂(表示为R-Cl)可以得到再生,并重复使用,请用化学方程式表示离子交换树脂再生的原理
III.情景3——海水提镁
目前世界上60%的镁是从海水中提取的。已知海水提镁的主要步骤如下:

(8)为了使镁离子沉淀下来,加入的足量试剂①
(9)无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,该反应的化学方程式为:MgCl2(熔融)
 Mg+Cl2↑,标出电子转移的方向和数目
Mg+Cl2↑,标出电子转移的方向和数目(10)氯气是MgCl2转化为Mg时获得的副产品,用化学方程式表示该物质的某种用途
您最近一年使用:0次
解题方法
3 . 请分析海水提镁、海带提碘的主要过程,按要求回答下列问题。
(1)海水提镁
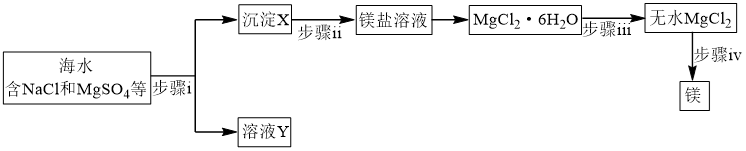
① 在周期表中位于
在周期表中位于_______ 区。
②步骤ⅰ所需试剂属于(填“强酸”、“强碱”或“可溶盐”)_______ 溶液。
③步骤ⅱ反应的离子方程式为_______ 。
④步骤ⅲ系列操作中需在 氛围中进行原因为
氛围中进行原因为_______ 。
⑤步骤ⅳ惰性电极电解熔融 时,在
时,在_______ 极每产生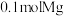 时,电路中转移电子数目为
时,电路中转移电子数目为_______ 。
(2)海带提碘(碘元素在海带中碘化物形式存在,碘为微溶于水的紫黑色固体)
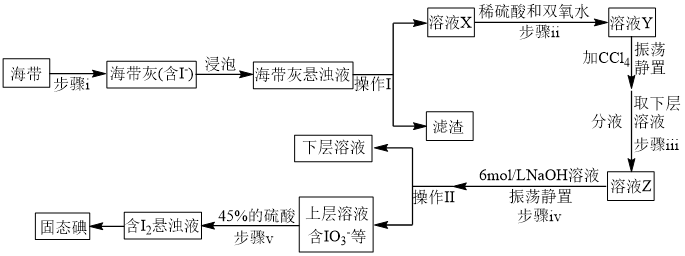
①步骤ⅰ不会用到下列仪器中的_______ (填字母)
a.酒精灯 b.漏斗 c.坩埚 d.泥三角
②操作Ⅰ、Ⅱ的名称依次为_______ 、_______ 。
③步骤ⅱ反应的离子方程式为_______ 。
④步骤ⅲ到步骤Ⅴ的目的是_______ 。
⑤步骤Ⅴ中 参与反应的离子方程式为
参与反应的离子方程式为_______ 。
(1)海水提镁

①
 在周期表中位于
在周期表中位于②步骤ⅰ所需试剂属于(填“强酸”、“强碱”或“可溶盐”)
③步骤ⅱ反应的离子方程式为
④步骤ⅲ系列操作中需在
 氛围中进行原因为
氛围中进行原因为⑤步骤ⅳ惰性电极电解熔融
 时,在
时,在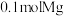 时,电路中转移电子数目为
时,电路中转移电子数目为(2)海带提碘(碘元素在海带中碘化物形式存在,碘为微溶于水的紫黑色固体)

①步骤ⅰ不会用到下列仪器中的
a.酒精灯 b.漏斗 c.坩埚 d.泥三角
②操作Ⅰ、Ⅱ的名称依次为
③步骤ⅱ反应的离子方程式为
④步骤ⅲ到步骤Ⅴ的目的是
⑤步骤Ⅴ中
 参与反应的离子方程式为
参与反应的离子方程式为
您最近一年使用:0次
4 . 海带、紫菜等藻类植物含有丰富的碘元素。某化学实验小组同学从海带中提取碘并计算海带中的碘元素含量,进行以下实验:
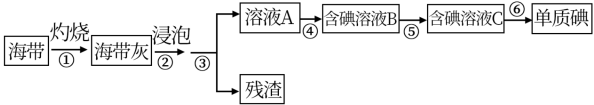
已知:步骤⑥是用反萃取法从碘的四氯化碳溶液中提取碘。
回答下列问题:
(1)在进行步骤①之前,他们称取m g干海带,甲同学提出将海带先剪碎,然后用水浸泡、洗净、晾干放入___________ 中灼烧至海带完全成灰烬。乙同学认为甲的操作不合理,其理由是___________ 。
(2)海带提碘的一系列操作中需要过滤的步骤是___________ 。
(3)步骤④中,甲同学向溶液A中先滴加几滴淀粉溶液,发现未明显变化,再加入氯水后溶液颜色变蓝,此反应的离子方程式是___________ ;乙同学认为使用稀硫酸和 溶液能更有利于提取碘,其理由
溶液能更有利于提取碘,其理由___________ 。
(4)步骤⑤中用分液漏斗得到碘的四氯化碳溶液,其操作顺序是___________ (填写字母)。
a.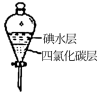 b.
b.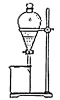
c. d.
d.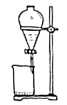
请设计一种简单的实验方法,检验提取碘后的水溶液中还含有单质碘:___________ 。
(5)将得到的单质碘,干燥、称量,其质量为n g:则海带中碘元素的含量为___________ 。

已知:步骤⑥是用反萃取法从碘的四氯化碳溶液中提取碘。
回答下列问题:
(1)在进行步骤①之前,他们称取m g干海带,甲同学提出将海带先剪碎,然后用水浸泡、洗净、晾干放入
(2)海带提碘的一系列操作中需要过滤的步骤是
(3)步骤④中,甲同学向溶液A中先滴加几滴淀粉溶液,发现未明显变化,再加入氯水后溶液颜色变蓝,此反应的离子方程式是
 溶液能更有利于提取碘,其理由
溶液能更有利于提取碘,其理由(4)步骤⑤中用分液漏斗得到碘的四氯化碳溶液,其操作顺序是
a.
 b.
b.
c.
 d.
d.
请设计一种简单的实验方法,检验提取碘后的水溶液中还含有单质碘:
(5)将得到的单质碘,干燥、称量,其质量为n g:则海带中碘元素的含量为
您最近一年使用:0次
2021-05-06更新
|
470次组卷
|
5卷引用:山东省枣庄市2020-2021学年高一下学期期中考试化学试题
山东省枣庄市2020-2021学年高一下学期期中考试化学试题(已下线)期末综合检测卷01【综合检测】-2020-2021学年高一化学下学期期末专项复习(人教版必修2)陕西省西安市雁塔区第二中学、渭北中学2021-2022学年高二下学期期中联考化学试题(已下线)第2章能力提升测评-【帮课堂】2022-2023学年高一化学同步精品讲义(沪科版2020必修第一册)山东省菏泽市单县第二中学2022-2023学年高一下学期3月段考化学试题
名校
5 . 碘主要用于制药物、染料和碘化合物等,海带、紫菜等藻类植物中富含碘元素。实验室中从海带中提取碘的流程如图。
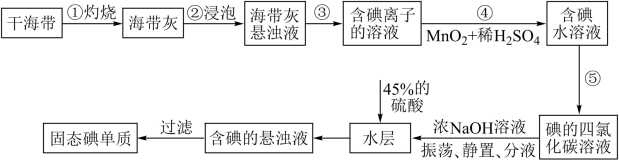
已知:碘元素在海带中以碘化物的形式存在;碘单质与NaOH浓溶液发生的反应为:3I2+6NaOH=5NaI+NaIO3+3H2O
回答下列问题:
(1)“灼烧”时,应将干海带放在___________________ (填仪器名称) 进行加热。
(2)步骤④发生反应的离子方程式为__________________ 。
(3)“过滤”操作用到的主要玻璃仪器有________________________ 。
(4)下列有关步骤⑤的叙述正确的是_________ (填序号)。
a.用到的主要玻璃仪器是分液漏斗和烧杯
b.也可选择苯或酒精作萃取剂
c.“萃取”实验中,振荡后,分液漏斗下口向上倾斜,打开活塞,使漏斗内气体放出
d.“分液”时,应打开旋塞,先将水层放出
(5)加入45%的硫酸后发生反应的离子方程式为________________________ 。
(6)该学习小组欲探究氯气、溴单质、碘单质的氧化性强弱。设计的实验操作依次为:i.向NaBr溶液中通入氯气 ii.向KI溶液中通入氯气
①若要验证氧化性Cl2>Br2>I2,你认为该小组同学还需完成的实验是______ (用离子方程式表示)。
②请用原子结构知识解释Cl2的氧化性强于I2的原因______________ 。

已知:碘元素在海带中以碘化物的形式存在;碘单质与NaOH浓溶液发生的反应为:3I2+6NaOH=5NaI+NaIO3+3H2O
回答下列问题:
(1)“灼烧”时,应将干海带放在
(2)步骤④发生反应的离子方程式为
(3)“过滤”操作用到的主要玻璃仪器有
(4)下列有关步骤⑤的叙述正确的是
a.用到的主要玻璃仪器是分液漏斗和烧杯
b.也可选择苯或酒精作萃取剂
c.“萃取”实验中,振荡后,分液漏斗下口向上倾斜,打开活塞,使漏斗内气体放出
d.“分液”时,应打开旋塞,先将水层放出
(5)加入45%的硫酸后发生反应的离子方程式为
(6)该学习小组欲探究氯气、溴单质、碘单质的氧化性强弱。设计的实验操作依次为:i.向NaBr溶液中通入氯气 ii.向KI溶液中通入氯气
①若要验证氧化性Cl2>Br2>I2,你认为该小组同学还需完成的实验是
②请用原子结构知识解释Cl2的氧化性强于I2的原因
您最近一年使用:0次
解题方法
6 . 实验室从海带浸取液中提取碘单质。
(1)碘的结构与性质
①碘原子核外有5个电子层,最外层有7个电子,碘元素在周期表中的位置是_______ 。
②质子数为53、中子数为78的碘核素表示为_______ 。
③设计简单的实验验证氯的非金属性比碘强:_____ 。(须用试剂:新制氯水、KI溶液,淀粉溶液)
(2)提取碘单质
I.萃取氧化法:向浸取液中加入 ,调节pH为3~4,加入
,调节pH为3~4,加入 ,再加入
,再加入 溶液,反应一段时间后得到
溶液,反应一段时间后得到 的
的 溶液。
溶液。
①调pH时不用盐酸来替代 的主要原因是
的主要原因是_______ 。(填序号)
a.盐酸易挥发使溶液pH变化快, 不易挥发溶液pH缓慢
不易挥发溶液pH缓慢
b. 为弱电解质,反应过程中电离出
为弱电解质,反应过程中电离出 维持溶液的pH
维持溶液的pH
②加入 的作用是
的作用是_______ ,得到 的
的 溶液。
溶液。
II.双氧化法:把浸取液分成A、B两份,在 催化下用
催化下用 把A溶液中的
把A溶液中的 氧化为
氧化为 ,然后与B溶液混合,经盐酸酸化得到碘单质。
,然后与B溶液混合,经盐酸酸化得到碘单质。
③ 氧化
氧化 的离子方程式为
的离子方程式为_______ 。
④A、B两份溶液的体积比为_______ 时,可使碘的提取率最高。
(3)废液的处理:提取碘后的酸性废液中含有少量的 、
、 ,向废液中加入适量
,向废液中加入适量 把
把 氧化成
氧化成 ,然后加入活性炭,过滤后排放。活性炭的作用是
,然后加入活性炭,过滤后排放。活性炭的作用是_______ 。
(1)碘的结构与性质
①碘原子核外有5个电子层,最外层有7个电子,碘元素在周期表中的位置是
②质子数为53、中子数为78的碘核素表示为
③设计简单的实验验证氯的非金属性比碘强:
(2)提取碘单质
I.萃取氧化法:向浸取液中加入
 ,调节pH为3~4,加入
,调节pH为3~4,加入 ,再加入
,再加入 溶液,反应一段时间后得到
溶液,反应一段时间后得到 的
的 溶液。
溶液。①调pH时不用盐酸来替代
 的主要原因是
的主要原因是a.盐酸易挥发使溶液pH变化快,
 不易挥发溶液pH缓慢
不易挥发溶液pH缓慢b.
 为弱电解质,反应过程中电离出
为弱电解质,反应过程中电离出 维持溶液的pH
维持溶液的pH②加入
 的作用是
的作用是 的
的 溶液。
溶液。II.双氧化法:把浸取液分成A、B两份,在
 催化下用
催化下用 把A溶液中的
把A溶液中的 氧化为
氧化为 ,然后与B溶液混合,经盐酸酸化得到碘单质。
,然后与B溶液混合,经盐酸酸化得到碘单质。③
 氧化
氧化 的离子方程式为
的离子方程式为④A、B两份溶液的体积比为
(3)废液的处理:提取碘后的酸性废液中含有少量的
 、
、 ,向废液中加入适量
,向废液中加入适量 把
把 氧化成
氧化成 ,然后加入活性炭,过滤后排放。活性炭的作用是
,然后加入活性炭,过滤后排放。活性炭的作用是
您最近一年使用:0次
名校
解题方法
7 . 海洋是一座巨大的化学资源宝库,如图是从海水中或海产品中提取若干种化学物质的流程图。
I.试剂级NaCl可用海盐(含泥沙、海藻、Ca2+、Mg2+、Fe3+、SO 等杂质)为原料制备。
等杂质)为原料制备。

(1)焙炒海盐的目的是______ 。
(2)根据除杂原理,填写合适的试剂③,并选择每步 预期沉淀的离子。
离子:a.Ca2+ b.Mg2+ c.Fe3+ d.SO
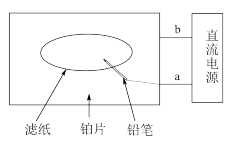
(3)以氯化钠为原料设计了“黑笔写红字”的趣味实验。滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹。下列叙述正确的是______ 。
II.国家海洋局科研学者考察了从浓海水中提溴的一种新型方法:聚四氟乙烯(PTFE)气态膜法提溴。本方法关键是采用了PTFE中空纤维膜,在该膜中,水不可以通过,而溴分子可以自主进入和脱离。
将氧化后的浓海水加入气态膜设备预处理,用NaOH溶液作为吸收液配合处理。处理过程的俯视截面示意图如图所示。经流出液氧化后的流出液检验,流出液中含BrO 离子。
离子。
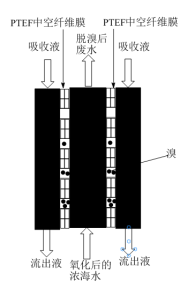
(4)浓海水中溴元素的存在形式是______ ,氧化浓海水时可选用的氧化剂是______ 。
(5)流出液中另外一种含溴物质是______ 。
(6)说明聚四氟乙烯(PTFE)气态膜是如何在上述过程中起到富集作用______ 。
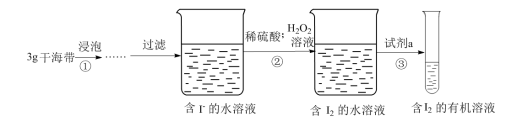
III.小淳同学按如图实验过程,证明海带中存在碘元素。
(7)H2O2的作用是______ 。
(8)试剂a不能选择的是(填序号)______ 。
(9)操作③的名称是______ 。
(10)操作③中需要振荡排放气体,放气时分液漏斗的状态是______ 。
小桢同学欲探究I-的性质,进行如图实验:
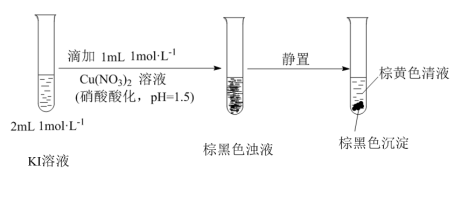
(11)该小组同学推测反应生成了I2。设计实施了如下方案,证实了推测。请将方案补充完整:取棕色清液,______ 。
进一步探究发现:棕黑色沉淀中含有CuI。
(12)由此推知:Cu(NO3)2与KI反应过程中,一定发生的反应的离子方程式为______ 。
I.试剂级NaCl可用海盐(含泥沙、海藻、Ca2+、Mg2+、Fe3+、SO
 等杂质)为原料制备。
等杂质)为原料制备。
(1)焙炒海盐的目的是
(2)根据除杂原理,填写合适的试剂③,并
离子:a.Ca2+ b.Mg2+ c.Fe3+ d.SO

| 实验步骤 | 试剂 | 预期沉淀的离子 |
| 步骤1 | 适量NaOH溶液 | ① |
| 步骤2 | 适量BaCl2溶液 | ② |
| 步骤3 | 适量③ | ④ |
(3)以氯化钠为原料设计了“黑笔写红字”的趣味实验。滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹。下列叙述正确的是

| A.b极发生还原反应 | B.铂片端作阴极 |
| C.铅笔端有少量的氯气产生 | D.a处是负极 |
II.国家海洋局科研学者考察了从浓海水中提溴的一种新型方法:聚四氟乙烯(PTFE)气态膜法提溴。本方法关键是采用了PTFE中空纤维膜,在该膜中,水不可以通过,而溴分子可以自主进入和脱离。
将氧化后的浓海水加入气态膜设备预处理,用NaOH溶液作为吸收液配合处理。处理过程的俯视截面示意图如图所示。经流出液氧化后的流出液检验,流出液中含BrO
 离子。
离子。
(4)浓海水中溴元素的存在形式是
(5)流出液中另外一种含溴物质是
(6)说明聚四氟乙烯(PTFE)气态膜是如何在上述过程中起到富集作用
III.小淳同学按如图实验过程,证明海带中存在碘元素。

(7)H2O2的作用是
(8)试剂a不能选择的是(填序号)
| A.CCl4 | B.苯 | C.酒精 | D.直馏汽油 |
(9)操作③的名称是
(10)操作③中需要振荡排放气体,放气时分液漏斗的状态是
A. | B. | C. | D. |
小桢同学欲探究I-的性质,进行如图实验:

(11)该小组同学推测反应生成了I2。设计实施了如下方案,证实了推测。请将方案补充完整:取棕色清液,
进一步探究发现:棕黑色沉淀中含有CuI。
(12)由此推知:Cu(NO3)2与KI反应过程中,一定发生的反应的离子方程式为
您最近一年使用:0次
8 . 碘(紫黑色固体,微溶于水)及其化合物广泛用于医药、染料等方面。工业上从含碘海水中制备 的一种方法如图所示。已知氧化性
的一种方法如图所示。已知氧化性 ,还原性
,还原性 。回答下列问题:
。回答下列问题:
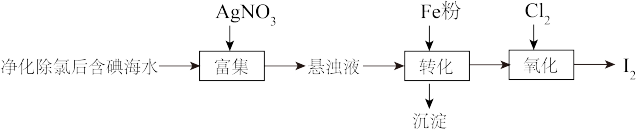
(1)海带中含有丰富的碘元素,处理时应将海带放入_______ (填仪器名称)中进行灼烧得含 的灰烬。
的灰烬。
(2)转化过程加入的Fe粉是过量的,发生的反应为: 。若往转化所得的沉淀中加入稀硫酸,反应的离子方程式为
。若往转化所得的沉淀中加入稀硫酸,反应的离子方程式为_______ ;若要检验转化过程所加Fe粉是否过量,可取适量转化所得的溶液于试管中,加入_______ 溶液,观察现象。
(3)氧化过程可以用适量的酸化的 代替
代替 ,则该反应的离子方程式为
,则该反应的离子方程式为_______ 。用 做氧化剂时也需控制
做氧化剂时也需控制 的用量,若反应物
的用量,若反应物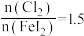 时,氧化产物为
时,氧化产物为 和
和_______ ,当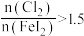 ,
, 会被过量的
会被过量的 进一步氧化从而导致单质碘的收率会降低。
进一步氧化从而导致单质碘的收率会降低。
(4)实验室从含碘废液(除 外,还含有
外,还含有 、
、 、
、 等)中回收碘,其实验过程如图所示:
等)中回收碘,其实验过程如图所示:
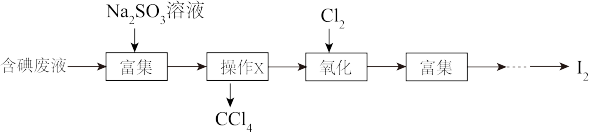
①操作X的名称为_______ 。
②向含碘废液中加入稍过量的 溶液,将废液中的
溶液,将废液中的 还原为
还原为 ,该操作的目的是
,该操作的目的是_______ 。
③氧化时,在三颈烧瓶中将含 的水溶液用盐酸调至pH约为2,缓慢通入
的水溶液用盐酸调至pH约为2,缓慢通入 ,在40℃左右反应(实验装置如图所示)。实验控制在较低温度下进行的原因可能是
,在40℃左右反应(实验装置如图所示)。实验控制在较低温度下进行的原因可能是_______ 。(选填字母编号)
A.增大 的溶解度 B.防止
的溶解度 B.防止 的升华 C.防止水发生分解
的升华 C.防止水发生分解
 的一种方法如图所示。已知氧化性
的一种方法如图所示。已知氧化性 ,还原性
,还原性 。回答下列问题:
。回答下列问题:
(1)海带中含有丰富的碘元素,处理时应将海带放入
 的灰烬。
的灰烬。(2)转化过程加入的Fe粉是过量的,发生的反应为:
 。若往转化所得的沉淀中加入稀硫酸,反应的离子方程式为
。若往转化所得的沉淀中加入稀硫酸,反应的离子方程式为(3)氧化过程可以用适量的酸化的
 代替
代替 ,则该反应的离子方程式为
,则该反应的离子方程式为 做氧化剂时也需控制
做氧化剂时也需控制 的用量,若反应物
的用量,若反应物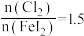 时,氧化产物为
时,氧化产物为 和
和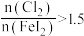 ,
, 会被过量的
会被过量的 进一步氧化从而导致单质碘的收率会降低。
进一步氧化从而导致单质碘的收率会降低。(4)实验室从含碘废液(除
 外,还含有
外,还含有 、
、 、
、 等)中回收碘,其实验过程如图所示:
等)中回收碘,其实验过程如图所示:
①操作X的名称为
②向含碘废液中加入稍过量的
 溶液,将废液中的
溶液,将废液中的 还原为
还原为 ,该操作的目的是
,该操作的目的是③氧化时,在三颈烧瓶中将含
 的水溶液用盐酸调至pH约为2,缓慢通入
的水溶液用盐酸调至pH约为2,缓慢通入 ,在40℃左右反应(实验装置如图所示)。实验控制在较低温度下进行的原因可能是
,在40℃左右反应(实验装置如图所示)。实验控制在较低温度下进行的原因可能是
A.增大
 的溶解度 B.防止
的溶解度 B.防止 的升华 C.防止水发生分解
的升华 C.防止水发生分解
您最近一年使用:0次
解题方法
9 . 实验室里从海带中提取碘的流程如下:
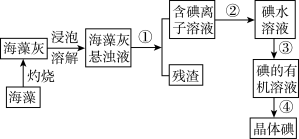
(1)提取碘的过程中有关实验的操作名称①_______ 、②_______ 、③_______ 、④_______ 。
(2)进行步骤①操作时,需要用到的玻璃仪器有:烧杯、漏斗和_______ 。进行步骤③操作时,需要用到的主要仪器是_______ 。
(3)写出上述过程中含I-的溶液通氯气后的离子方程式:_______ ,该反应中的氧化剂是_______ 。
(4)某同学想证明以上流程中的未知无色溶液中含有I-,现有以下试剂可供选择:
①新制氯水、②稀硝酸、③CCl4、④AgNO3溶液、⑤淀粉溶液。(完成以下填空)

(1)提取碘的过程中有关实验的操作名称①
(2)进行步骤①操作时,需要用到的玻璃仪器有:烧杯、漏斗和
(3)写出上述过程中含I-的溶液通氯气后的离子方程式:
(4)某同学想证明以上流程中的未知无色溶液中含有I-,现有以下试剂可供选择:
①新制氯水、②稀硝酸、③CCl4、④AgNO3溶液、⑤淀粉溶液。(完成以下填空)
| 方案 | 选用试剂(填标号) | 主要现象 |
| 1 | 未知溶液、 | |
| 2 | 未知溶液、 |
您最近一年使用:0次
解题方法
10 . 海洋是巨大的资源宝库,孕育着丰富的矿产。海水资源的综合利用对人类的生产生活有重要意义。回答下列问题:
Ⅰ.从海带中提取碘的工艺流程如图所示:

(1)灼烧干海带需在仪器________ (填“蒸发皿”“坩埚”或“烧杯”)内进行。
(2)用蒸馏水浸取海带灰时,为提高浸取率,可采用的方法有_________ (填一种即可);
(3)将溶液中的I-氧化成I2,最佳选用试剂为_________(填标号)。
(4)欲证明水溶液中含有I2,实验方法为________________ 。
Ⅱ.空气吹出法是目前“海水提溴”的主要方法之一,其主要工艺流程如图所示:

(5)步骤①的离子方程式为___________ 。
(6)步骤②说明溴单质具有_________ 性,步骤③④的目的是______________ 。
(7)步骤③的还原剂若为 溶液,则其离子方程式为
溶液,则其离子方程式为____________ 。
Ⅰ.从海带中提取碘的工艺流程如图所示:

(1)灼烧干海带需在仪器
(2)用蒸馏水浸取海带灰时,为提高浸取率,可采用的方法有
(3)将溶液中的I-氧化成I2,最佳选用试剂为_________(填标号)。
| A.稀硝酸 | B.酸性 | C.浓硫酸 | D.稀硫酸、 |
Ⅱ.空气吹出法是目前“海水提溴”的主要方法之一,其主要工艺流程如图所示:

(5)步骤①的离子方程式为
(6)步骤②说明溴单质具有
(7)步骤③的还原剂若为
 溶液,则其离子方程式为
溶液,则其离子方程式为
您最近一年使用:0次



