湖南省株洲市茶陵县第三中学2019-2020学年高二上学期期中考试化学(选考)试题
湖南
高二
期中
2019-11-28
171次
整体难度:
适中
考查范围:
化学反应原理
一、单选题 添加题型下试题
 2C(g)
2C(g)  达到平衡后,将反应体系的温度降低,下列叙述中正确的是
达到平衡后,将反应体系的温度降低,下列叙述中正确的是| A.正反应速率增大,逆反应速率减小,平衡向正反应方向移动 |
| B.正反应速率减小,逆反应速率增大,平衡向逆反应方向移动 |
| C.正反应速率和逆反应速率都减小,平衡向正反应方向移动 |
| D.正反应速率和逆反应速率都减小,平衡向逆反应方向移动 |
【知识点】 温度对化学反应速率的影响解读 温度对化学平衡移动的影响解读
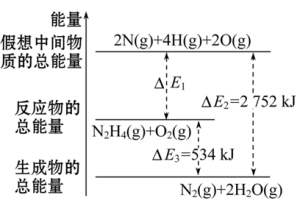
| A.26.0kJ | B.51.9kJ | C.155.8kJ | D.467.3kJ |
【知识点】 化学反应热的计算 燃烧热的计算解读 依据热化学方程式的计算解读
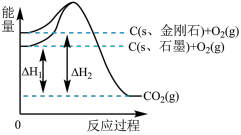
| A.金刚石的稳定性强于石墨 |
| B.石墨和金刚石的转化是物理变化 |
| C.C(s、石墨)=C(s、金刚石) ΔH=+1.9kJ·mol-1 |
| D.断裂1 mol石墨中的化学键吸收的能量比断裂1mol金刚石中的化学键吸收的能量少 |
②稀溶液中,H+(aq)+OH-(aq)=H2O(l)ΔH=-57.3 kJ·mol-1
③H2(g)+
 O2(g)=H2O(g)ΔH=-241.8 kJ·mol-1
O2(g)=H2O(g)ΔH=-241.8 kJ·mol-1④H2O(g)=H2O(l)ΔH=-44.0 kJ·mol-1
下列结论正确的是( )
| A.碳的燃烧热小于-110.5 kJ·mol-1 |
| B.浓硫酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量 |
| C.氢气的燃烧热为-241.8 kJ·mol-1 |
| D.2H2(g)+O2(g)=2H2O(l)的反应热为ΔH=+571.6 kJ·mol-1 |
| A.S(s)+O2(g)=SO2(g) ΔH=ΔH2-ΔH1 |
| B.S(s)+O2(g)=SO2(g) ΔH=ΔH1-ΔH2 |
| C.S(s)+O2(g)=SO2(g) ΔH=ΔH1+ΔH2 |
| D.1 mol S(s)燃烧生成1 mol SO2(g)放出的热量大于1 mol S(g)燃烧生成1 mol SO2(g)放出的热量 |
【知识点】 盖斯定律与热化学方程式解读 反应热大小比较解读
②2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ·mol-1
则制备水煤气的反应C(s)+H2O(g)=CO(g)+H2(g)的△H为( )
| A.+262.6 kJ·mol-1 | B.-131.3 kJ·mol-1 |
| C.-352.3 kJ·mol-1 | D.+131.3 kJ·mol-1 |
【知识点】 盖斯定律及其有关计算 盖斯定律的应用解读
二、未知 添加题型下试题
三、单选题 添加题型下试题
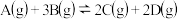 ,在不同情况下测其反应速率,其中反应速率
,在不同情况下测其反应速率,其中反应速率 最快的是
最快的是A.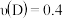 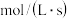 | B.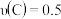 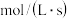 |
C. 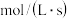 | D. 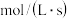 |
 4C(g)+5D(g)。若经5s后,剩下的A是2.5mol,则B的反应速率是( )
4C(g)+5D(g)。若经5s后,剩下的A是2.5mol,则B的反应速率是( )| A.0.45mol/L·s | B.0.15mol/L·s | C.0.225mol/L·s | D.0.9mol/L·s |
 O2(g)
O2(g) SO3 (g) 的平衡常数K1=50,在同一温度下,反应2SO3(g)
SO3 (g) 的平衡常数K1=50,在同一温度下,反应2SO3(g) 2SO2(g) +O2(g)的平衡常数K2的值为( )
2SO2(g) +O2(g)的平衡常数K2的值为( )| A.2500 | B.4×10-4 | C.100 | D.2×10-2 |
【知识点】 化学平衡常数的概念及表达方式解读
 2HI(g)
2HI(g)  H<0 达到平衡后,当改变外界条件如物质浓度、体系压强、温度等而发生下列项目的变化时,能作为平衡一定发生了移动的标志的是
H<0 达到平衡后,当改变外界条件如物质浓度、体系压强、温度等而发生下列项目的变化时,能作为平衡一定发生了移动的标志的是| A.气体的密度变小了 | B.反应物和生成物浓度均变为原来的2倍 |
| C.气体的颜色变深了 | D.体系的温度发生了变化 |
【知识点】 化学平衡的移动及其影响因素
| A.NH4NO3溶于水吸热,说明其溶于水不是自发过程 |
| B.常温下,反应C(s)+CO2(g)===2CO(g)为熵增加的反应,可以自发进行 |
| C.熵增加且放热的反应一定是自发反应 |
| D.非自发反应在任何条件下都不能实现 |
【知识点】 化学反应进行方向的判据
 2C(g)达到平衡时,各物质的物质的量之比为n(A)∶n(B)∶n(C)=2∶2∶1。保持温度不变,以2∶2∶1的物质的量之比再充入A、B、C,则
2C(g)达到平衡时,各物质的物质的量之比为n(A)∶n(B)∶n(C)=2∶2∶1。保持温度不变,以2∶2∶1的物质的量之比再充入A、B、C,则 | A.平衡不移动 |
| B.再达平衡时,n(A)∶n(B)∶n(C)仍为2∶2∶1 |
| C.再达平衡时,C的体积分数增大 |
| D.再达平衡时,正反应速率增大,逆反应速率减小 |
【知识点】 压强对化学平衡移动的影响解读
A. |
B.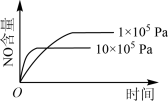 |
C.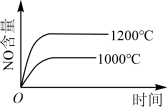 |
D.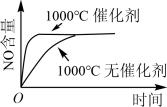 |
 C(g)△H<0。开始充入2mol A和2mol B,并达到平衡状态,下列说法正确的是
C(g)△H<0。开始充入2mol A和2mol B,并达到平衡状态,下列说法正确的是| A.再充入2mol A,平衡正移,A的转化率增大 |
| B.如果升高温度,C的体积分数增大 |
| C.如果增大压强,化学平衡一定向正反应方向移动,B的体积分数减小 |
| D.再充入1mol C,C的物质的量浓度将增大 |
【知识点】 化学平衡的移动及其影响因素 化学平衡的移动解读
 2Z(g)+W(s) ΔH<0,下列叙述正确的是 ( )
2Z(g)+W(s) ΔH<0,下列叙述正确的是 ( )| A.平衡常数K值越大,X的转化率越大 |
| B.达到平衡时,反应速率v正(X)=2v逆(Z) |
| C.达到平衡后降低温度,正向反应速率减小的倍数大于逆向反应速率减小的倍数 |
| D.达到平衡后,升高温度或增大压强都有利于该反应平衡向逆反应方向移动 |
【知识点】 化学平衡的移动及其影响因素 化学平衡常数 化学平衡的移动解读
四、填空题 添加题型下试题
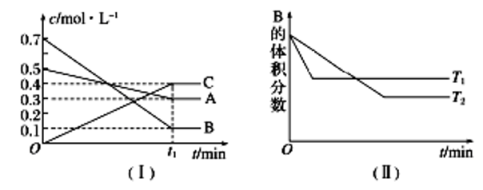
根据以上条件,回答下列问题:
(1)A与B反应生成C的化学方程式为
(2)t1 min后,改变下列某一条件,能使平衡向逆反应方向移动的有
A.保持其他条件不变,增大压强
B.保持容器总体积不变,通入少量稀有气体
C.保持其他条件不变,升高温度
 B+C在某一温度时,达到平衡。
B+C在某一温度时,达到平衡。(1)若温度升高,平衡向正反应方向移动,则正反应是
(2)若B为固体,减小压强平衡向逆反应方向移动,则A呈
(3)若A、B、C均为气体,加入催化剂,平衡
【知识点】 化学平衡的移动及其影响因素
 B(g)+C(g),三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在950℃,B、C的起始浓度都为0,反应物A的浓度(mol·L-1)随时间(min)的变化如图所示。试回答下列问题:
B(g)+C(g),三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在950℃,B、C的起始浓度都为0,反应物A的浓度(mol·L-1)随时间(min)的变化如图所示。试回答下列问题: 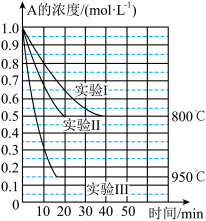
(1)在实验Ⅰ中,反应在20~40min内A的平均反应速率为
(2)该反应的ΔH
(3)实验Ⅰ第40min末,若降低反应温度,达到新的平衡后,A的浓度不可能为
A.0.35mol·L-1 B.0.4mol·L-1 C.0.7mol·L-1 D.0.8mol·L-1
(4)若反应在800℃进行,在该1L的密闭容器中加入1molA、0.2molHe,达到平衡时A的转化率应
A.等于86% B.等于50% C.小于50% D.介于50%~86%之间
五、解答题 添加题型下试题

(1)从实验装置上看,图中尚缺少的一种玻璃用品是
(2)大烧杯上如不盖硬纸板,则求得的中和热数值
(3)实验中若改用60 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1 NaOH溶液进行反应,与上述实验相比,所放出的热量
(4)三次平行操作测得的数据中,起始时盐酸与烧碱溶液温度相同,而终止温度与起始温度之差(t2-t1)分别为2.3 ℃、2.4 ℃、2.9 ℃,则最终代入计算式的温度差的平均值为
【知识点】 中和热的测定与误差分析解读
六、填空题 添加题型下试题

根据上图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程式
(2)PCl5分解成PCl3和Cl2的热化学方程式
(3)P和Cl2分两步反应生成1molPCl5的△H3=
(4)PCl5与足量水充分反应,最终生成两种酸,已知反应前后各元素化合价不变,其化学方程式是
【知识点】 热化学方程式书写及正误判断解读 盖斯定律与热化学方程式解读
试卷分析
试卷题型(共 21题)
试卷难度
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.94 | 温度对化学反应速率的影响 温度对化学平衡移动的影响 | |
| 2 | 0.65 | 化学反应热的计算 燃烧热的计算 依据热化学方程式的计算 | |
| 3 | 0.85 | 化学反应中能量变化的原因 焓变 化学键与化学反应中的能量关系 化学能与物质稳定性之间的关系 | |
| 4 | 0.65 | 热化学方程式书写及正误判断 中和热概念 燃烧热概念 | |
| 5 | 0.85 | 盖斯定律与热化学方程式 反应热大小比较 | |
| 6 | 0.85 | 盖斯定律及其有关计算 盖斯定律的应用 | |
| 8 | 0.65 | 化学反应速率的定量表示方法 化学反应速率与化学计量数之间的关系 | |
| 9 | 0.85 | 化学反应速率计算 | |
| 10 | 0.85 | 化学平衡常数的概念及表达方式 | |
| 11 | 0.65 | 化学平衡的移动及其影响因素 | |
| 12 | 0.85 | 化学反应进行方向的判据 | |
| 13 | 0.65 | 压强对化学平衡移动的影响 | |
| 14 | 0.65 | 化学平衡的移动及其影响因素 温度对化学平衡移动的影响 压强对化学平衡移动的影响 | |
| 15 | 0.65 | 化学平衡的移动及其影响因素 化学平衡的移动 | |
| 16 | 0.65 | 化学平衡的移动及其影响因素 化学平衡常数 化学平衡的移动 | |
| 二、未知 | |||
| 7 | 0.85 | 化学反应热的计算 化学键与化学反应中的能量关系 | 未知 |
| 三、填空题 | |||
| 17 | 0.65 | 化学平衡的移动及其影响因素 化学平衡建立的过程 与物质百分含量变化有关图像的分析 | |
| 18 | 0.85 | 化学平衡的移动及其影响因素 | |
| 19 | 0.65 | 化学平衡图像分析 温度对化学平衡移动的影响 压强对化学平衡移动的影响 转化率的相关计算及判断 | |
| 21 | 0.65 | 热化学方程式书写及正误判断 盖斯定律与热化学方程式 | |
| 四、解答题 | |||
| 20 | 0.65 | 中和热的测定与误差分析 | 实验探究题 |