湖北省武汉市江夏区金口中学2019-2020学年沆二下学期月考化学试题
湖北
高二
阶段练习
2020-10-25
280次
整体难度:
适中
考查范围:
化学与STSE、物质结构与性质、化学反应原理、化学实验基础
湖北省武汉市江夏区金口中学2019-2020学年沆二下学期月考化学试题
湖北
高二
阶段练习
2020-10-25
280次
整体难度:
适中
考查范围:
化学与STSE、物质结构与性质、化学反应原理、化学实验基础
一、单选题 添加题型下试题
单选题
|
较易(0.85)
名校
1. 下列分别是利用不同能源发电的实例,其中不属于新能源开发利用的是( )
A. 风力发电 风力发电 | B. 太阳能发电 太阳能发电 |
C. 火力发电 火力发电 | D. 潮汐能发电 潮汐能发电 |
【知识点】 能源开发利用新理念
您最近一年使用:0次
2012-06-30更新
|
2124次组卷
|
36卷引用:2011-2012年湖南衡阳七校高二上学期期末质量检测化学试卷
(已下线)2011-2012年湖南衡阳七校高二上学期期末质量检测化学试卷2015-2016学年辽宁省沈阳二中高一下期中理综化学试卷2016-2017学年湖北沙市中学高二上第一次双周练化学卷2016-2017学年河南省新乡市延津县中学高二上第一次月考化学卷2018届高三一轮复习化学:微考点47-能源开发与节能减排湖北省监利县实验高中2017-2018学年高二上学期期中考试化学试题甘肃省兰州市第四中学2017-2018学年高二上学期期末考试化学试题陕西省西安中学2017-2018学年高一下学期期末考试(理)化学试题河南省安阳市第三十六中学2018-2019学年高二上学期第一次月考化学试题海南省东方市八所中学2019-2020学年高二上学期第一次月考化学试题辽宁省建平第二高级中学2019-2020学年高二上学期9月月考化学试题云南省玉溪市玉溪一中2019-2020学年高二上学期第一次月考化学试题广东省深圳市第二实验学校2019-2020学年高二上学期期中考试化学试题河南省南阳市2017-2018学年高二上学期期末考试化学试题四川省攀枝花市第十五中学2019-2020学年高二上学期第二次月考化学试题海南省三亚华侨学校2019-2020学年高二上学期期末考试化学试题宁夏回族自治区石嘴山市第三中学2019-2020学年高二下学期期末考试化学试题河北省保定市涞水波峰中学2019-2020学年高一下学期第三次质检考试化学试题(已下线)1.1.3 反应焓变的计算 练习——【高中新教材同步备课】鲁科版高中化学选择性必修1(已下线)第一章 化学反应与能量(基础过关)-2020-2021学年高二化学单元测试定心卷(人教版选修4)甘肃省天水一中2020-2021学年高二上学期第一学段考试化学试题湖北省武汉市江夏区金口中学2019-2020学年沆二下学期月考化学试题福建省平潭县新世纪学校2020-2021学年高二上学期第一次月考化学试题(选考)湖北省黄石市育英高中2020-2021学年高二上学期第一次月考化学试题河北省唐山市第十一中学2020-2021学年高二上学期期中考试化学试题广东省佛山市第一中学2020-2021学年高二上学期第一次段考化学(选考)试题四川省成都市金堂县竹篙中学2020-2021学年高二10月月考化学试题甘肃省武威市民勤县第四中学2020-2021学年高二上学期期末考试(普通班)化学试题甘肃省武威市民勤县第四中学2020-2021学年高二上学期期末考试(实验班)化学试题云南省新平县一中2020-2021学年高二下学期期中考试化学试题(已下线)第1章 化学反应与能量(提分小卷)-【单元测试】2021-2022学年高二化学尖子生选拔卷(人教版选修4)甘肃省靖远县二中2021-2022学年高二上学期第一次月考化学试题辽宁省葫芦岛市协作校2021-2022学年高二上学期第二次考试化学试题(已下线)1.1.2 反应热(二)-同步学习必备知识贵州省黔东南州凯里市第一中学2022-2023学年高二上学期期中考试化学试题福建省莆田第一中学2022-2023学年高二上学期第一学段考试化学试题
单选题
|
较易(0.85)
名校
2. 13CNMR(核磁共振)、15NNMR可用于测定蛋白质、核酸等生物大分子的空间结构,KurtWuithrich等人为此获得2002年诺贝尔化学奖。下面有关13C、15N的叙述正确的是( )
| A.13C与15N有相同的中子数 |
| B.13C电子排布式为1s22s22p2 |
| C.15N与14N互为同素异形体 |
| D.15N的电子排布式为1s22s22p4 |
您最近一年使用:0次
2020-10-20更新
|
128次组卷
|
2卷引用:湖北省武汉市江夏区金口中学2019-2020学年沆二下学期月考化学试题
单选题
|
适中(0.65)
3. 下列说法正确的是( )
| A.元素周期表中金属与非金属分界线附近的元素既具有金属性也具有非金属性,所以属于过渡元素 |
| B.第ⅠA族元素的金属性不一定比第ⅡA族元素的金属性强 |
| C.若M+和R2-的核外电子层结构相同,则原子序数:R>M |
| D.等物质的量的C2H6和H2O2含电子数相同 |
您最近一年使用:0次
单选题
|
适中(0.65)
4. 下表所列有关晶体的说法中,有错误的是( )
| 选项 | A | B | C | D |
| 晶体名称 | 碘化钾 | 铜 | 金刚石 | 二氧化硅 |
| 组成晶体微粒名称 | 阴、阳离子 | 金属阳离子,自由电子 | 原子 | 分子 |
| 晶体内存在的作用力 | 离子键 | 金属键 | 共价键 | 范德华力,共价键 |
| A.A | B.B | C.C | D.D |
【知识点】 化学键类别与晶体类别间的关系解读
您最近一年使用:0次
2020-10-20更新
|
140次组卷
|
2卷引用:湖北省武汉市江夏区金口中学2019-2020学年沆二下学期月考化学试题
单选题
|
较易(0.85)
5. 下列分子中,各分子的立体构型和中心原子的杂化方式均正确的是( )
| A.NH3平面三角形sp3杂化 | B.CCl4正四面体sp2杂化 |
| C.H2OV形sp3杂化 | D.CO 三角锥形sp3杂化 三角锥形sp3杂化 |
【知识点】 价层电子对互斥理论的应用解读 杂化轨道理论理解解读
您最近一年使用:0次
单选题
|
较易(0.85)
名校
6. 下列配合物的水溶液中加入硝酸银不能生成沉淀的是
| A.[Co(NH3)4Cl2]Cl | B.[Co(NH3)6]Cl3 |
| C.[Cu(NH3)4]Cl2 | D.[Co(NH3)3Cl3] |
您最近一年使用:0次
2019-01-25更新
|
757次组卷
|
19卷引用:2012-2013学年福建省长泰县第二中学高二下学期第二次月考化学试卷
(已下线)2012-2013学年福建省长泰县第二中学高二下学期第二次月考化学试卷(已下线)2014年高二鲁科版选修3化学规范训练2.3离子键配位键与金属键练习卷2015-2016学年宁夏六盘山高中高二下学期期中化学试卷2015-2016学年广东省肇庆市高二下期末化学试卷河北省唐山一中2017-2018学年高二下学期期中考试化学试题黑龙江省牡丹江市第三高级中学2018-2019学年高二上学期期末考试化学试题山西省阳泉市第二中学2018-2019学年高二下学期期中考试化学试题新疆石河子第二中学2018-2019学年高二下学期期末考试化学试题新疆阿勒泰地区第二高级中学2018-2019学年高二下学期期末(A卷)化学试题宁夏银川市银川二中2019-2020学年高二上学期第一次月考化学试题山东省滕州市第一中学2019-2020学年高二下学期第二次月考化学试题海南省三亚华侨学校2019-2020学年高二上学期期末考试化学试题内蒙古自治区包头市北方重工业集团有限公司第三中学2019-2020学年高二下学期期中考试化学试题湖北省武汉市江夏区金口中学2019-2020学年沆二下学期月考化学试题河北省张家口宣化一中2020-2021学年高二下学期4月月考化学试题专题4 分子空间结构与物质性质 第二单元 配合物的形成和应用 第2课时 配合物的应用第四节 配合物与超分子4.2.1配合物的形成和应用 课中2.3离子键、配位键与金属键(课后)-鲁科版选择性必修2
单选题
|
容易(0.94)
名校
解题方法
7. 下列化学反应中,同时存在离子键、极性键、非极性键的断裂与生成的是
| A.2Na2O2+2H2O=4NaOH+O2↑ | B.Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑ |
| C.Cl2+H2O=HClO+HCl | D.NH4Cl+NaOH=NaCl+NH3↑+H2O |
【知识点】 离子键 共价键 共价键与离子键的比较解读 化学键与物质类别关系的判断解读
您最近一年使用:0次
2020-03-06更新
|
466次组卷
|
24卷引用:2010—2011学年湖北省武穴中学高二3月月考化学试卷
(已下线)2010—2011学年湖北省武穴中学高二3月月考化学试卷(已下线)2012-2013学年河北省石家庄市高一下学期期末考试化学试卷2014-2015学年福建省永春美岭中学高二下学期期中考试化学试卷2016届安徽省安庆市第二中学高三上学期第一次质检化学试卷2015-2016学年福建省漳州市芗城中学高二下期中理科化学试卷云南省曲靖市宣威市第三中学2017-2018学年高二下学期3月月考化学试题【全国百强校】广东省中山市第一中学2017-2018学年高二下学期第二次段考化学试题云南省河口县一中2018-2019学年高二上学期期中考试化学试题云南省武定县第一中学2018-2019学年高二上学期12月份考试化学试题江西省赣州市十五县(市)2018-2019学年高一下学期期中联考化学试题云南省玉溪市江川二中2019-2020学年高二上学期期中考试化学试题宁夏石嘴山市第三中学2019-2020学年高二上学期期末考试化学试题宁夏回族自治区吴忠市吴忠中学2020年高二化学人教版选修3第二章《分子结构与性质》单元测试福建省永安市第三中学2019-2020学年高二下学期期中考试化学试题四川省广元市2019-2020学年高一下学期期末教学质量监测化学试题(已下线)专题10 化学键(核心精讲)——【新教材精创】2019-2020学年高中化学新教材知识讲学湖北省武汉市江夏区金口中学2019-2020学年沆二下学期月考化学试题(已下线)第2章 微粒间相互作用与物质性质(基础过关)-2020-2021学年高二化学单元测试定心卷(鲁科版2019选择性必修2)新疆维吾尔自治区新源县第二中学2019-2020学年高二上学期第一次阶段测试化学试题福建省福州高级中学2020-2021学年高二下学期期中考试化学试题甘肃省民乐县第一中学2020-2021学年高一下学期期中考试化学试题甘肃省兰州二十七中学2020-2021学年高二下学期期中考试化学试题云南省弥勒市第一中学2021-2022学年高二上学期第二次月考化学试题(已下线)BBWYhjhx1010.pdf
单选题
|
适中(0.65)
名校
8. 下列关于晶体的说法中,不正确的是( )
①含有离子的晶体一定是离子晶体
②分子晶体若是密堆积方式,其配位数都是12
③晶胞是晶体结构的基本单元
④共价键的强弱决定分子晶体熔沸点的高低
⑤MgO远比NaCl的晶格能大
⑥含有共价键的晶体一定是原子晶体
⑦分子晶体的熔点一定比金属晶体低
⑧NaCl晶体中,阴、阳离子的配位数都为6
①含有离子的晶体一定是离子晶体
②分子晶体若是密堆积方式,其配位数都是12
③晶胞是晶体结构的基本单元
④共价键的强弱决定分子晶体熔沸点的高低
⑤MgO远比NaCl的晶格能大
⑥含有共价键的晶体一定是原子晶体
⑦分子晶体的熔点一定比金属晶体低
⑧NaCl晶体中,阴、阳离子的配位数都为6
| A.①④⑥⑦ | B.②④⑥⑧ | C.③⑤⑦⑧ | D.③④⑥⑦ |
您最近一年使用:0次
2020-10-20更新
|
175次组卷
|
7卷引用:2016-2017学年河南省洛阳市第一高级中学高二(平行班)3月月考化学试卷
单选题
|
适中(0.65)
解题方法
9. 有关3—甲基—1—丁炔分子的说法正确的是( )
| A.12个σ键,2个π键 | B.11个σ键,3个π键 |
| C.11个σ键,2个π键 | D.12个σ键,3个π键 |
您最近一年使用:0次
单选题
|
适中(0.65)
名校
解题方法
10. 图中每条折线表示IVA~VIIA中的某一族元素氢化物的沸点变化,其中a点代表的是


| A.H2S | B.HCl | C.PH3 | D.SiH4 |
【知识点】 氢键对物质性质的影响解读
您最近一年使用:0次
2021-12-03更新
|
71次组卷
|
34卷引用:2011-2012学年吉林长春市十一高高一下学期期中考试化学试卷
(已下线)2011-2012学年吉林长春市十一高高一下学期期中考试化学试卷(已下线)2011-2012学年吉林省吉林一中高一下学期期中考试化学试卷2014-2015学年吉林省长春市十一中高一下期中化学试卷2016-2017学年湖南师范大学附属中学高一下学期第一次阶段性测试化学试卷湖南省衡阳市八中、澧县一中、鼎城中学等重点中学2016-2017学年高一下学期期末联考化学试题江西省抚州市临川区第一中学2017-2018学年高一下学期第一次月考化学试题上海市高二上学期第二章《初识元素周期律》综合测试题第4节 分子间作用力与物质性质——A学习区 夯实基础(鲁科版选修3)湖北省黄冈市黄梅县第一中学2019-2020学年高一下学期期中考试化学试题(已下线)专题5.3 化学键(讲)——2020年高考化学一轮复习讲练测吉林省通化市通化县综合高级中学2019-2020学年高二下学期期中考试化学试题(已下线)吉林省长春市实验中学2019-2020学年高一下学期期中考试化学试题吉林省长春市实验中学2019-2020学年高一下期中考试化学试题贵州省贵阳市第十四中学2019-2020学年高一下学期期末考试化学试题苏教版(2020)高一必修第一册专题5第二单元课时2 化学键 分子间作用力人教版(2019)高一必修第一册 第四章 第三节课时2 化学键 分子间作用力贵州省贵阳十四中2019-2020学年高一下学期期末考试化学试题湖北省武汉市江夏区金口中学2019-2020学年沆二下学期月考化学试题(人教版2019)选择性必修2 第二章 分子结构与性质 第三节 分子结构与物质的性质高二选择性必修2(人教版2019)第二章 分子结构与性质 第三节综合训练四川省巴中市平昌县驷马中学2020-2021学年高二上学期期末测试化学试题(已下线)2.4 分子间作用力-2020-2021学年高二化学课时同步练(鲁科2019选择性必修2) (已下线)2.3 分子的结构与物质的性质(A级基础练)-2020-2021学年高二化学章节分层检测ABC(人教版2019选择性必修2)广西桂林市第十八中学2020-2021学年高一下学期开学考试化学试题福建省建瓯市芝华中学2020-2021学年高二下学期第一阶段考试化学试题浙江省嘉兴市第五高级中学2018-2019学年高一下学期期中考试化学试题河北省衡水市武强中学2020-2021学年高二下学期第一次月考化学试题宁夏石嘴山市第三中学2021-2022学年高二上学期期中考试化学试题云南省玉溪市民族中学2021-2022学年高二上学期期末考试化学试题北京市第一五六中学 2021-2022学年高二下学期期中考试化学试题天津市第三中学2021-2022学年高二下学期期末质量检测化学试题云南省文山州一中2021-2022学年高一下学期3月份考试化学试题天津市红桥区2021-2022学年高二下学期期末考试化学试题广东省惠州市丰湖高级中学2022-2023学年高二下学期第一次段考化学试题
单选题
|
适中(0.65)
11. 下列有关物质性质的比较顺序中,不正确的是( )
| A.晶格能大小顺序:NaCl<NaF<CaO<MgO |
| B.酸性:HClO4>H2SO4>H3PO4>H2SiO3 |
| C.微粒半径:K+>Ca2+>Cl->S2- |
| D.热稳定性:HF>HCl>HBr>HI |
【知识点】 同周期元素性质递变规律 元素非金属性强弱的比较方法解读 晶格能解读
您最近一年使用:0次
单选题
|
适中(0.65)
名校
12. “打赢蓝天保卫战”,就意味着对污染防治提出更高要求。实验室中尝试对垃圾渗透液再利用,实现发电、环保二位一体,当该装置工作时,下列说法错误的是( )


| A.该装置实现了将化学能转化为电能 |
| B.盐桥中Cl-向A极移动 |
| C.工作时,B极区溶液pH减小 |
| D.电路中流过7.5mol电子时,共产生标况下44.8LN2 |
您最近一年使用:0次
2020-10-20更新
|
147次组卷
|
3卷引用:湖北省武汉市江夏区金口中学2019-2020学年沆二下学期月考化学试题
单选题
|
较难(0.4)
13. 下列说法正确的是( )
| A.在相同温度下,物质的量浓度相等的氨水、NaOH溶液,c(OH-)相等 |
| B.中和pH和体积均相等的盐酸、CH3COOH溶液,所需NaOH的物质的量CH3COOH多 |
| C.浓度和体积都相等的盐酸和醋酸溶液分别与足量的Zn完全反应,盐酸产生的H2多 |
| D.室温下pH=1的CH3COOH溶液和pH=13的NaOH溶液中,c(CH3COO-)小于c(Na+) |
您最近一年使用:0次
2020-10-20更新
|
556次组卷
|
3卷引用:湖北省武汉市江夏区金口中学2019-2020学年沆二下学期月考化学试题
湖北省武汉市江夏区金口中学2019-2020学年沆二下学期月考化学试题(已下线)第11单元 水溶液中的离子平衡(A卷 基础过关检测)-2021年高考化学一轮复习单元滚动双测卷湖南省常德市外国语学校2020-2021学年高二上学期第二次月考化学试题
单选题
|
适中(0.65)
14. 室温时,下列混合溶液的pH一定小于7的是( )
| A.pH=3的硝酸溶液和pH=11的氢氧化钾溶液等体积混合 |
| B.pH=3的醋酸和pH=11的氢氧化钾溶液等体积混合 |
| C.pH=3的硫酸溶液和pH=11的氨水等体积混合 |
| D.pH=3的盐酸和pH=11的氨水等体积混合 |
您最近一年使用:0次
单选题
|
适中(0.65)
名校
解题方法
15. 水的电离平衡曲线如图所示,下列说法正确的是


| A.图中五点KW间的关系:B>C>A>D=E |
| B.若从A点到D点,可采用在水中加入少量NaOH的方法 |
| C.若从A点到C点,可采用温度不变时在水中加入适量H2SO4的方法 |
| D.若处在B点时,将pH=2的硫酸与pH=12的KOH等体积混合后,溶液显碱性 |
您最近一年使用:0次
2020-10-20更新
|
535次组卷
|
4卷引用:湖北省武汉市江夏区金口中学2019-2020学年沆二下学期月考化学试题
湖北省武汉市江夏区金口中学2019-2020学年沆二下学期月考化学试题(已下线)第11单元 水溶液中的离子平衡(A卷 基础过关检测)-2021年高考化学一轮复习单元滚动双测卷广东省台山市华侨中学2020-2021学年高二上学期期中考试化学试题(已下线)第31练 水的电离和溶液的pH-2023年高考化学一轮复习小题多维练(全国通用)
单选题
|
适中(0.65)
16. 如图,a、b、d均为石墨电极,c为Mg电极,通电进行电解(电解液足量),下列说法不正确的是( )


| A.向甲中加入适量CuO,溶液组成可以恢复 |
| B.电解一段时间,乙溶液中会产生白色沉淀 |
| C.当b极增重3.2g时,d极产生的气体体积为标况下1.12L |
| D.甲中b极上的电极反应式为:4OH--4e-=O2↑+2H2O |
您最近一年使用:0次
二、解答题 添加题型下试题
解答题-结构与性质
|
适中(0.65)
解题方法
17. 钯(Pd)、锌及其化合物在合成酮类物质中有极其重要的作用,如图为合成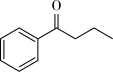 的反应过程:
的反应过程:
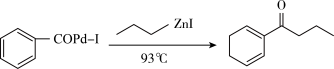
回答下列问题:
(1)O原子价电子排布图为___ ,其能量最高的能级是__ (填能层符号)。
(2)N、C、O三种元素的第一电离能由大到小的顺序为__ 。
(3) 中碳原子的杂化方式为
中碳原子的杂化方式为__ 。
(4)ZnCl2溶液中加入足量氨水,发生的反应为ZnCl2+4NH3·H2O=[Zn(NH3)4]Cl2+4H2O。
①上述反应涉及的物质中,固态时属于分子晶体的是__ 。
②NH3的空间构型为__ 。
③1mol[Zn(NH3)4]Cl2中含有__ 个σ键。
(5)Zn和Cu可形成金属互化物(ZnCu),该金属互化物中所有金属原子均按面心立方最密堆积,若所有Cu均位于晶胞的面心,则Zn位于晶胞的___ 。
(6)金属钯的堆积方式如图所示:

①该晶胞中原子的空间利用率为___ (用含π的式子表示)。
②若该晶胞参数a=638pm,则该晶胞密度为___ (列出计算表达式)g·cm-3。
 的反应过程:
的反应过程:
回答下列问题:
(1)O原子价电子排布图为
(2)N、C、O三种元素的第一电离能由大到小的顺序为
(3)
 中碳原子的杂化方式为
中碳原子的杂化方式为(4)ZnCl2溶液中加入足量氨水,发生的反应为ZnCl2+4NH3·H2O=[Zn(NH3)4]Cl2+4H2O。
①上述反应涉及的物质中,固态时属于分子晶体的是
②NH3的空间构型为
③1mol[Zn(NH3)4]Cl2中含有
(5)Zn和Cu可形成金属互化物(ZnCu),该金属互化物中所有金属原子均按面心立方最密堆积,若所有Cu均位于晶胞的面心,则Zn位于晶胞的
(6)金属钯的堆积方式如图所示:

①该晶胞中原子的空间利用率为
②若该晶胞参数a=638pm,则该晶胞密度为
您最近一年使用:0次
解答题-无机推断题
|
适中(0.65)
解题方法
18. A、B、W、D、E为短周期元素,且原子序数依次增大,五种元素核内质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等。
(1)A2W2的电子式为___ 。
(2)W中质子数和中子数相等的核素符号为__ ,D元素在周期表中的位置为___ 。
(3)A、B、W三种元素的电负性小到大的顺序为__ (填元素符号)。
(4)在一定条件下,D元素的单质能与A元素的单质化合生成DA,DA能与水反应放氢气,则其化学方程式为___ ,若将1.5molDA和1.5molE单质混合加入足量的水,充分反应后生成气体___ mol。
(5)若要比较D和E的金属性强弱,下列实验方法可行的是__ 。
a.将D单质置于E的盐溶液中,若单质D不能置换出单质E,说明D的金属性弱
b.将少量D、E的单质分别投入到水中,若D反应而E不反应,说明D的金属性强
c.比较相同条件下D和E的最高价氧化物对应水化物的溶解性若前者比后者溶解度大,说明D的金属性强
(1)A2W2的电子式为
(2)W中质子数和中子数相等的核素符号为
(3)A、B、W三种元素的电负性小到大的顺序为
(4)在一定条件下,D元素的单质能与A元素的单质化合生成DA,DA能与水反应放氢气,则其化学方程式为
(5)若要比较D和E的金属性强弱,下列实验方法可行的是
a.将D单质置于E的盐溶液中,若单质D不能置换出单质E,说明D的金属性弱
b.将少量D、E的单质分别投入到水中,若D反应而E不反应,说明D的金属性强
c.比较相同条件下D和E的最高价氧化物对应水化物的溶解性若前者比后者溶解度大,说明D的金属性强
您最近一年使用:0次
解答题-工业流程题
|
适中(0.65)
19. 某科研小组利用工业废料(主要成分NiO,含有少量Al2O3、FeO、CuO、BaO)回收NiO,并制备其他部分产品的工艺流程如图:

已知:①溶液中离子浓度小于等于1.0×10-5mol·L-1时,认为该离子沉淀完全。
②25℃时,部分难溶物的溶度积常数如表所示:
请回答下列问题:
(1)NaClO的电子式为___ 。
(2)“酸浸”时,Ni的浸出率与温度的关系如图所示。温度高于70℃,Ni的浸出率降低的主要原因为___ 。

(3)“沉淀1”的主要成分为___ (填化学式)。
(4)“滤液1”中通入H2S的作用为___ 。
(5)“转化”过程中,发生反应的主要离子方程式为___ 。
(6)25℃时,“调节pH2”使沉淀3中金属阳离子沉淀完全后,所得溶液中的c(H+)最大为__ (保留三位有效数字,已知 ≈1.4)。
≈1.4)。
(7)“操作I”主要包括蒸发浓缩、___ 、过滤、洗涤、干燥。
(8)NiO可通过铝热反应冶炼Ni,该反应的化学方程式为___ 。

已知:①溶液中离子浓度小于等于1.0×10-5mol·L-1时,认为该离子沉淀完全。
②25℃时,部分难溶物的溶度积常数如表所示:
| 难溶物 | CuS | Al(OH)3 | Ni(OH)2 | Fe(OH)3 | Fe(OH)2 |
| 溶度积常数(Ksp) | 6.3×10-36 | 1.3×10-33 | 2.0×10-15 | 4.0×10-38 | 1.8×10-16 |
(1)NaClO的电子式为
(2)“酸浸”时,Ni的浸出率与温度的关系如图所示。温度高于70℃,Ni的浸出率降低的主要原因为

(3)“沉淀1”的主要成分为
(4)“滤液1”中通入H2S的作用为
(5)“转化”过程中,发生反应的主要离子方程式为
(6)25℃时,“调节pH2”使沉淀3中金属阳离子沉淀完全后,所得溶液中的c(H+)最大为
 ≈1.4)。
≈1.4)。(7)“操作I”主要包括蒸发浓缩、
(8)NiO可通过铝热反应冶炼Ni,该反应的化学方程式为
您最近一年使用:0次
2020-10-20更新
|
235次组卷
|
2卷引用:湖北省武汉市江夏区金口中学2019-2020学年沆二下学期月考化学试题
解答题-原理综合题
|
适中(0.65)
解题方法
20. 现有反应:
A.CaCO3 CaO+CO2↑
CaO+CO2↑
B.Zn+H2SO4=ZnSO4+H2↑
C.C+CO2 2CO
2CO
D.2KOH+H2SO4=K2SO4+2H2O
(1)上述四个反应过程中能量变化符合如图的是__ (填反应序号)。

(2)在常温下,上述四个反应中可用于设计原电池的是___ (填反应序号),根据该原电池回答下列问题:
①正极材料是___ ,正极发生___ (填“氧化”或“还原”)反应;负极反应式为___ 。
②当导线中有2mol电子通过时,理论上发生的变化是___ (填序号)。
a.溶液增重63g b.溶液增重31.5g c.析出1gH2 d.析出11.2LH2
(3)对于反应B,将足量且等量的形状相同的锌块分别加入到等浓度等体积的两份稀硫酸X、Y中,同时向X中加入少量饱和CuSO4溶液,发生反应生成氢气的体积(V)与时间(t)的关系如图所示。

①n曲线表示锌与稀硫酸___ (填“X”或“Y”)反应。
②锌分别与稀硫酸X、Y反应时,反应速率不同的原因是___ (填序号)。
a.CuSO4作催化剂
b.加入硫酸铜溶液增大了c(SO )
)
c.Zn首先与Cu2+反应,生成的Cu与Zn、稀硫酸构成原电池
d.加入硫酸铜溶液增大了溶液体积
(4)理论上讲,任何自发的氧化还原反应都可以设计成原电池。请利用反应2H2+O2=2H2O设制一个化学电池(材料均用碳棒),回答下列问题:

该电池的b极是___ ,(填正极或负极),若电解质溶液是稀硫酸,则SO 移向
移向__ 极,(填a或b),写出a极上的电极反应式__ 。
A.CaCO3
 CaO+CO2↑
CaO+CO2↑B.Zn+H2SO4=ZnSO4+H2↑
C.C+CO2
 2CO
2COD.2KOH+H2SO4=K2SO4+2H2O
(1)上述四个反应过程中能量变化符合如图的是

(2)在常温下,上述四个反应中可用于设计原电池的是
①正极材料是
②当导线中有2mol电子通过时,理论上发生的变化是
a.溶液增重63g b.溶液增重31.5g c.析出1gH2 d.析出11.2LH2
(3)对于反应B,将足量且等量的形状相同的锌块分别加入到等浓度等体积的两份稀硫酸X、Y中,同时向X中加入少量饱和CuSO4溶液,发生反应生成氢气的体积(V)与时间(t)的关系如图所示。

①n曲线表示锌与稀硫酸
②锌分别与稀硫酸X、Y反应时,反应速率不同的原因是
a.CuSO4作催化剂
b.加入硫酸铜溶液增大了c(SO
 )
)c.Zn首先与Cu2+反应,生成的Cu与Zn、稀硫酸构成原电池
d.加入硫酸铜溶液增大了溶液体积
(4)理论上讲,任何自发的氧化还原反应都可以设计成原电池。请利用反应2H2+O2=2H2O设制一个化学电池(材料均用碳棒),回答下列问题:

该电池的b极是
 移向
移向【知识点】 吸热反应和放热反应解读 原电池原理的应用 原电池电极反应式书写解读
您最近一年使用:0次
试卷分析
整体难度:适中
考查范围:化学与STSE、物质结构与性质、化学反应原理、化学实验基础
试卷题型(共 20题)
题型
数量
单选题
16
解答题
4
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.85 | 能源开发利用新理念 | |
| 2 | 0.85 | 原子中相关数值及其之间的相互关系 元素、核素、同位素 电子排布式 | |
| 3 | 0.65 | 元素周期表结构 元素周期律的应用 | |
| 4 | 0.65 | 化学键类别与晶体类别间的关系 | |
| 5 | 0.85 | 价层电子对互斥理论的应用 杂化轨道理论理解 | |
| 6 | 0.85 | 配合物的结构与性质 | |
| 7 | 0.94 | 离子键 共价键 共价键与离子键的比较 化学键与物质类别关系的判断 | |
| 8 | 0.65 | 晶胞概念及判断 常见分子晶体的结构 晶格能 常见离子晶体的结构 | |
| 9 | 0.65 | 化学键概念理解及判断 共价键的实质与形成 物质结构中化学键数目的计算 | |
| 10 | 0.65 | 氢键对物质性质的影响 | |
| 11 | 0.65 | 同周期元素性质递变规律 元素非金属性强弱的比较方法 晶格能 | |
| 12 | 0.65 | 原电池原理 原电池有关计算 | |
| 13 | 0.4 | 弱电解质电离平衡的影响因素 弱电解质在水溶液中的电离平衡 | |
| 14 | 0.65 | 酸与酸或碱与碱混合后pH的计算 一元强酸与一元弱酸的比较 | |
| 15 | 0.65 | 水的离子积常数 影响水电离的因素 | |
| 16 | 0.65 | 电解后溶液的复原 电解池电极反应式及化学方程式的书写与判断 电解池有关计算 利用电子守恒法进行多池串联相关计算 | |
| 二、解答题 | |||
| 17 | 0.65 | 电离能变化规律 共价键的形成及主要类型 利用杂化轨道理论判断化学键杂化类型 晶胞的有关计算 | 结构与性质 |
| 18 | 0.65 | 元素金属性强弱的比较方法 根据原子结构进行元素种类推断 | 无机推断题 |
| 19 | 0.65 | 溶度积常数相关计算 物质分离、提纯综合应用 常见无机物的制备 | 工业流程题 |
| 20 | 0.65 | 吸热反应和放热反应 原电池原理的应用 原电池电极反应式书写 | 原理综合题 |



