2016届河南省商丘市高三下学期4月二模理综化学试卷
河南
高三
二模
2017-07-27
689次
整体难度:
适中
考查范围:
化学与STSE、有机化学基础、化学实验基础、常见无机物及其应用、物质结构与性质、化学反应原理、认识化学科学
2016届河南省商丘市高三下学期4月二模理综化学试卷
河南
高三
二模
2017-07-27
689次
整体难度:
适中
考查范围:
化学与STSE、有机化学基础、化学实验基础、常见无机物及其应用、物质结构与性质、化学反应原理、认识化学科学
一、单选题 添加题型下试题
单选题
|
适中(0.65)
1. 化学与社会、科学、技术、环保密切相关。下列有关说法不正确的是
| A.荧光蛋白是一种高分子化合物且能发生水解 |
| B.用纯碱溶液和盐酸可以清洗锅炉中的硫酸钙 |
| C.利用次氯酸钠溶液的碱性对餐具和环境消毒 |
| D.大量排放PM2.5、SO2、NOX等会形成雾霾 |
【知识点】 药物的合理使用解读 大气污染的治理原理及方法解读 高分子材料
您最近一年使用:0次
单选题
|
适中(0.65)
2. 下列设计的实验方案能达到实验目的的是
| A.检验蔗糖是否水解:蔗糖溶液在稀硫酸存在下水浴加热一段时间后,再与银氨溶液混合加热,观察现象 |
| B.检验溶液中是否含有NH4:取少量待检溶液,向其中加入浓NaOH溶液加热,再用湿润的红色石蕊试纸放置试管口,观察现象 |
| C.提纯含有少量苯酚的苯:向含有少量的苯酚的苯中加入过量的浓溴水,振荡后静置过滤,除去三溴苯酚沉淀 |
| D.探究化学反应的限度:取5ml 0.1mol/LKI溶液,滴加0.1mol/LFeCl3溶液5-6滴,充分反应,根据溶液中是否含有碘单质和碘离子判断该反应有一定限度 |
您最近一年使用:0次
单选题
|
较难(0.4)
3. 下列有关物质的同分异构体(不考虑立体异构)数目分、的分析中正确的是
| 选项 | A | B | C | D |
| 分子式 | C3H8O | C3H8 | C7H16 | C8H10 |
| 限定条件 | 能与钠反应 | 二氯化物 | 分子中还有3个甲基 | 芳香烃、能得到3种硝基化物 |
| 同分异构体数目 | 2 | 3 | 2 | 3 |
| A.A | B.B | C.C | D.D |
【知识点】 根据要求书写同分异构体解读 同分异构体的数目的确定解读
您最近一年使用:0次
单选题
|
较难(0.4)
名校
4. X、Y、Z、W四种物质在一定条件下具有如图所示的转化关系,下列判断正确的是
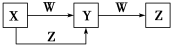

| A.若图中反应均为非氧化还原反应,当W为一元强碱时,则X可能是NaAlO2 |
| B.若图中反应均为非氧化还原反应,当W为一元强酸时,则X可能是NH3 |
| C.若图中反应均为氧化还原反应,当W为非金属单质时,则Z可能是CO2 |
| D.若图中反应均为氧化还原反应,当W为金属单质时,则Z可能是FeCl3 |
【知识点】 无机综合推断 铝三角转化解读 铁三角转化条件分析及判断解读
您最近一年使用:0次
2016-04-14更新
|
745次组卷
|
8卷引用:2015届江苏省扬州市高三上学期期末考试化学试卷
单选题
|
适中(0.65)
名校
5. 在元素周期表短周期元素中,X元素与Y、Z、W三元素相邻,X、Y的原子序数之和等于Z的原子序数,这四种元素原子的最外层电子数之和为20。下列判断一定正确的是
| A.单质熔点:Z>W |
| B.离子半径:X﹤Y |
| C.氧化物对应水化物的酸性:X>Z |
| D.X和Z可存在于同一离子化合物中 |
【知识点】 元素周期律、元素周期表的推断
您最近一年使用:0次
2016-12-09更新
|
167次组卷
|
4卷引用:2016届河南省商丘市高三下学期4月二模理综化学试卷
单选题
|
适中(0.65)
名校
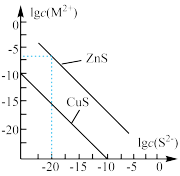
6.  时,用
时,用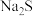 沉淀
沉淀 、
、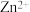 两种金属阳离子
两种金属阳离子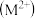 ,所需
,所需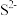 最低浓度的对数值
最低浓度的对数值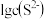 与
与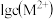 的关系如图所示.下列说法不正确的是
的关系如图所示.下列说法不正确的是
 时,用
时,用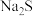 沉淀
沉淀 、
、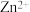 两种金属阳离子
两种金属阳离子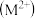 ,所需
,所需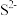 最低浓度的对数值
最低浓度的对数值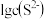 与
与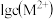 的关系如图所示.下列说法不正确的是
的关系如图所示.下列说法不正确的是

A.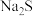 溶液中: 溶液中: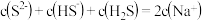 |
B. 时, 时,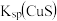 约为 约为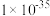 |
C.向100 mL 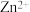 、 、 浓度均为 浓度均为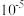  的混合溶液中逐滴加入 的混合溶液中逐滴加入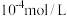 的 的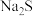 溶液, 溶液, 先沉淀 先沉淀 |
D.向 浓度为 浓度为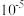  的工业废水中加入ZnS 粉末,会有CuS 沉淀析出 的工业废水中加入ZnS 粉末,会有CuS 沉淀析出 |
【知识点】 难溶电解质的溶解平衡 沉淀溶解平衡的应用 沉淀的溶解与生成解读
您最近一年使用:0次
2020-01-27更新
|
256次组卷
|
7卷引用:2016届河南省商丘市高三下学期4月二模理综化学试卷
单选题
|
较难(0.4)
名校
7. 电浮选凝聚法是工业上采用的一种污水处理方法,即保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3胶体,Fe(OH)3胶体具有吸附作用,可吸附水中的污物而使其沉淀下来,起到净水的作用,其原理如图所示。下列说法正确的是
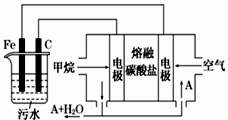
| A.石墨电极上发生氧化反应 |
| B.根据图示,物质A为CO2 |
| C.为增强污水的导电能力,可向污水中加入适量乙醇 |
| D.甲烷燃料电池中CO32-向空气一极移动 |
您最近一年使用:0次
2016-05-11更新
|
1078次组卷
|
16卷引用:2016届广东省华南师大附中等四校高三上期末联考理综化学试卷
2016届广东省华南师大附中等四校高三上期末联考理综化学试卷2016届河南省商丘市高三下学期4月二模理综化学试卷2016届福建省漳州八校高三下学期第三次联考理科综合化学试卷2016届江西省上高县二中高三4月半月考二理综化学试卷2016届甘肃省张掖市高三下学期第三次诊断考试理综化学试卷2016届山西省祁县中学高三5月月考理综化学试卷2017届广东省韶关市六校高三上10月联考化学试卷广东省潮州市2017届高三第二次模拟考试理科综合化学试题黑龙江省哈尔滨市第六中学2018届高三9月阶段检测化学试题鄱阳一中2017-2018学年度上学期高二年级第二次检测化学试卷(已下线)解密09 电化学(教师版)——备战2018年高考化学之高频考点解密【市级联考】湖南省怀化市2019届高三上学期期中新博览联考化学试题江西省师范大学附属中学2019届高三上学期期末考试化学试题福建省仙游第一中学、福州八中2020届高三上学期第三次质检(期中)考试化学试题湖南省浏阳一中、株洲二中等湘东七校2020届高三12月联考化学试题备考突破2020高三化学专题强化集训——原电池的理解和应用
二、解答题 添加题型下试题
解答题-实验探究题
|
适中(0.65)
8. 亚氯酸钠(NaClO2)是一种高效氧化剂、漂白剂。已知:NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2·3H2O,高于38℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。某化学探究小组开展如下图所示实验制取NaClO2晶体并测定其纯度。回答下列问题
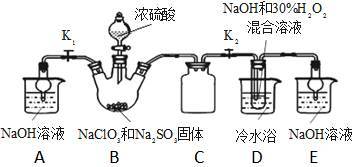
(1)用50%双氧水配置30%的H2O2溶液,需要的玻璃仪器除玻璃棒、胶头滴管、烧杯外,还需要_____________ (填仪器名称);右下图装置C的作用是_____________ 。
(2)装置D中反应生成NaClO2的化学方程式为_____________ 。反应后溶液中阴离子除ClO2、ClO3、Cl、ClO、OH外还可能含有一种阴离子是_____________ ,检验该离子的方法是_____________ 。产生该离子最可能的的原因是_________ 。
a.B中有SO2气体产生,并有部分进入D装置内
b.B中浓硫酸挥发进入D中与NaOH中和
c.B中的硫酸进入到D装置内
(3)请补充从反应后的溶液中获得NaClO2晶体的操作步骤:①减压,55℃蒸发结晶;②趁热过滤;③______ ;④_________ ;得到成品。
(4)如果撤去D中的冷水浴,可能导致产品中混有的杂质是____________ 。
(5)测定样品中NaClO2的纯度:准确称一定质量的样品,加入适量蒸馏水和过量KI晶体,在酸性条件下发生反应:ClO2-+ 4I-+4H+ =2H2O+2I2+Cl-。将所得混合液体稀释成100ml待测溶液。取25.00ml待测溶液,加入淀粉溶液做指示剂,用c mol·L-1NaS2O3标准液滴定至终点,测得消耗标准溶液体积的平均值为V ml(已知:I2+2S2O32-=2I-+S4O42-)
①确认滴定终点的现象是__________
②所称取的样品中NaClO2的物质的量为____________ (用含C、V的代数式表示)。

(1)用50%双氧水配置30%的H2O2溶液,需要的玻璃仪器除玻璃棒、胶头滴管、烧杯外,还需要
(2)装置D中反应生成NaClO2的化学方程式为
a.B中有SO2气体产生,并有部分进入D装置内
b.B中浓硫酸挥发进入D中与NaOH中和
c.B中的硫酸进入到D装置内
(3)请补充从反应后的溶液中获得NaClO2晶体的操作步骤:①减压,55℃蒸发结晶;②趁热过滤;③
(4)如果撤去D中的冷水浴,可能导致产品中混有的杂质是
(5)测定样品中NaClO2的纯度:准确称一定质量的样品,加入适量蒸馏水和过量KI晶体,在酸性条件下发生反应:ClO2-+ 4I-+4H+ =2H2O+2I2+Cl-。将所得混合液体稀释成100ml待测溶液。取25.00ml待测溶液,加入淀粉溶液做指示剂,用c mol·L-1NaS2O3标准液滴定至终点,测得消耗标准溶液体积的平均值为V ml(已知:I2+2S2O32-=2I-+S4O42-)
①确认滴定终点的现象是
②所称取的样品中NaClO2的物质的量为
您最近一年使用:0次
解答题-原理综合题
|
适中(0.65)
解题方法
9. 研究氮氧化物与悬浮在大气中的海盐粒子的相互作用时,设计如下反应:
I.2NO2(g)+NaCl(g) NaNO3(g)+ClNO(g) △H< 0 ,化学平衡常数为k1,
NaNO3(g)+ClNO(g) △H< 0 ,化学平衡常数为k1,
II. 2NO(g)+Cl2(g) 2ClNO(g) △H<0化学平衡常数为k2
2ClNO(g) △H<0化学平衡常数为k2
请回答下列问题:
(1)4NO2(g)+2NaCl(g) 2NaNO3(g)+2NO(g)+Cl2(g)的反应热△H=
2NaNO3(g)+2NO(g)+Cl2(g)的反应热△H=__________ (用△H1、△H2表示),化学平衡常数K=____________ (用k1、k2表示)
(2)若反应I在绝热密闭容器中进行,实验测得NO2(g)的转化率(NO2%)随时间变化如图所示,

t3--t1时刻NO2(g)的转化率(NO2%)降低的原因是_____________ 。
(3)若反应II在恒温、恒容条件下进行,下列能判断该反应一定达到平衡状态的是______
(4)在一定温度和压强下,反应II达到平衡,当NO和Cl2的比例不同时,对Cl2的比例不同时,对Cl2的转化率及平衡混合物中ClNO的体积分数都有影响。设NO和Cl2起始物质的量之比为x,平衡时Cl2的转化率为a,平衡混合物中ClNO的体积分数为y,y=________ 。(用a和x的代数式表示y)
(5)实验室用NaOH溶液吸收NO2,反应为:2NO2+2NaOH=NaNO3+NaNO2+H2O。含0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.1mol•L-1的CH3COONa溶液,则两溶液中c(NO3-)、c(NO2-)和c(CH3COOH)由大到小的顺序为___________________ 。(已知HNO2的电离常数Ka=7.1×10-4mol•L-1,CH3COOH的电离常数Ka=1.7×10-5mol•L-1)。常温下,向溶液B中加水稀释过程中,下列比值变化大的是_________ 。
a.c(H+)/c(OH-) b.c(OH-)/c(CH3COO-)
c.c(Na+)/c(CH3OO-) d.c(CH3OO-)·c(H+)/c(CH3COOH)
I.2NO2(g)+NaCl(g)
 NaNO3(g)+ClNO(g) △H< 0 ,化学平衡常数为k1,
NaNO3(g)+ClNO(g) △H< 0 ,化学平衡常数为k1,II. 2NO(g)+Cl2(g)
 2ClNO(g) △H<0化学平衡常数为k2
2ClNO(g) △H<0化学平衡常数为k2请回答下列问题:
(1)4NO2(g)+2NaCl(g)
 2NaNO3(g)+2NO(g)+Cl2(g)的反应热△H=
2NaNO3(g)+2NO(g)+Cl2(g)的反应热△H=(2)若反应I在绝热密闭容器中进行,实验测得NO2(g)的转化率(NO2%)随时间变化如图所示,

t3--t1时刻NO2(g)的转化率(NO2%)降低的原因是
(3)若反应II在恒温、恒容条件下进行,下列能判断该反应一定达到平衡状态的是
| A.容器内压强不再变化 |
| B.n(ClNO)=n(NO) |
| C.混合气体密度不变 |
| D.V正(NO)=V逆(ClNO) |
(5)实验室用NaOH溶液吸收NO2,反应为:2NO2+2NaOH=NaNO3+NaNO2+H2O。含0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.1mol•L-1的CH3COONa溶液,则两溶液中c(NO3-)、c(NO2-)和c(CH3COOH)由大到小的顺序为
a.c(H+)/c(OH-) b.c(OH-)/c(CH3COO-)
c.c(Na+)/c(CH3OO-) d.c(CH3OO-)·c(H+)/c(CH3COOH)
您最近一年使用:0次
解答题-工业流程题
|
适中(0.65)
解题方法
10. 利用水钴矿(主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等)制取草酸钴的工艺流程如下

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(1)浸出过程中加入Na2SO3的目的是_____________ 。
(2)制取NaClO3可以将氯气通入到热的浓氢氧化钠溶液,该反应的离子方程式为____________ ;实验需要制取10.65克NaClO3,需要的氯气由电解食盐水生成,若不考虑反应过程中的损失,则同时生成的氢气的体积为____________ (标准状况)。
(3)萃取剂对金属离子的萃取率与pH的关系如图所示。滤液Ⅱ中加入萃取剂的作用是_________ ;使用萃取剂适宜的pH是______ (填选项序号)。
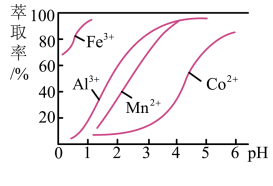
A.接近2.0 B.接近3.0 C.接近5.0
(4)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液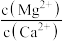 =
=________________ 。
(5)工业上用氨水吸收废气中的SO2。已知NH3·H2O的电离平衡常数K1 =1.8×10-5mol·L-1H2SO4的电离平衡常数K2=1.2×10-2mol·L-1,K3 =1.3×10-8mol·L-1。在通入废气的过程中:
①当恰好形成正盐时,溶液中离子浓度的大小关系为________________ 。
②当恰好形成酸式盐时,加入少量NaOH溶液,反应的离子方程式为_________________ 。

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(2)制取NaClO3可以将氯气通入到热的浓氢氧化钠溶液,该反应的离子方程式为
(3)萃取剂对金属离子的萃取率与pH的关系如图所示。滤液Ⅱ中加入萃取剂的作用是

A.接近2.0 B.接近3.0 C.接近5.0
(4)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液
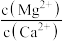 =
=(5)工业上用氨水吸收废气中的SO2。已知NH3·H2O的电离平衡常数K1 =1.8×10-5mol·L-1H2SO4的电离平衡常数K2=1.2×10-2mol·L-1,K3 =1.3×10-8mol·L-1。在通入废气的过程中:
①当恰好形成正盐时,溶液中离子浓度的大小关系为
②当恰好形成酸式盐时,加入少量NaOH溶液,反应的离子方程式为
您最近一年使用:0次
解答题-工业流程题
|
适中(0.65)
11. 纯碱是造纸、玻璃、纺织、制革等行业的重要原料。
(1)路布兰法制备纯碱:①食盐与硫酸反应生成硫酸钠;②将硫酸钠、石灰石和足量煤混合,高温下共熔制得碳酸钠,反应有硫化钙生成。第②步反应的化学方程式为_______________ 。
(2)索尔维制碱的主要工艺流程如下,石灰石用于制备二氧化碳和石灰乳

①原盐水中含少量Mg2+和Ca2+,结合生产实际,精制盐水需要的试剂是_____________ 、_________ 。(填化学式)
②步骤II保持在30-35℃进行,反应的化学方程式为____________ ,该反应能发生的原因是_____________ 。该工艺中循环利用的物质是_____________ 。
③索尔维制纯碱不需要用到的一种设备是______ (填正确答案标号)。
④该工艺中食盐利用率大约只有70%,食盐损失的主要原因是_____________ 。我国科学家侯德榜将合成氨工业得到的NH3和CO2引入纯碱的生产,向上述工艺的“母液”中通入NH3并加入食盐固体,降温结晶得到副产品__________ (填化学式),剩余母液返回“吸氨”步骤,大大提高了食盐的利用率。
(3)纯碱产品中可能含有碳酸氢钠。用热重分析的方法测定纯碱中碳酸氢钠的质量分数为ω(NaHCO3)=_______ (列出算式,所需数据用字母表示,并说明各字母的含义)。
(1)路布兰法制备纯碱:①食盐与硫酸反应生成硫酸钠;②将硫酸钠、石灰石和足量煤混合,高温下共熔制得碳酸钠,反应有硫化钙生成。第②步反应的化学方程式为
(2)索尔维制碱的主要工艺流程如下,石灰石用于制备二氧化碳和石灰乳

①原盐水中含少量Mg2+和Ca2+,结合生产实际,精制盐水需要的试剂是
②步骤II保持在30-35℃进行,反应的化学方程式为
③索尔维制纯碱不需要用到的一种设备是
| A.吸氨塔 | B.蒸氨塔 | C.碳酸化塔 | D.沸腾炉 | E.石灰窑 |
(3)纯碱产品中可能含有碳酸氢钠。用热重分析的方法测定纯碱中碳酸氢钠的质量分数为ω(NaHCO3)=
您最近一年使用:0次
解答题-结构与性质
|
适中(0.65)
解题方法
12. 钛、铬、铁、溴、铜等金属及其化合物在工业上有重要用途。
(1)制备CrO2Cl2的反应为:K2Cr2O2+3CCl4=2Kl+2CrO2Cl2+3COCl2↑。
①上述化学方程式中非金属元素电负性由大到小的顺序是__________ (用元素符号表示)。
②COCl2分子中所有原子均满足8电子构型,COCl2分子中σ键和π键的个数比为___________ ,中心原子的杂化方式为_____________ 。
(2)NiO、FeO的晶体结构均与氯化钠的晶体结构相同,其中Ni2+和Fe2+的离子半径分别为6.9×10-2nm和7.8×10-2nm。则熔点:NiO____________ FeO(填”<”、 “=”或 “>”)。
(3)Ni和La的合金晶细胞结构如图所示。
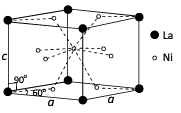
①该晶体的化学式为____________ 。
②已知该物质的摩尔质量M gmol-1,密度为d gcm-3.设Ni为阿伏加德罗常数 的值,则该晶胞的体积是____ cm3(用含M、d、Ni的代数式表示)。
(4)铜晶体中原子的堆积方式如右图所示。

①基态铜原子的电子排布式为________ 。
②每个铜原子周围距离最近的铜原子数目______________ 。
(5)某M原子的外围电子排布式为3S23p5,铜与M形成化合物的晶胞如附图所示(黑点代表铜原子,空心圆代表M原子)。
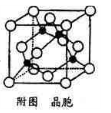
①该晶体的化学式为____________ 。
②已知铜和M电负性分别为1.9和3.0,则铜与M形成的化合物属于_____ (填“离子”或“共价”)化合物。
③已知该晶体的密度p gcm-3,阿伏加德罗常数的值为Na,则该晶体中铜原子与M原子之间的最短距离为_____ pm(只写计算式)。
(1)制备CrO2Cl2的反应为:K2Cr2O2+3CCl4=2Kl+2CrO2Cl2+3COCl2↑。
①上述化学方程式中非金属元素电负性由大到小的顺序是
②COCl2分子中所有原子均满足8电子构型,COCl2分子中σ键和π键的个数比为
(2)NiO、FeO的晶体结构均与氯化钠的晶体结构相同,其中Ni2+和Fe2+的离子半径分别为6.9×10-2nm和7.8×10-2nm。则熔点:NiO
(3)Ni和La的合金晶细胞结构如图所示。

①该晶体的化学式为
②已知该物质的摩尔质量M gmol-1,密度为d gcm-3.设Ni为阿伏加德罗常数 的值,则该晶胞的体积是
(4)铜晶体中原子的堆积方式如右图所示。

①基态铜原子的电子排布式为
②每个铜原子周围距离最近的铜原子数目
(5)某M原子的外围电子排布式为3S23p5,铜与M形成化合物的晶胞如附图所示(黑点代表铜原子,空心圆代表M原子)。

①该晶体的化学式为
②已知铜和M电负性分别为1.9和3.0,则铜与M形成的化合物属于
③已知该晶体的密度p gcm-3,阿伏加德罗常数的值为Na,则该晶体中铜原子与M原子之间的最短距离为
您最近一年使用:0次
解答题-有机推断题
|
适中(0.65)
名校
解题方法
13. 有机物G(分子式为C13H18O2)是一种香料,如图是该香料的一种合成路线。已知

①R-CH=CH2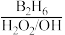 R-CH2CH2OH;
R-CH2CH2OH;
②有机物D的摩尔质量为88 g·mol-1,其核共振氢谱有3组峰;
③E能够发生银镜反应,1molE能够与2molH2完全反应生成F;
④有机物F是苯甲醇的同系物,苯环上只有一个无支链的侧链 回答下列问题:
(1)用系统命名法命名有机物B_____________ 。
(2)E的结构简式为_____________ 。
(3)C与新制Cu (OH)2反应的化学方程式为_____________ 。
(4)有机物C可与银氨溶液反应,配制银氨溶液的实验操作为_______________ 。
(5)已知有机物甲符合下列条件:①为芳香族化合物;②与F是同分异构体;③能被催化氧化成醛。符合上述条件的有机物甲有____________ 种。其中满足苯环上有3个侧链,且核磁共振氢谱有5组峰,峰面积比为6:2:2:1:1的有机物的结构简式为_____________ 。
(6)以丙烯等为原料合成D的路线如下:

X的结构简式为_____________ 。步骤Ⅱ的反应条件为___________ 。步骤Ⅳ的反应类型为____________ 。

①R-CH=CH2
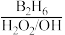 R-CH2CH2OH;
R-CH2CH2OH;②有机物D的摩尔质量为88 g·mol-1,其核共振氢谱有3组峰;
③E能够发生银镜反应,1molE能够与2molH2完全反应生成F;
④有机物F是苯甲醇的同系物,苯环上只有一个无支链的侧链 回答下列问题:
(1)用系统命名法命名有机物B
(2)E的结构简式为
(3)C与新制Cu (OH)2反应的化学方程式为
(4)有机物C可与银氨溶液反应,配制银氨溶液的实验操作为
(5)已知有机物甲符合下列条件:①为芳香族化合物;②与F是同分异构体;③能被催化氧化成醛。符合上述条件的有机物甲有
(6)以丙烯等为原料合成D的路线如下:

X的结构简式为
您最近一年使用:0次
2016-12-09更新
|
363次组卷
|
2卷引用:2016届河南省商丘市高三下学期4月二模理综化学试卷
试卷分析
整体难度:适中
考查范围:化学与STSE、有机化学基础、化学实验基础、常见无机物及其应用、物质结构与性质、化学反应原理、认识化学科学
试卷题型(共 13题)
题型
数量
单选题
7
解答题
6
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.65 | 药物的合理使用 大气污染的治理原理及方法 高分子材料 | |
| 2 | 0.65 | 蔗糖与麦芽糖 化学实验方案的设计与评价 物质性质实验方案的设计 综合实验设计与评价 | |
| 3 | 0.4 | 根据要求书写同分异构体 同分异构体的数目的确定 | |
| 4 | 0.4 | 无机综合推断 铝三角转化 铁三角转化条件分析及判断 | |
| 5 | 0.65 | 元素周期律、元素周期表的推断 | |
| 6 | 0.65 | 难溶电解质的溶解平衡 沉淀溶解平衡的应用 沉淀的溶解与生成 | |
| 7 | 0.4 | 烃燃料电池 电解原理的理解及判断 电解池电极反应式及化学方程式的书写与判断 | |
| 二、解答题 | |||
| 8 | 0.65 | 化学实验基础操作 常见无机物的制备 物质含量的测定 化学实验方案的设计与评价 | 实验探究题 |
| 9 | 0.65 | 化学平衡的移动及其影响因素 化学平衡常数 化学平衡的有关计算 盐溶液中离子浓度大小的比较 | 原理综合题 |
| 10 | 0.65 | 盐溶液中离子浓度大小的比较 溶度积常数相关计算 物质的分离、提纯 钴及钴的化合物 | 工业流程题 |
| 11 | 0.65 | 氧化还原反应方程式的配平 物质分离、提纯综合应用 物质含量的测定 纯碱的生产 | 工业流程题 |
| 12 | 0.65 | 物质结构与性质综合考查 基态核外电子排布规律 元素性质与电负性的关系 晶胞的有关计算 | 结构与性质 |
| 13 | 0.65 | 根据要求书写同分异构体 根据题给物质选择合适合成路线 有机推断综合考查 信息给予的有机合成 | 有机推断题 |



