湖北省武汉市武昌区2020届高三元月调研考试理综化学试题
湖北
高三
阶段练习
2020-01-27
489次
整体难度:
适中
考查范围:
化学与STSE、化学实验基础、认识化学科学、化学反应原理、物质结构与性质、常见无机物及其应用、有机化学基础
湖北省武汉市武昌区2020届高三元月调研考试理综化学试题
湖北
高三
阶段练习
2020-01-27
489次
整体难度:
适中
考查范围:
化学与STSE、化学实验基础、认识化学科学、化学反应原理、物质结构与性质、常见无机物及其应用、有机化学基础
一、单选题 添加题型下试题
单选题
|
适中(0.65)
名校
解题方法
1. 明代方以智的《物理小识》中有关炼铁的记载:“煤则各处产之,臭者烧熔而闭之成石,再凿而入炉曰礁,可五日不灭火,煎矿煮石,殊为省力。”下列说法中不正确的是( )
| A.文中说明以煤炭作为燃料已经是很普遍的现象 |
| B.《物理小识》中记载的是以焦炭作为还原剂的方法来炼铁 |
| C.生铁是指含碳量很低的铁合金 |
| D.铁合金是钢铁冶炼和机械铸造行业必不可少的重要原料之一 |
您最近一年使用:0次
2020-01-20更新
|
262次组卷
|
4卷引用:湖北省武汉市武昌区2020届高三元月调研考试理综化学试题
湖北省武汉市武昌区2020届高三元月调研考试理综化学试题(已下线)2020届高三《新题速递·化学》2月第01期(考点01-06)山东省泰安市宁阳一中2021届高三上学期模块考试化学试题解题达人.化学选择题(2021全国卷)精编特训02
单选题
|
适中(0.65)
解题方法
2. 用下列装置或操作进行实验,能达到实验目的且操作正确的是( )
A. 制取NH3 制取NH3 | B. 制取少量CO2气体 制取少量CO2气体 |
C. 干燥SO2气体 干燥SO2气体 | D. 除去SO2中的少量HCl 除去SO2中的少量HCl |
【知识点】 常见气体的制备与收集解读 化学实验方案的设计与评价
您最近一年使用:0次
单选题
|
适中(0.65)
名校
3. 设NA为阿伏加 德罗常数的值。下列说法正确的是
| A.在标准状况下,2.24LCCl4中含C-Cl键数目为0.4NA |
| B.标准状况下,30g醋酸和葡萄糖的混合物中,碳原子的数目为NA |
| C.某密闭容器中有0.1molN2和0.3molH2,在一定条件下充分反应,转移电子的数目为0.6NA |
| D.常温下,pH=1的HCl溶液中,由水电离出的H+数目为10-13NA |
您最近一年使用:0次
2020-01-20更新
|
160次组卷
|
3卷引用:湖北省武汉市武昌区2020届高三元月调研考试理综化学试题
单选题
|
适中(0.65)
4. 根据下列实验操作和现象所得出的结论或解释正确的是( )
| 选项 | 实验操作和现象 | 结论 |
| A | 向5 mL 0.1 mol/L KI 溶液中加入0.1 mol/L de FeCl3溶液1 mL,振荡,用苯萃取2~3次后取下 层溶液滴加5滴KSCN溶液,出现血红色 | Fe3+与I-之间的反应是有 一定限度的 |
| B | 向NaCl、NaI的混合稀溶液中滴入硝酸银溶液, 有黄色沉淀生成 | Ksp(AgCl)>Ksp(AgI) |
| C | 向盛有Fe(NO3)2溶液的试管中滴加0.1 mol/L H2SO4溶液,试管口出现红棕色气体 | 溶液中 被Fe2+还原为 被Fe2+还原为NO2 |
| D | 将稀硝酸溶液加入过量的铁粉中,有难溶于水的 气体生成 | 该气体为H2 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
适中(0.65)
名校
5. 常温下,用0.10mol/LNaOH溶液分别滴定20.00mL浓度均为0.10mol/LCH3COOH溶液和HCN溶液所得滴定曲线如图[Ka(CH3COOH)>K(HCN)]。下列说法正确的是( )
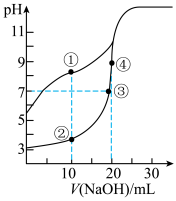

| A.点①和点②所示溶液中:c(CH3COO-)<c(CN-) |
| B.点③所示溶液中:c(Na+)=c(CH3COO-)=c(OH-)=c(H+) |
| C.点①和点②所示溶液中:c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH) |
| D.点③和点④所示溶液中都有:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+) |
【知识点】 酸碱中和滴定的综合考查解读
您最近一年使用:0次
2020-01-20更新
|
513次组卷
|
5卷引用:湖北省武汉市武昌区2020届高三元月调研考试理综化学试题
湖北省武汉市武昌区2020届高三元月调研考试理综化学试题(已下线)考点12 盐类水解及其应用-2020年高考化学命题预测与模拟试题分类精编河北省石家庄市辛集市第一中学2020-2021学年高二上学期第一次考试化学试题黑龙江省绥化市一中2020-2021学年度高二上学期第三次月考化学试题(已下线)选择题11-15
单选题
|
适中(0.65)
名校
解题方法
6. 将NO2、O2和熔融KNO3制成燃料电池,电解处理含Cr2O72-的废水。电解过程中发生反应:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。下列说法正确的是( )


| A.石墨Ⅱ是电池的负极 |
| B.若溶液中减少了0.01molCr2O72-,则电路中至少转移了0.12mol电子 |
| C.Fe(a)棒上发生的电极反应为:Fe-3e-=Fe3+ |
| D.在相同条件下,消耗的O2和NO2的体积比为4∶1 |
您最近一年使用:0次
2020-01-20更新
|
224次组卷
|
3卷引用:湖北省武汉市武昌区2020届高三元月调研考试理综化学试题
单选题
|
适中(0.65)
7. 甲~辛等元素在周期表中的相对位置如图所示。甲与戊的原子序数相差3,戊是空气中含量最多的元素,丁与辛是同周期元素。下列说法正确的是( )


| A.丙不能与水发生反应 |
| B.己和氯气反应的产物只有一种 |
| C.丙与庚的原子核外电子数相差13 |
| D.乙形成的氧化膜疏松,不能保护内层金属 |
您最近一年使用:0次
二、解答题 添加题型下试题
解答题-实验探究题
|
适中(0.65)
解题方法
8. 某化学实验小组拟探究改进Fe(OH)2的制取方法。
方案1:
①实验药品:FeS固体、稀硫酸溶液、NaHCO3溶液;
②实验装置如图1。

方案2:
①取一支试管,向其中加入一粒NaOH固体,再加入约2mL新制的FeSO4溶液;
②将试管置于酒精灯火焰上,对着有NaOH颗粒的部位小心加热(不能使液体剧烈沸腾)。使沉淀自下至上慢慢增多,观察下部沉淀颜色。
方案3:
①先在试管中滴入2~3 mL液体石蜡;
②用胶头滴管小心往试管底部注入4~5 mL新制的FeSO4溶液;
③再往试管中投入1粒绿豆大小的金属钠,观察反应现象。
回答下列问题:
(1)“方案1”中,后加入试管中的液体是______ ,NaOH溶液的作用是_______ 。
(2)“方案2”中,对着有NaOH颗粒的部位小心加热的目的是________ 。
(3)“方案2”的沉淀中,上层沉淀的颜色是________ ,下层沉淀的颜色是________ ,发生此现象的原因是________ 。
(4)“方案3”中反应的化学反应方程式为________ 。
(5)“方案3”的实验过程中间断性的出现白色沉淀,其原因是_________ 。
方案1:
①实验药品:FeS固体、稀硫酸溶液、NaHCO3溶液;
②实验装置如图1。

方案2:
①取一支试管,向其中加入一粒NaOH固体,再加入约2mL新制的FeSO4溶液;
②将试管置于酒精灯火焰上,对着有NaOH颗粒的部位小心加热(不能使液体剧烈沸腾)。使沉淀自下至上慢慢增多,观察下部沉淀颜色。
方案3:
①先在试管中滴入2~3 mL液体石蜡;
②用胶头滴管小心往试管底部注入4~5 mL新制的FeSO4溶液;
③再往试管中投入1粒绿豆大小的金属钠,观察反应现象。
回答下列问题:
(1)“方案1”中,后加入试管中的液体是
(2)“方案2”中,对着有NaOH颗粒的部位小心加热的目的是
(3)“方案2”的沉淀中,上层沉淀的颜色是
(4)“方案3”中反应的化学反应方程式为
(5)“方案3”的实验过程中间断性的出现白色沉淀,其原因是
您最近一年使用:0次
解答题-工业流程题
|
适中(0.65)
解题方法
9. 硫酸锌是一种重要的工业原料,广泛用于农业、化工、电镀等行业。工业上由锌渣(主要成分为ZnO、FeO、CuO、PbO等)等工业废料生产ZnSO4·7H2O的流程如下:

(1)“溶浸”操作中,选用“锌渣”而不选择氧化锌矿粉的原因是______ ;该操作中不断通入高温水蒸气的目的是________ 。
(2)“滤渣A”的主要成分是________ 。
(3)“反应Ⅰ”中,加入NaClO反应的离子方程式为___ 。
(4)“反应Ⅰ”中,再加入NaOH调节pH约为4.5,则“滤渣B”的主要成分是_____ (填化学式)。【Ksp[Zn(OH)2]=3×10-17,Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=2.8×10-39】
(5)“反应Ⅱ”中,加入的锌粉需用少量稀硫酸处理,原因是_________ 。
(6)取28.7gZnSO4·7H2O加热至不同温度,剩余固体的质量如下表:
则680℃时所得固体的化学式为_________ (填字母标号)。
A.ZnO B.Zn3O(SO4)2 C.ZnSO4 D.ZnSO4·H2O

(1)“溶浸”操作中,选用“锌渣”而不选择氧化锌矿粉的原因是
(2)“滤渣A”的主要成分是
(3)“反应Ⅰ”中,加入NaClO反应的离子方程式为
(4)“反应Ⅰ”中,再加入NaOH调节pH约为4.5,则“滤渣B”的主要成分是
(5)“反应Ⅱ”中,加入的锌粉需用少量稀硫酸处理,原因是
(6)取28.7gZnSO4·7H2O加热至不同温度,剩余固体的质量如下表:
| 温度/℃ | 100 | 250 | 680 | 930 |
| 质量/g | 17.90 | 16.10 | 13.43 | 8.10 |
A.ZnO B.Zn3O(SO4)2 C.ZnSO4 D.ZnSO4·H2O
您最近一年使用:0次
2020-01-20更新
|
572次组卷
|
4卷引用:湖北省武汉市武昌区2020届高三元月调研考试理综化学试题
湖北省武汉市武昌区2020届高三元月调研考试理综化学试题(已下线)2020届高三《新题速递·化学》2月第01期(考点10-12)湖南省示范性高中江华一中2020年高考理科综测试化学试题(14)(已下线)专题二十化学工艺流程题解题策略
解答题-原理综合题
|
适中(0.65)
10. 金属钒(V)及其化合物有着广泛的用途。请回答下列问题:
(1)钒在溶液中的主要聚合状态与溶液的pH关系如图1所示。V2O 中V元素的化合价是
中V元素的化合价是________ ,溶液中VO 转化为V2O
转化为V2O 的离子方程式为
的离子方程式为________ 。
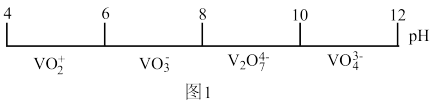
(2)偏钒酸铵是最普通的钒酸盐,将V2O5溶于碳酸钠溶液中(有气体生成),然后加入氯化铵,便可析出偏钒酸铵(NH4VO3),该过程总反应的化学方程式为________ ;当pH超过8.0时偏钒酸铵会发生转化,其原因是溶液中的VO 转化为V2O
转化为V2O 、
、________ (请另写出一点原因)。
(3)NH4VO3在高温下分解产生的V2O5可作为硫酸工业中2SO2(g)+O2(g)⇌2SO3(g) ΔH=pkJ/mol反应的催化剂,其催化原理如图2所示。
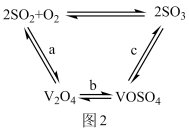
①过程a和过程b的热化学方程式为
V2O5(s)+SO2(g)=V2O4(s)+SO3(g) ΔH=qkJ/mol
V2O4(s)+O2(g)+2SO2(g)=2VOSO4(s) ΔH=rkJ/mol
则过程c的热化学方程式为_________ 。
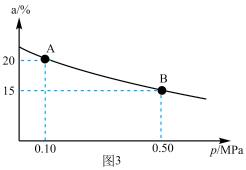
②T℃时反应2SO3(g)⇌2SO2(g)+O2(g) ΔH>0中SO3的转化率(α)与体系总压强(p)的关系如图3所示。T℃时,将2molSO3置于10L密闭容器中,反应达到平衡后,体系总压强为0.10MPa。则T℃时B点的化学平衡常数Kc=_________ 。
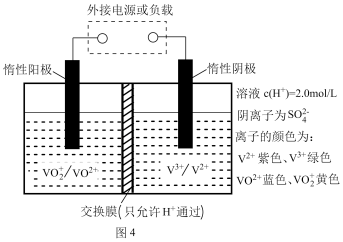
(4)全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如图4所示。
①充电过程中,右槽溶液颜色逐渐由________ 色变为________ 色;
②充电时若转移的电子数为NA个,则左槽溶液中n(H+)的变化量为______ 。
(1)钒在溶液中的主要聚合状态与溶液的pH关系如图1所示。V2O
 中V元素的化合价是
中V元素的化合价是 转化为V2O
转化为V2O 的离子方程式为
的离子方程式为
(2)偏钒酸铵是最普通的钒酸盐,将V2O5溶于碳酸钠溶液中(有气体生成),然后加入氯化铵,便可析出偏钒酸铵(NH4VO3),该过程总反应的化学方程式为
 转化为V2O
转化为V2O 、
、(3)NH4VO3在高温下分解产生的V2O5可作为硫酸工业中2SO2(g)+O2(g)⇌2SO3(g) ΔH=pkJ/mol反应的催化剂,其催化原理如图2所示。

①过程a和过程b的热化学方程式为
V2O5(s)+SO2(g)=V2O4(s)+SO3(g) ΔH=qkJ/mol
V2O4(s)+O2(g)+2SO2(g)=2VOSO4(s) ΔH=rkJ/mol
则过程c的热化学方程式为
②T℃时反应2SO3(g)⇌2SO2(g)+O2(g) ΔH>0中SO3的转化率(α)与体系总压强(p)的关系如图3所示。T℃时,将2molSO3置于10L密闭容器中,反应达到平衡后,体系总压强为0.10MPa。则T℃时B点的化学平衡常数Kc=

(4)全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如图4所示。
①充电过程中,右槽溶液颜色逐渐由
②充电时若转移的电子数为NA个,则左槽溶液中n(H+)的变化量为

【知识点】 盖斯定律与热化学方程式解读 化学平衡的有关计算 原电池原理的应用
您最近一年使用:0次
解答题-结构与性质
|
适中(0.65)
名校
解题方法
11. Cu的单质和合金在生活、生产中有着广泛的应用。回答下列问题:
(1)Cu的基态原子价电子排布式为___ 。
(2)金属铜单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,其原因是___ ,反应的化学方程式为___ 。
(3)配离子Cu(CN)32-中,中心离子的杂化类型是___ ,该配离子的空间构型为___ ;CN-中配位原子是___ (填名称)。
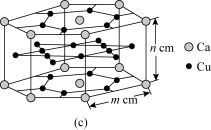
(4)CaCux合金可看作由如图所示的(a)、(b)两种原子层交替堆积排列而成。(a)是由Cu和Ca共同组成的层,层中Cu—Cu之间由实线相连;(b)是完全由Cu原子组成的层,Cu—Cu之间也由实线相连。图中虚线构建的六边形,表示由这两种层平行堆积时垂直于层的相对位置;(c)是由(a)和(b)两种原子层交替堆积成CaCux合金的晶体结构图。在这种结构中,同一层的Ca—Cu距离为294pm,相邻两层的Ca—Cu距离为327pm。
①该晶胞中Ca有___ 个Cu原子配位(不一定要等距最近)。
②同一层中,Ca原子之间的最短距离是___ pm,设NA为阿伏加 德罗常数的值,CaCu晶体的密度是___ g/cm3(用含m、n的式子表示)。


(1)Cu的基态原子价电子排布式为
(2)金属铜单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,其原因是
(3)配离子Cu(CN)32-中,中心离子的杂化类型是
(4)CaCux合金可看作由如图所示的(a)、(b)两种原子层交替堆积排列而成。(a)是由Cu和Ca共同组成的层,层中Cu—Cu之间由实线相连;(b)是完全由Cu原子组成的层,Cu—Cu之间也由实线相连。图中虚线构建的六边形,表示由这两种层平行堆积时垂直于层的相对位置;(c)是由(a)和(b)两种原子层交替堆积成CaCux合金的晶体结构图。在这种结构中,同一层的Ca—Cu距离为294pm,相邻两层的Ca—Cu距离为327pm。
①该晶胞中Ca有
②同一层中,Ca原子之间的最短距离是



您最近一年使用:0次
2020-01-20更新
|
371次组卷
|
5卷引用:湖北省武汉市武昌区2020届高三元月调研考试理综化学试题
湖北省武汉市武昌区2020届高三元月调研考试理综化学试题安徽省六安市第一中学2020届高三下学期自测卷(五)线下考试化学试题(已下线)考点14 物质结构与性质(选考)-2020年高考化学命题预测与模拟试题分类精编(已下线)2020届高三《新题速递·化学》2月第01期(考点13-14)(已下线)专题二十一物质结构与性质解题策略
解答题-有机推断题
|
适中(0.65)
12. 有机物W在医药和新材料等领域有广泛应用。W的一种合成路线如图:

已知部分信息如下:
请回答下列问题:
(1)Y的化学名称是___ ;Z中官能团的名称是___ ;
(2)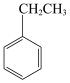 中
中___ (填“有”或“无”)手性碳原子;图示中X转化为Y的反应类型是___ 。
(3)生成W的化学方程式为___ 。
(4)G是对硝基乙苯的同分异构体,G能和碳酸钠反应产生气体且分子中含有—NH2(氨基),G的同分异构体有___ 种(不考虑立体结构),其中在核磁共振氢谱上峰的面积比为1∶2∶2∶2∶2的结构简式为___ 。
(5)设计以苯乙烯和丙酮为原料制备药物中间体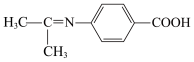 的合成路线
的合成路线___ (无机试剂自选)。

已知部分信息如下:
| ① | 1 mol Y完全反应生成2 mol Z,且在加热条件下Z不能和新制氢氧化铜悬浊液反应 |
| ② |  |
| ③ |  |
(1)Y的化学名称是
(2)
 中
中(3)生成W的化学方程式为
(4)G是对硝基乙苯的同分异构体,G能和碳酸钠反应产生气体且分子中含有—NH2(氨基),G的同分异构体有
(5)设计以苯乙烯和丙酮为原料制备药物中间体
 的合成路线
的合成路线
您最近一年使用:0次
试卷分析
整体难度:适中
考查范围:化学与STSE、化学实验基础、认识化学科学、化学反应原理、物质结构与性质、常见无机物及其应用、有机化学基础
试卷题型(共 12题)
题型
数量
单选题
7
解答题
5
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.65 | 常见金属的冶炼 | |
| 2 | 0.65 | 常见气体的制备与收集 化学实验方案的设计与评价 | |
| 3 | 0.65 | 结合气体物质与NA相关推算 结合氧化还原反应知识与NA相关推算 结合物质结构基础知识与NA相关推算 | |
| 4 | 0.65 | 氧化还原反应的应用 化学平衡的移动 溶度积规则及其应用 | |
| 5 | 0.65 | 酸碱中和滴定的综合考查 | |
| 6 | 0.65 | 原电池原理的应用 电解池电极反应式及化学方程式的书写与判断 | |
| 7 | 0.65 | “位构性”关系理解及应用 结合物质计算的元素周期律、元素周期表相关推断 | |
| 二、解答题 | |||
| 8 | 0.65 | 氢氧化亚铁的制备 物质制备的探究 | 实验探究题 |
| 9 | 0.65 | 离子方程式的书写 影响化学反应速率的因素 溶度积常数相关计算 物质分离、提纯综合应用 | 工业流程题 |
| 10 | 0.65 | 盖斯定律与热化学方程式 化学平衡的有关计算 原电池原理的应用 | 原理综合题 |
| 11 | 0.65 | 电子排布式 杂化轨道理论 配合物的概念、组成及形成条件 晶胞的有关计算 | 结构与性质 |
| 12 | 0.65 | 有机反应类型 烯烃系统命名法 同分异构体书写 根据题给物质选择合适合成路线 | 有机推断题 |



