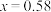H2C2O4水溶液中部分微粒的分布分数δ与pH关系如图所示,下列说法正确的是
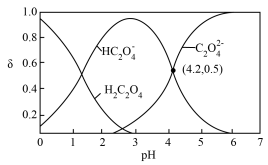

A.向H2C2O4溶液中滴加NaOH溶液至pH=2.5:c(H2C2O4)+c(C2O )>c(HC2O )>c(HC2O ) ) |
| B.由图可知:H2C2O4的Ka1=10-4.2 |
C.向H2C2O4溶液中滴加NaOH溶液至pH=7,则溶液中:2c(C2O )>c(Na+) )>c(Na+) |
D.将0.01 mol·L-1的H2C2O4溶液与0.02 mol·L-1 NaOH溶液等体积混合后的溶液中:c(OH-)=c(H+)+c(HC2O )+2c(H2C2O4) )+2c(H2C2O4) |
更新时间:2020-10-08 08:49:40
|
相似题推荐
单选题
|
较难
(0.4)
【推荐1】常温下,向20mL 0.1mol·L-1氨水中滴加某浓度的硫酸溶液,溶液中水电离的c(H+)随加入硫酸的体积变化如图所示。下列说法不正确 的是


| A.若a点对应水电离的c(H+)=1.0×10-11mol·L-1,则此时氨水的电离程度为1% |
| B.c点时氨水与硫酸恰好完全反应 |
| C.c点对应溶液中:c(H+)-c(OH-)=c(NH3·H2O) |
| D.若b、d点对应水电离的c(H+)=1.0×10-7mol·L-1,则两溶液中均存在:c(NH4+)=2c(SO42-) |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】配离子的稳定性可用K不稳衡量,例如Ag(NH3)2]+的K不稳=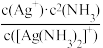 。在一定温度下,向0.1 mol/L硝酸银溶液中滴入稀氨水,发生反应Ag++2NH3⇌[Ag(NH3)2]+]。溶液中pNH3与δ(X)的关系如图。其中pNH3=-lg[c(NH3)]、δ(X)=
。在一定温度下,向0.1 mol/L硝酸银溶液中滴入稀氨水,发生反应Ag++2NH3⇌[Ag(NH3)2]+]。溶液中pNH3与δ(X)的关系如图。其中pNH3=-lg[c(NH3)]、δ(X)=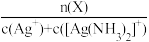 (X代表Ag+或Ag(NH3)2]+。下列说法不正确的是
(X代表Ag+或Ag(NH3)2]+。下列说法不正确的是
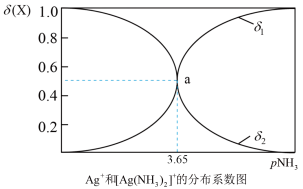
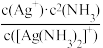 。在一定温度下,向0.1 mol/L硝酸银溶液中滴入稀氨水,发生反应Ag++2NH3⇌[Ag(NH3)2]+]。溶液中pNH3与δ(X)的关系如图。其中pNH3=-lg[c(NH3)]、δ(X)=
。在一定温度下,向0.1 mol/L硝酸银溶液中滴入稀氨水,发生反应Ag++2NH3⇌[Ag(NH3)2]+]。溶液中pNH3与δ(X)的关系如图。其中pNH3=-lg[c(NH3)]、δ(X)=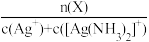 (X代表Ag+或Ag(NH3)2]+。下列说法不正确的是
(X代表Ag+或Ag(NH3)2]+。下列说法不正确的是
| A.图中δ2代表的是δ([Ag(NH3)2]+]) | B.向溶液中滴入稀硝酸,δ(Ag+)减小 |
| C.该溶液中c(NH4+)+c(H+)=c(OH-) | D.该温度时,K不稳([Ag(NH3)2]+)=10-7.3 |
您最近一年使用:0次
单选题
|
较难
(0.4)
解题方法
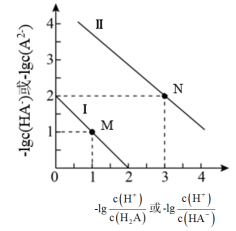
【推荐1】25℃时,用 NaOH 溶液滴定H2A 溶液,溶液中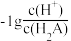 和-1gc(HA-)或
和-1gc(HA-)或 和
和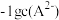 关系如图所示,下列说法正确的是
关系如图所示,下列说法正确的是
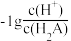 和-1gc(HA-)或
和-1gc(HA-)或 和
和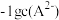 关系如图所示,下列说法正确的是
关系如图所示,下列说法正确的是
| A.H2A 为弱酸,其Ka1约为10-4 |
| B.滴定过程中,当pH=5时,c(Na+)>3c(A2-) |
| C.水的电离程度:M点<N点 |
| D.向 H2A 溶液中加入等体积等浓度的 NaOH 溶液完全反应后的溶液中: c(OH-)+c(A2-)=c(H+)+2c(H2A) |
您最近一年使用:0次
单选题
|
较难
(0.4)
解题方法
【推荐2】室温下,用0.1000mol•L-1NaOH溶液滴定20mL0.1000mol•L-1H3PO4溶液,溶液的pH与所加NaOH溶液的体积关系如图所示。下列说法不正确的是( )


| A.H3PO4的电离平衡常数Ka1约为10-2 |
B.当V(NaOH溶液)=40mL时,c(PO )+c(OH-)=c(H+)+c(H2PO )+c(OH-)=c(H+)+c(H2PO )+2c(H3PO4) )+2c(H3PO4) |
C.当pH=7时,c(Na+)=c(H2PO )+2c(HPO )+2c(HPO )+3c(PO )+3c(PO ) ) |
D.当V(NaOH溶液)=20mL时,c(Na+)>c(H2PO )>c(H3PO4)>c(HPO )>c(H3PO4)>c(HPO ) ) |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐3】某无色溶液仅由 、
、 、
、 、
、 、
、 、
、 、
、 、
、 中的若干种离子组成,且各离子浓度相等,取适量溶液进行如下实验:
中的若干种离子组成,且各离子浓度相等,取适量溶液进行如下实验:
①加过量盐酸无明显现象,且阴离子种类不改变;进行焰色试验显黄色。透过蓝色钴玻璃观察,未见紫色;
②取操作①后的溶液,加入过量 溶液,产生白色沉淀。
溶液,产生白色沉淀。
下列推断错误的是
A.原溶液中一定存在 |
B.②中的白色沉淀只有 |
C.溶液中一定不含 、 、 、 、 、 、 |
D.由溶液呈电中性可知溶液中一定含有 |
您最近一年使用:0次
单选题
|
较难
(0.4)
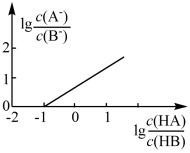
【推荐1】常温下,向20mL NaB溶液中滴入等浓度的HA溶液,所得溶液中
NaB溶液中滴入等浓度的HA溶液,所得溶液中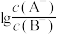 与1g
与1g 的关系如图所示。已知
的关系如图所示。已知 ,下列说法错误的是
,下列说法错误的是
 NaB溶液中滴入等浓度的HA溶液,所得溶液中
NaB溶液中滴入等浓度的HA溶液,所得溶液中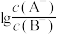 与1g
与1g 的关系如图所示。已知
的关系如图所示。已知 ,下列说法错误的是
,下列说法错误的是
A.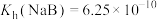 |
B.与 时相比, 时相比,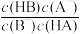 的值在 的值在 时更小 时更小 |
C.滴入20mLHA溶液后存在关系: |
D.滴入20mLHA溶液离子浓度存在关系: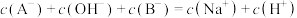 |
您最近一年使用:0次
单选题
|
较难
(0.4)
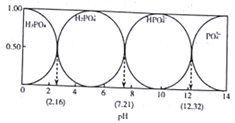
【推荐2】常温下,某酸H3A水溶液中含A的各种粒子的分布分数(平衡时某种粒子的浓度占各粒子浓度之和的分数)与pH关系图如下所示,下列说法正确的是
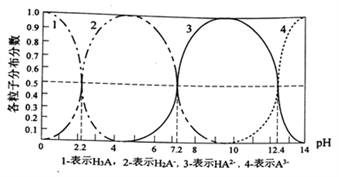

| A.NaH2A水溶液呈碱性 |
B.H3A溶液中存在:c(H+)=c(OH-)+c(H2A-)+ c(HA2-)+ c(HA2-)+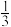 c(A3-) c(A3-) |
C.向H3A溶液中加入一定量的NaOH溶液至pH=5时,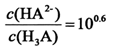 |
| D.向H3A溶液中加入氨水使PH从5→9发生的主要离子反应是:H2A-+OH-=HA2-+H2O |
您最近一年使用:0次


 的电离常数
的电离常数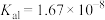 、
、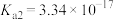 。
。 难溶于水,常温下,将
难溶于水,常温下,将 与
与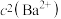 的关系如图所示。下列说法错误的是
的关系如图所示。下列说法错误的是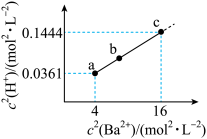
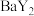 易溶于水。
易溶于水。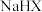 溶液显碱性
溶液显碱性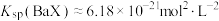
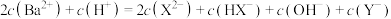
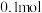

 HY溶液中得到氢离子浓度与
HY溶液中得到氢离子浓度与 点相等,则
点相等,则