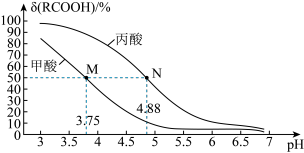
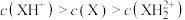25 ℃时,改变0.1 mol/L弱酸RCOOH溶液的pH,溶液中RCOOH分子的物质的量分数δ(RCOOH)随之改变[已知δ(RCOOH)=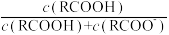 ],甲酸(HCOOH)与丙酸(CH3CH2COOH)溶液中δ(RCOOH)与pH的关系如图所示。下列说法正确的是
],甲酸(HCOOH)与丙酸(CH3CH2COOH)溶液中δ(RCOOH)与pH的关系如图所示。下列说法正确的是
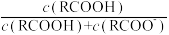 ],甲酸(HCOOH)与丙酸(CH3CH2COOH)溶液中δ(RCOOH)与pH的关系如图所示。下列说法正确的是
],甲酸(HCOOH)与丙酸(CH3CH2COOH)溶液中δ(RCOOH)与pH的关系如图所示。下列说法正确的是
| A.若弱酸pH增大是通过向弱酸中加入NaOH固体实现的,则图中M、N两点对应溶液中的c(Na+)相等 |
| B.对于甲酸和丙酸,当lg[c(RCOOH)/c(RCOO-)]>0时,溶液都为酸性 |
| C.等浓度的HCOONa和CH3CH2COONa两种溶液中的c(NaOH)相等 |
| D.将0.1 mol/L的HCOOH溶液与0.1 mol/L的HCOONa溶液等体积混合,所得溶液中:c(Na+)>c(HCOOH)>c(HCOO-)>c(OH-)>c(H+) |
21-22高三上·黑龙江牡丹江·期末 查看更多[7]
黑龙江省牡丹江市第一高级中学2021届高三上学期期末化学试题(已下线)解密10 水溶液中离子反应(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密10 水溶液中离子反应(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)模块十 水溶液中的离子平衡(模块检测)-2022年高考化学一轮复习小题多维练(全国通用)湖北省十一校2021-2022学年高三上学期第一次联考(12月)化学试题(已下线)专题07 电解质溶液—2022年高考化学二轮复习讲练测(全国版)-练习黑龙江省大兴安岭实验中学2021-2022学年高三上学期期末考试化学试题
更新时间:2021-01-07 16:37:17
|
相似题推荐
单选题
|
较难
(0.4)
名校
【推荐1】25℃,向100mL0.01mol·L-1的NaHA溶液中分别加入浓度均为0.01mol·L-1的NaOH溶液和盐酸,混合溶液的pH随所加溶液体积的变化关系如图所示(lg5=0.7)。下列说法不正确的是


| A.25℃,H2A的第二步电离平衡常数约为10-6 |
| B.P点时溶液中存在:2c(H2A)+c(HA-)+c(H+)=c(OH-)+c(Na+)+c(Cl-) |
| C.水的电离程度为N>M>P |
| D.随着盐酸的不断滴入,最终溶液的pH可能小于2 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐2】25℃时,用 溶液滴定同浓度的
溶液滴定同浓度的 溶液,
溶液, 被滴定分数
被滴定分数 、pH及微粒分布分数
、pH及微粒分布分数 [
[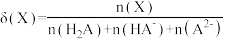 ,X表示
,X表示 、
、 或
或 ]的关系如图所示:
]的关系如图所示:
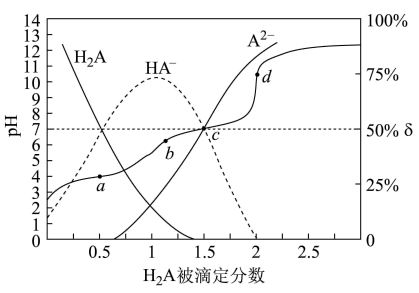
下列说法错误的是
 溶液滴定同浓度的
溶液滴定同浓度的 溶液,
溶液, 被滴定分数
被滴定分数 、pH及微粒分布分数
、pH及微粒分布分数 [
[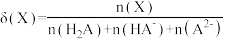 ,X表示
,X表示 、
、 或
或 ]的关系如图所示:
]的关系如图所示:
下列说法错误的是
A.25℃时, 第一步电离平衡常数 第一步电离平衡常数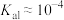 |
B.c点溶液中: |
C.a、b、c、d四点溶液中水的电离程度: |
D.用NaOH溶液滴定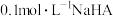 溶液可用甲基橙作指示剂 溶液可用甲基橙作指示剂 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐3】25 ℃时,H2R及其钠盐的溶液中,H2R、HR-、R2-三者所占的物质的量分数(w)随溶液pH变化的关系如图所示。下列叙述错误的是


| A.H2R是二元弱酸,其Ka1=1×10-2 |
| B.当溶液恰好呈中性时,c(Na+)=2c(R2-)+c(HR-) |
| C.NaHR在溶液中的水解程度大于电离程度 |
| D.pH=7.2的溶液中存在下列离子浓度关系:c(Na+)>c(R2-)=c(HR-)>c(OH-)>c(H+) |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐1】25℃时,向20mL0.1mol•L-1H2A溶液中滴加0.1mol•L-1的NaOH溶液,(忽略反应前后溶液体积变化)原溶液中部分粒子的物质的量随滴入NaOH溶液体积的变化如图所示。下列说法不正确的是


| A.II表示的是HA-的物质的量的变化曲线 |
| B.NaHA水溶液显碱性 |
C.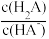 的值随若V[NaOH(aq)]的增大而减小 的值随若V[NaOH(aq)]的增大而减小 |
| D.当V[NaOH(aq)]=20mL时,溶液中存在关系:c(HA-)+c(A2-)+c(H2A)=0.05mol•L-1 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐2】常温下,向 溶液滴加
溶液滴加 溶液的过程中各组分的物质的量分数随pH变化曲线如图所示,下列说法中正确的是
溶液的过程中各组分的物质的量分数随pH变化曲线如图所示,下列说法中正确的是
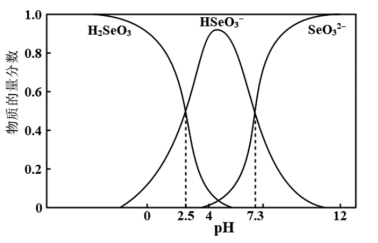
 溶液滴加
溶液滴加 溶液的过程中各组分的物质的量分数随pH变化曲线如图所示,下列说法中正确的是
溶液的过程中各组分的物质的量分数随pH变化曲线如图所示,下列说法中正确的是
A. 的数量级为 的数量级为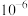 |
B.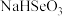 溶液显碱性 溶液显碱性 |
C. 时,溶液中存在 时,溶液中存在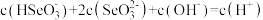 |
D.在 溶液中, 溶液中, |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐1】常温下,下列说法正确的是
| A.等体积、等物质的量浓度的氨水和氢氧化钠溶液,分别通入氯化氢气体至溶液呈中性,氨水消耗的氯化氢更少 |
B.浓度均为0.1mol•L-1的氨水和盐酸等体积混合后,溶液中c(Cl-)=c(NH ) ) |
| C.pH相等的盐酸和氯化铵溶液中,c(Cl-)相同 |
| D.浓度均为0.1mol•L-1的盐酸和醋酸溶液,导电能力相同 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】HA和HB是两种一元弱酸,其难溶盐RA和RB的溶度积: ,已知
,已知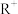 不发生水解,实验测得25℃时RA和RB的饱和溶液中,
不发生水解,实验测得25℃时RA和RB的饱和溶液中, 随
随 的变化为线性关系,下列说法不正确的是
的变化为线性关系,下列说法不正确的是
 ,已知
,已知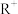 不发生水解,实验测得25℃时RA和RB的饱和溶液中,
不发生水解,实验测得25℃时RA和RB的饱和溶液中, 随
随 的变化为线性关系,下列说法不正确的是
的变化为线性关系,下列说法不正确的是
A.甲表示RB的饱和溶液中 随 随 的变化 的变化 |
B.等体积、等浓度的ROH溶液与HA溶液混合时,存在 |
C.由图可知,当RA饱和溶液中 时, 时, |
D.25℃时,将难溶盐RA、RB加入蒸馏水中混合、振荡、静置后,上层清液中 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐1】已知CH3COONH4溶液为中性,又知CH3COOH溶液加到Na2CO3溶液中有气体放出,现有25℃时等浓度的三种溶液:①NH4Cl、②CH3COONH4、③NH4HCO3。下列说法正确的是
| A.NH4HCO3溶液的pH=7 |
B.三种溶液NH 浓度由大到小的顺序排列是①>②>③ 浓度由大到小的顺序排列是①>②>③ |
| C.等浓度的CH3COONH4和NaCl溶液,水的电离程度一样 |
| D.①②③三个溶液中的H+都由水电离生成 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐2】弱酸酸式盐的酸根离子电离和水解并存,已知HSO 电离大于水解。以 NaHXO3表示 NaHCO3和 NaHSO3,对于 NaHCO3和NaHSO3溶液,下列关系式中不正确的是
电离大于水解。以 NaHXO3表示 NaHCO3和 NaHSO3,对于 NaHCO3和NaHSO3溶液,下列关系式中不正确的是
 电离大于水解。以 NaHXO3表示 NaHCO3和 NaHSO3,对于 NaHCO3和NaHSO3溶液,下列关系式中不正确的是
电离大于水解。以 NaHXO3表示 NaHCO3和 NaHSO3,对于 NaHCO3和NaHSO3溶液,下列关系式中不正确的是A.c(Na+)+c(H+)=c(OH-)+c(HXO )+2c(XO )+2c(XO ) ) |
B.c(Na+)=c(H2XO3)+c(HXO )+c(XO )+c(XO ) ) |
C.c(Na+)>c(HXO )>c(H+)>c(OH-) )>c(H+)>c(OH-) |
D.c(OH-)=c(H+)+c(H2XO3)-c(XO ) ) |
您最近一年使用:0次

 )的叙述正确的是
)的叙述正确的是
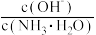 将增大
将增大

 的HR溶液中缓慢加入NaOH固体(溶液温度恒为25℃。不考虑溶液体积的变化),平衡后
的HR溶液中缓慢加入NaOH固体(溶液温度恒为25℃。不考虑溶液体积的变化),平衡后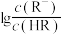 与溶液pH的关系如图所示(已知
与溶液pH的关系如图所示(已知 )。下列说法正确的是
)。下列说法正确的是
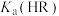 的数量级是
的数量级是 的分布分数
的分布分数 等于
等于 时,溶液的pH=4.1
时,溶液的pH=4.1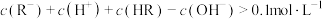
 ,简写为X)为二元弱碱。常温时,向
,简写为X)为二元弱碱。常温时,向 其盐酸盐溶液
其盐酸盐溶液 中加入固体NaOH(溶液体积变化忽略不计),体系中
中加入固体NaOH(溶液体积变化忽略不计),体系中 、
、 、X三种粒子的浓度的对数值(
、X三种粒子的浓度的对数值( )、所加NaOH固体质量与pOH的关系如图所示。下列说法正确的是
)、所加NaOH固体质量与pOH的关系如图所示。下列说法正确的是

 时,
时,