已知常温下浓度均为0.1 mol/L的下列溶液的pH如表,下列有关说法正确的是
| 溶质 | NaF | Na2CO3 | NaClO | NaHCO3 |
| pH | 7.5 | 11.6 | 9.7 | 8.4 |
| A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:H2CO3<HClO<HF |
B.若将CO2通入0.1 mol/L Na2CO3溶液至溶液呈中性则溶液中 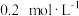 |
| C.等体积、等物质的量浓度的NaClO溶液与NaF溶液中离子总数大小:N前=N后 |
| D.向Na2CO3溶液中通入少量的HF气体,化学方程式为Na2CO3+2HF =CO2+H2O+2NaF |
更新时间:2021-01-09 20:28:01
|
相似题推荐
单选题
|
适中
(0.65)
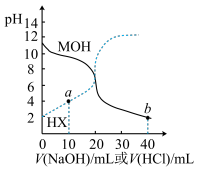
【推荐1】根据如表提供的数据可知,在溶液中能大量共存的微粒是
| 化学式 | 电离常数 |
 |  |
| HCN |  |
 | 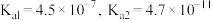 |
A.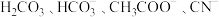 | B.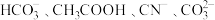 |
C.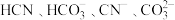 | D. |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】已知草酸为二元弱酸:H2C2O4⇌HC2O4-+H+ Ka1;HC2O4-⇌C2O42-+H+ Ka2。常温下,向某浓度的草酸溶液中逐滴加入一定物质的量浓度的KOH溶液,所得溶液中H2C2O4、HC2O4—、C2O42−三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法不正确的是
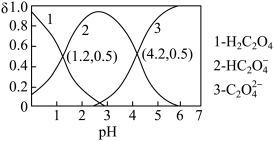

| A.pH=1.2的溶液中:c(K+)+c(H+)=c(OH−)+c(H2C2O4) |
B.pH=2.7的溶液中: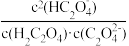 =1000 =1000 |
| C.向pH=1.2的溶液中加KOH溶液,将pH增大至4.2的过程中水的电离度一定增大 |
| D.将相同物质的量的KHC2O4和K2C2O4固体完全溶于水所得混合液的pH为4.2 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】由下列实验及现象不能推出相应结论的是
| 实验 | 现象 | 结论 | |
| A、 | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体 | 观察到红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
| B、 | 室温下,用pH试纸测0.1 mol/L NaHSO3溶液的pH | pH约为5 | HSO3-电离大于水解 |
| C、 | 加热盛有少量 NH4HCO3固体的试管,并在试管口放置湿润的红色石蕊试纸 | 石蕊试纸变蓝 | NH4HCO3显碱性 |
| D、 | 某有机物与溴的四氯化碳溶液混合 | 溶液褪色 | 该有机物不一定含碳碳双键 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】已知NaHSO3溶液呈弱酸性。在0.1mol/L NaHSO3溶液中,下列粒子浓度关系式不正确的是
A.c(Na+)>c( )>c( )>c( )>c(H2SO3) )>c(H2SO3) |
B.c(H+)+c( )=c(OH-)+c(H2SO3) )=c(OH-)+c(H2SO3) |
C.c(Na+)=c( )+c(H2SO3)+c( )+c(H2SO3)+c( ) ) |
D.c(H+)+c(Na+) =c(OH-)+c( )+2c( )+2c( ) ) |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐3】下列化学事实对应的原理或解释正确的是
| 化学事实 | 原理或解释 | |
| A | 焦炭在高温下与石英砂反应制备粗硅 | 非金属性:C>Si |
| B | 向NaAlO2溶液中滴加NaHCO3溶液,有白色沉淀生成 |  与 与 均发生水解反应并相互促进 均发生水解反应并相互促进 |
| C | 将浓硫酸加入蔗糖中,蔗糖变黑,放出大量热,生成有刺激性气味的气体 | 浓硫酸具有脱水性、强氧化性 |
| D | 将1 mL0.1 mol/L KI溶液与5 mL0.1 mol/L FeCl3溶液混合,再滴加KSCN溶液,溶液变为红色 | FeCl3与KI的反应有一定的限度 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐1】常温下,用一定浓度的盐酸溶液滴定某氨水溶液。滴定终点附近溶液pH和导电能力的变化分别如下图所示(利用溶液导电能力的变化可判断滴定终点,溶液总体积变化忽略不计)。下列说法错误的是
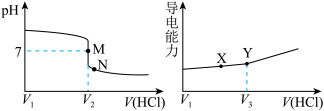

| A.M点对应溶液中c(NH4+)=c(Cl-) |
| B.X→Y溶液导电性增强的主要原因是c(H+)和c(Cl-)增大 |
| C.根据溶液pH和导电能力的变化可判断V2<V3 |
D.M→N过程中 不变 不变 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐2】已知常温时,0.1mol·L-1的二元酸H2A溶液的pH=4.0,则下列说法中正确的是
| A.加水稀释H2A溶液,H2A的电离程度增大,溶液中各离子浓度均减小 |
| B.在Na2A溶液中一定有:c(Na+)>c(A2-)>c(H+)>c(OH-)>c(HA-) |
| C.在Na2A、NaHA两溶液中,离子种类不相同 |
| D.在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+2c(A2-) |
您最近一年使用:0次

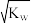 ,则该溶液一定显中性
,则该溶液一定显中性