乙酸、碳酸、次氯酸、草酸在生产、生活及医药方面有广泛用途。回答下列问题:
I.已知25℃时,部分物质的电离常数如表所示:
(1)a.CH3COOH、b.H2CO3、c.HClO的酸性由强到弱的顺序为_______ (填编号)。
(2)水存在如下平衡:H2O+H2O⇌H3O++OH-ΔH>0,现欲使平衡向右移动,结果使溶液显碱性,应选择方法_______ 。
A.向水中加入NaHSO4固体 B.向水中加入NaOH固体 C.加热至100℃ D.向水中加入Na
(3)NaClO溶液显碱性的原因(用化学用语表示)_______ 。
(4)向NaClO溶液中通入少量的CO2,反应的离子方程式为_______ 。
(5)pH相同等体积的下列三种物质的溶液:a.HCl,b.H2SO4,c.CH3COOH滴加等浓度的NaOH溶液将它们恰好中和,用去NaOH溶液的体积分别为V1、V2、V3则三者的大小关系_______ 。
A.V3>V2>V1 B.V3=V2=V1 C.V3>V2=V1 D.V1=V2>V3
(6)25℃时,有两种溶液:①0.10mol·L-1CH3COOH溶液,②Na2CO3溶液,下列说法正确的是_______ (填字母)。
A.CH3COOH和Na2CO3都属于强电解质
B.①中:c(CH3COOH)+c(CH3COO-) = 0.10mol·L-1
C.②中:c(Na+)>c(OH-)>c(CO ) > c(HCO
) > c(HCO )>c(H+)
)>c(H+)
II.乙二酸(H2C2O4)俗称草酸,在实验研究和化学工业中应用广泛。
(1)室温下,测得0.1 mol·L-1 H2C2O4溶液的pH =1.3,写出草酸的电离方程式_______ 。
(2)草酸溶液中各粒子的物质的量分数随溶液pH变化关系如图所示:
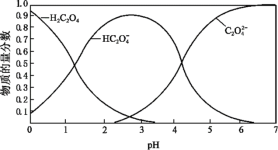
①向草酸溶液中滴加KOH溶液至pH=2.5时发生的主要反应的离子方程式是_______ 。
②0.1 mol·L-1 KHC2O4溶液中,下列粒子浓度关系正确的是_______ (填序号)。
a.c(K+)+c(H+)=c(HC2O )+c(C2O
)+c(C2O )+c(OH-)
)+c(OH-)
b.c(K+)>c(HC2O ) > c(C2O
) > c(C2O ) > c(H2C2O4)
) > c(H2C2O4)
c.c(K+)=c(HC2O ) + c(C2O
) + c(C2O )+c(H2C2O4)
)+c(H2C2O4)
(3)工业上利用硫酸亚铁与草酸反应制备草酸亚铁晶体,其离子方程式为:Fe2++H2C2O4+xH2O FeC2O4·xH2O↓+2H+
FeC2O4·xH2O↓+2H+
①制备时需添加氨水以提高FeC2O4·xH2O的产率,从化学平衡移动原理角度解释原因:_______ 。
②测定草酸亚铁晶体(FeC2O4·xH2O)的x值,实验如下:称取0.5400 g草酸亚铁晶体溶于一定浓度的硫酸中,用KMnO4酸性溶液滴定。到达滴定终点时,消耗0.1000 mol·L-1的KMnO4酸性溶液18.00 mL。已知:滴定过程中铁、碳元素被氧化为Fe3+、CO2,锰元素被还原为Mn2+,则FeC2O4·xH2O中x=_______ (FeC2O4的摩尔质量是144 g·mol-1)。
I.已知25℃时,部分物质的电离常数如表所示:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
(2)水存在如下平衡:H2O+H2O⇌H3O++OH-ΔH>0,现欲使平衡向右移动,结果使溶液显碱性,应选择方法
A.向水中加入NaHSO4固体 B.向水中加入NaOH固体 C.加热至100℃ D.向水中加入Na
(3)NaClO溶液显碱性的原因(用化学用语表示)
(4)向NaClO溶液中通入少量的CO2,反应的离子方程式为
(5)pH相同等体积的下列三种物质的溶液:a.HCl,b.H2SO4,c.CH3COOH滴加等浓度的NaOH溶液将它们恰好中和,用去NaOH溶液的体积分别为V1、V2、V3则三者的大小关系
A.V3>V2>V1 B.V3=V2=V1 C.V3>V2=V1 D.V1=V2>V3
(6)25℃时,有两种溶液:①0.10mol·L-1CH3COOH溶液,②Na2CO3溶液,下列说法正确的是
A.CH3COOH和Na2CO3都属于强电解质
B.①中:c(CH3COOH)+c(CH3COO-) = 0.10mol·L-1
C.②中:c(Na+)>c(OH-)>c(CO
 ) > c(HCO
) > c(HCO )>c(H+)
)>c(H+)II.乙二酸(H2C2O4)俗称草酸,在实验研究和化学工业中应用广泛。
(1)室温下,测得0.1 mol·L-1 H2C2O4溶液的pH =1.3,写出草酸的电离方程式
(2)草酸溶液中各粒子的物质的量分数随溶液pH变化关系如图所示:

①向草酸溶液中滴加KOH溶液至pH=2.5时发生的主要反应的离子方程式是
②0.1 mol·L-1 KHC2O4溶液中,下列粒子浓度关系正确的是
a.c(K+)+c(H+)=c(HC2O
 )+c(C2O
)+c(C2O )+c(OH-)
)+c(OH-)b.c(K+)>c(HC2O
 ) > c(C2O
) > c(C2O ) > c(H2C2O4)
) > c(H2C2O4)c.c(K+)=c(HC2O
 ) + c(C2O
) + c(C2O )+c(H2C2O4)
)+c(H2C2O4)(3)工业上利用硫酸亚铁与草酸反应制备草酸亚铁晶体,其离子方程式为:Fe2++H2C2O4+xH2O
 FeC2O4·xH2O↓+2H+
FeC2O4·xH2O↓+2H+①制备时需添加氨水以提高FeC2O4·xH2O的产率,从化学平衡移动原理角度解释原因:
②测定草酸亚铁晶体(FeC2O4·xH2O)的x值,实验如下:称取0.5400 g草酸亚铁晶体溶于一定浓度的硫酸中,用KMnO4酸性溶液滴定。到达滴定终点时,消耗0.1000 mol·L-1的KMnO4酸性溶液18.00 mL。已知:滴定过程中铁、碳元素被氧化为Fe3+、CO2,锰元素被还原为Mn2+,则FeC2O4·xH2O中x=
更新时间:2021-01-25 08:56:33
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】氮的氧化物、硫的氧化物是主要的大气污染物,对这些有害气体的治理及合理利用显得尤为重要。回答下列问题:
Ⅰ.某MOFs多孔材料孔径大小和形状恰好将N2O4“固定”,能高效选择性吸附NO2。废气中的NO2被吸附后,将材料泡入水中并通入氧气能全部转化为HNO3,原理示意图如图所示:

已知:
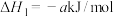
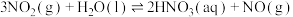
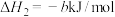
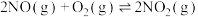
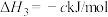 (a、b、c均大于0)
(a、b、c均大于0)
(1)请从温度和压强两个角度分析利于NO2吸附的条件:___________ 。
(2)①当MOFs多孔材料吸附NO2到质量不再发生变化时,______ (填序号)也能说明吸附反应已达到极限。
A.颜色不再发生变化 B.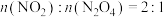
C. D.混合气体的平均分子质量不再发生变化
D.混合气体的平均分子质量不再发生变化
②若MOFs多孔材料共吸附10gNO2,当吸附反应达到极限时,测得材料内温度为40℃,压强为10.0MPa,混合气体平均相对分子质量为69,吸附反应的
______  。
。
(3)由N2O4转化生成HNO3的热化学反应方程式为___________ 。
Ⅱ.25℃时,有关物质的电离平衡常数如下表所示:
(4)等浓度的 、
、 、
、 结合H⁺的能力由强到弱的顺序为
结合H⁺的能力由强到弱的顺序为___________ 。
(5)将过量H2S气体通入Na2CO3溶液中反应的离子方程式为___________ 。
(6)废水中H2S的去除:可用N2或CO2将H2S从水中吹出,再用碱液吸收。将H2S从水中吹出时,用CO2比N2效果更好,其原因是___________ 。
Ⅰ.某MOFs多孔材料孔径大小和形状恰好将N2O4“固定”,能高效选择性吸附NO2。废气中的NO2被吸附后,将材料泡入水中并通入氧气能全部转化为HNO3,原理示意图如图所示:

已知:

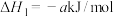
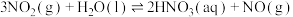
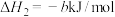
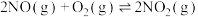
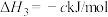 (a、b、c均大于0)
(a、b、c均大于0)(1)请从温度和压强两个角度分析利于NO2吸附的条件:
(2)①当MOFs多孔材料吸附NO2到质量不再发生变化时,
A.颜色不再发生变化 B.
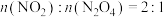
C.
 D.混合气体的平均分子质量不再发生变化
D.混合气体的平均分子质量不再发生变化②若MOFs多孔材料共吸附10gNO2,当吸附反应达到极限时,测得材料内温度为40℃,压强为10.0MPa,混合气体平均相对分子质量为69,吸附反应的

 。
。(3)由N2O4转化生成HNO3的热化学反应方程式为
Ⅱ.25℃时,有关物质的电离平衡常数如下表所示:
| 化学式 | 电离平衡常数( ) ) |
| CH3COOH |  |
| H2CO3 |  , , |
| H2S | 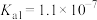 , ,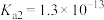 |
(4)等浓度的
 、
、 、
、 结合H⁺的能力由强到弱的顺序为
结合H⁺的能力由强到弱的顺序为(5)将过量H2S气体通入Na2CO3溶液中反应的离子方程式为
(6)废水中H2S的去除:可用N2或CO2将H2S从水中吹出,再用碱液吸收。将H2S从水中吹出时,用CO2比N2效果更好,其原因是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】油气开采、石油化工、煤化工等行业废气中普遍含有硫化氢,需要回收处理并加以利用。
I.已知下列反应的热化学方程式:
①2H2S(g)+3O2(g)=2SO2(g)+2H2O(g) ∆H1
②4H2S(g)+2SO2(g)=3S2(g)+4H2O(g) ∆H2
③2H2(g)+O2(g)=2H2O(g) ∆H3
④2H2S(g)=S2(g)+2H2(g) ∆H4
(1)∆H4=
(2)已知∆H4>0,
A.低温 B.高温
(3)处理H2S普遍采用的方法是克劳斯工艺,即利用反应①和②生成S2;另一种方法是利用反应④分解H2S。相比克劳斯工艺,分解法的优点是
II.在1373K、100 kPa下,分别将n(H2S):n(Ar)为4:1、1:1、1:4、1:9的H2S-Ar混合气体置于密闭容器中发生反应④,反应过程中H2S转化率随时间的变化如下图所示:
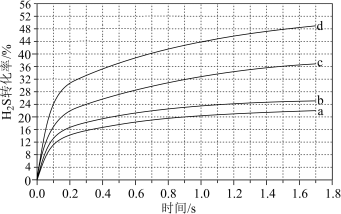
(4)n(H2S):n(Ar)=1:9对应图中曲线
A.a B.b C.c D.d
(5)n(H2S):n(Ar)=1:4的混合气体投料后,若将温度升高至1473K,达到平衡时混合气体中H2S与H2的分压相等,H2S平衡转化率为
III.在真空克劳斯法脱硫中,用K2CO3溶液吸收H2S。
电离平衡常数 | H2CO3 | H2S |
K1 | 4.2×10-7 | 5.6×10-8 |
K2 | 5.6×10-11 | 1.2×10-15 |
(6)下列关于K2CO3溶液中微粒关系正确的是___________。
A.c(OH-)>c(HCO ) ) | B.c(H+)>c(HCO ) ) |
C.c(OH-)=c(H+)+c(HCO )+2c(H2CO3) )+2c(H2CO3) | D.2c(K+)=c(CO )+c(HCO )+c(HCO )+c(H2CO3) )+c(H2CO3) |
(7)K2CO3溶液吸收少量H2S的离子方程式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】Ⅰ:现有以下几种物质①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸钠、⑥亚硫酸氢钠、⑦氨水。请回答下列问题:
(1)以上物质属于弱电解质的是______ (填序号);
(2)常温下④的溶液pH______ 7(填>“<”或“=”),原因______ (用离子方程式表示);
(3)⑥的水溶液中呈酸性,原因是______ 。
(4)常温下,将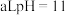 的
的 溶液与
溶液与 的
的 溶液混合(忽略混合后溶液体积的变化),若所得混合溶液的
溶液混合(忽略混合后溶液体积的变化),若所得混合溶液的 ,则
,则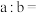
______ 。
(5)已知:
a.常温下,醋酸和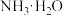 的电离平衡常数均为
的电离平衡常数均为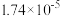 ;
;
b.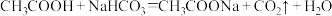
则 溶液呈
溶液呈______ 性(填“酸”、“碱”或“中”,下同), 溶液呈
溶液呈______ 性。
(6)对于醋酸溶液和醋酸钠溶液的下列说法正确的是______;
(1)以上物质属于弱电解质的是
(2)常温下④的溶液pH
(3)⑥的水溶液中呈酸性,原因是
(4)常温下,将
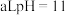 的
的 溶液与
溶液与 的
的 溶液混合(忽略混合后溶液体积的变化),若所得混合溶液的
溶液混合(忽略混合后溶液体积的变化),若所得混合溶液的 ,则
,则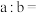
(5)已知:
a.常温下,醋酸和
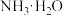 的电离平衡常数均为
的电离平衡常数均为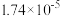 ;
;b.
则
 溶液呈
溶液呈 溶液呈
溶液呈(6)对于醋酸溶液和醋酸钠溶液的下列说法正确的是______;
| A.稀释醋酸溶液,醋酸的电离程度增大,而稀释醋酸钠溶液则醋酸钠的水解程度减小。 |
| B.升高温度可以促进醋酸电离,也可以促进醋酸钠水解。 |
| C.醋酸和醋酸钠混合液中,醋酸抑制醋酸钠的水解、醋酸钠也抑制醋酸的电离。 |
| D.常温下,醋酸和醋酸钠等体积等浓度混合,溶液呈碱性。 |
您最近一年使用:0次
【推荐1】甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题:
(1)一定温度下,在一恒容的密闭容器中,由CO和H2合成甲醇:
CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
①下列情形不能说明该反应已达到平衡状态的是_____ (填序号)。
A.每消耗1mol CO的同时生成2molH2
B.混合气体总物质的量不变
C.生成CH3OH的速率与消耗CO的速率相等
D.CH3OH、CO、H2的浓度都不再发生变化
②CO的平衡转化率(α)与温度、压强的关系如图所示.B、C两点的平衡常数K(B)_____ K(C)(填“>”、“=”或“<”).
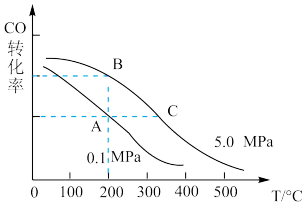
③某温度下,将2.0mol CO和6.0molH2充入2L的密闭容器中,达到平衡时测得
c(CO)=0.25mol/L,CO的转化率=_____ ,此温度下的平衡常数K=______ (保留二位有效数字)。
(2)常温下,将V mL、0.20mol/L氢氧化钠溶液逐滴加到20.00mL、0.20mol/L甲酸溶液中,充分反应,溶液pH=7,此时V______ 20.00(填“>”、“=”或“<”);当氢氧化钠溶液与甲酸溶液恰好完全反应时,溶液中所含离子浓度由大到小排列顺序____________
(3)温度650℃的熔融盐燃料电池,用(CO、H2)作反应物,空气与CO2的混合气体为正极反应物,镍作电极,用Li2CO3和Na2CO3混合物作电解质.该电池的正极反应式为__________ 。
(4)已知:CH3OH、H2的燃烧热(△H)分别为﹣726.5kJ/mol、﹣285.8kJ/mol,则常温下CO2和H2反应生成CH3OH和H2O的热化学方程式是________________________ 。
(1)一定温度下,在一恒容的密闭容器中,由CO和H2合成甲醇:
CO(g)+2H2(g)
 CH3OH(g)
CH3OH(g)①下列情形不能说明该反应已达到平衡状态的是
A.每消耗1mol CO的同时生成2molH2
B.混合气体总物质的量不变
C.生成CH3OH的速率与消耗CO的速率相等
D.CH3OH、CO、H2的浓度都不再发生变化
②CO的平衡转化率(α)与温度、压强的关系如图所示.B、C两点的平衡常数K(B)

③某温度下,将2.0mol CO和6.0molH2充入2L的密闭容器中,达到平衡时测得
c(CO)=0.25mol/L,CO的转化率=
(2)常温下,将V mL、0.20mol/L氢氧化钠溶液逐滴加到20.00mL、0.20mol/L甲酸溶液中,充分反应,溶液pH=7,此时V
(3)温度650℃的熔融盐燃料电池,用(CO、H2)作反应物,空气与CO2的混合气体为正极反应物,镍作电极,用Li2CO3和Na2CO3混合物作电解质.该电池的正极反应式为
(4)已知:CH3OH、H2的燃烧热(△H)分别为﹣726.5kJ/mol、﹣285.8kJ/mol,则常温下CO2和H2反应生成CH3OH和H2O的热化学方程式是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】煤的综合利用对于改善大气质量和能源充分利用有重要的意义。
(1)下列说法正确的是_____________ (填序号)。
a.煤是由有机物和少量无机物组成的复杂混合物
b.煤在燃烧过程中会生成一氧化碳、二氧化碳、氮氧化物、烟尘等物质
c.可利用生石灰、熟石灰、石灰石等固硫剂使煤在燃烧过程中生成稳定的硫酸盐
d.煤的干馏属于化学变化,煤的气化和液化都属于物理变化
(2)煤的气化过程中产生的有害气体H2S用氨水吸收生成正盐的离子方程式是__________ 。
(3)燃煤烟气的一种脱硫方案-火碱-石灰-石膏法流程图1如下:
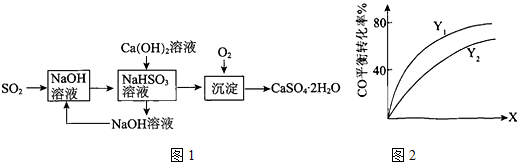
①常温下,用NaOH溶液吸收SO2得到pH=6的NaHSO3溶液,该溶液中离子浓度的大小顺序是
_______________________________________________________________ 。
②氢氧化钙与NaHSO3反应的化学方程式是____________________________ 。
(4)煤的间接液化法合成二甲醚的三步反应如下:
Ⅰ.2H2(g)+CO(g) CH3OH(g) △H=-90.8kJ·mol-1
CH3OH(g) △H=-90.8kJ·mol-1
Ⅱ.2CH3OH(g) CH3OCH3(g)+ H2O(g) △H="-23.5" kJ·mol-1
CH3OCH3(g)+ H2O(g) △H="-23.5" kJ·mol-1
Ⅲ.CO(g) + H2O(g) CO2(g) + H2(g) △H="-41.3" kJ·mol-1
CO2(g) + H2(g) △H="-41.3" kJ·mol-1
① 总反应热化学方程式:3H2(g)+ 3CO(g) CH3OCH3(g)+ CO2(g) △H=
CH3OCH3(g)+ CO2(g) △H=___________
② Y(Y1、Y2),X可分别代表压强或温度。如图2表示Y一定时,总反应中CO的平衡转化率随X的变化关系。判断Y1、Y2的大小关系,并简述理由:
_______________________________________________________________ 。
(1)下列说法正确的是
a.煤是由有机物和少量无机物组成的复杂混合物
b.煤在燃烧过程中会生成一氧化碳、二氧化碳、氮氧化物、烟尘等物质
c.可利用生石灰、熟石灰、石灰石等固硫剂使煤在燃烧过程中生成稳定的硫酸盐
d.煤的干馏属于化学变化,煤的气化和液化都属于物理变化
(2)煤的气化过程中产生的有害气体H2S用氨水吸收生成正盐的离子方程式是
(3)燃煤烟气的一种脱硫方案-火碱-石灰-石膏法流程图1如下:

①常温下,用NaOH溶液吸收SO2得到pH=6的NaHSO3溶液,该溶液中离子浓度的大小顺序是
②氢氧化钙与NaHSO3反应的化学方程式是
(4)煤的间接液化法合成二甲醚的三步反应如下:
Ⅰ.2H2(g)+CO(g)
 CH3OH(g) △H=-90.8kJ·mol-1
CH3OH(g) △H=-90.8kJ·mol-1Ⅱ.2CH3OH(g)
 CH3OCH3(g)+ H2O(g) △H="-23.5" kJ·mol-1
CH3OCH3(g)+ H2O(g) △H="-23.5" kJ·mol-1Ⅲ.CO(g) + H2O(g)
 CO2(g) + H2(g) △H="-41.3" kJ·mol-1
CO2(g) + H2(g) △H="-41.3" kJ·mol-1① 总反应热化学方程式:3H2(g)+ 3CO(g)
 CH3OCH3(g)+ CO2(g) △H=
CH3OCH3(g)+ CO2(g) △H=② Y(Y1、Y2),X可分别代表压强或温度。如图2表示Y一定时,总反应中CO的平衡转化率随X的变化关系。判断Y1、Y2的大小关系,并简述理由:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】回答下列问题:
(1)室温下pH相等的①Na2CO3②CH3COONa和③NaOH溶液,物质的量浓度从大到小的顺序为___________ (填序号);
(2)室温下浓度均为0.1mol·L-1的①(NH4)2CO3②(NH4)2SO4和③NH4HSO4溶液中, 物质的量浓度从大到小的顺序为
物质的量浓度从大到小的顺序为___________ (填序号);
(3)常温下,H2C2O4和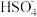 的电离平衡常数如下:
的电离平衡常数如下:
①根据以上信息可知,Na2SO4溶液呈___________ (填“酸”“碱”或“中”)性;
②少量Na2C2O4溶液与过量NaHSO4溶液反应的离子方程式为___________ ;
③室温下,pH=1的H2SO4溶液中,c( )∶c(
)∶c(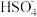 )=
)=___________ 。
(1)室温下pH相等的①Na2CO3②CH3COONa和③NaOH溶液,物质的量浓度从大到小的顺序为
(2)室温下浓度均为0.1mol·L-1的①(NH4)2CO3②(NH4)2SO4和③NH4HSO4溶液中,
 物质的量浓度从大到小的顺序为
物质的量浓度从大到小的顺序为(3)常温下,H2C2O4和
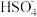 的电离平衡常数如下:
的电离平衡常数如下:| 化学式 | H2C2O4 | HSO |
| 电离平衡常数 | Ka1=5.9×10-2 Ka2=6.4×10-5 | 1.2×10-2 |
②少量Na2C2O4溶液与过量NaHSO4溶液反应的离子方程式为
③室温下,pH=1的H2SO4溶液中,c(
 )∶c(
)∶c(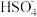 )=
)=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】某硫酸工厂的酸性废水中砷(As)元素含量极高,为控制砷的排放,可采用化学沉降法处理含砷废水,相关数据如下表。请回答以下问题:
表1 几种盐的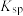
表2 工厂污染物排放浓度及允许排放标准
(1)该硫酸工厂排放的废水中硫酸的物质的量浓度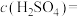
__________  。
。
(2)若酸性废水中 的浓度为
的浓度为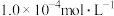 ,则
,则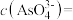
__________  。
。
(3)工厂排放出的酸性废水中的三价砷(弱酸 )不易沉降,可投入
)不易沉降,可投入 先将其氧化成五价砷(弱酸
先将其氧化成五价砷(弱酸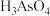 ),此时
),此时 被还原为
被还原为 ,该反应的离子方程式为
,该反应的离子方程式为__________ 。
(4)在处理含砷废水时采用分段式,先向废水中投入生石灰调节pH到2,再投入生石灰将pH调节到8左右,使五价砷以 的形式沉降。
的形式沉降。
①将pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为__________ 。
② 在pH调节到8左右才开始沉淀,原因为
在pH调节到8左右才开始沉淀,原因为______________ 。
③砷酸( )分步电离的平衡常数(25℃)为
)分步电离的平衡常数(25℃)为 ,
,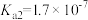
 ,
,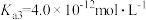 ,第三步电离的平衡常数表达式为
,第三步电离的平衡常数表达式为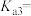
_________ , 第一步水解的离子方程式为
第一步水解的离子方程式为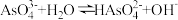 ,该步水解的平衡常数(25℃)为
,该步水解的平衡常数(25℃)为__________ 。
表1 几种盐的
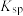
| 难溶物 | 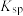 |
 | 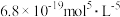 |
 |  |
 | 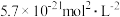 |
表2 工厂污染物排放浓度及允许排放标准
| 污染物 |  | As |
| 废水浓度 | 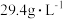 | 1.6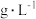 |
| 排放标准 | 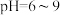 | 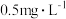 |
(1)该硫酸工厂排放的废水中硫酸的物质的量浓度
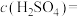
 。
。(2)若酸性废水中
 的浓度为
的浓度为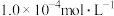 ,则
,则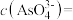
 。
。(3)工厂排放出的酸性废水中的三价砷(弱酸
 )不易沉降,可投入
)不易沉降,可投入 先将其氧化成五价砷(弱酸
先将其氧化成五价砷(弱酸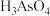 ),此时
),此时 被还原为
被还原为 ,该反应的离子方程式为
,该反应的离子方程式为(4)在处理含砷废水时采用分段式,先向废水中投入生石灰调节pH到2,再投入生石灰将pH调节到8左右,使五价砷以
 的形式沉降。
的形式沉降。①将pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为
②
 在pH调节到8左右才开始沉淀,原因为
在pH调节到8左右才开始沉淀,原因为③砷酸(
 )分步电离的平衡常数(25℃)为
)分步电离的平衡常数(25℃)为 ,
,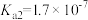
 ,
,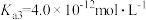 ,第三步电离的平衡常数表达式为
,第三步电离的平衡常数表达式为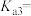
 第一步水解的离子方程式为
第一步水解的离子方程式为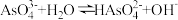 ,该步水解的平衡常数(25℃)为
,该步水解的平衡常数(25℃)为
您最近一年使用:0次
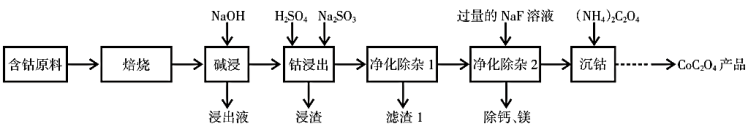
【推荐2】草酸钴用途广泛,用于制指示剂、催化剂及有机合成中间体。利用含钴废料(主要成分为Co2O3,还含有少量的 、
、 、
、 、
、 、
、 、碳及有机物等)制取
、碳及有机物等)制取 的一种工艺流程如下:
的一种工艺流程如下:
已知: 与
与 的化学性质相似。回答下列问题:
的化学性质相似。回答下列问题:
(1)“焙烧”的目的是___________ 。
(2)为提高“碱浸”效率,可采取的措施有___________ ,写出“碱浸”过程中发生的离子反应方程式___________ 。
(3)“钻浸出”过程中 转化为
转化为 ,反应的离子方程式为
,反应的离子方程式为___________ 。
(4)“净化除杂1”过程中,先在35℃左右加入 ,其作用是
,其作用是___________ ;再升温至80℃,加入 溶液,调pH至4.7以上。
溶液,调pH至4.7以上。
(5)为测定产品的纯度,将ag产品用适当试剂转化,得到草酸铵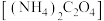 溶液。已知:
溶液。已知: 的
的 ;
; 的
的 ,
, 。
。
①常温时, 溶液pH
溶液pH___________ 7(填“大于”、“小于”或“等于”)。
②将草酸铵溶液用过量稀硫酸酸化,用 溶液滴定,测得平均消耗
溶液滴定,测得平均消耗 溶液20.00mL,则草酸钴样品的纯度为
溶液20.00mL,则草酸钴样品的纯度为___________ 。
 、
、 、
、 、
、 、
、 、碳及有机物等)制取
、碳及有机物等)制取 的一种工艺流程如下:
的一种工艺流程如下:
已知:
 与
与 的化学性质相似。回答下列问题:
的化学性质相似。回答下列问题:(1)“焙烧”的目的是
(2)为提高“碱浸”效率,可采取的措施有
(3)“钻浸出”过程中
 转化为
转化为 ,反应的离子方程式为
,反应的离子方程式为(4)“净化除杂1”过程中,先在35℃左右加入
 ,其作用是
,其作用是 溶液,调pH至4.7以上。
溶液,调pH至4.7以上。(5)为测定产品的纯度,将ag产品用适当试剂转化,得到草酸铵
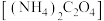 溶液。已知:
溶液。已知: 的
的 ;
; 的
的 ,
, 。
。①常温时,
 溶液pH
溶液pH②将草酸铵溶液用过量稀硫酸酸化,用
 溶液滴定,测得平均消耗
溶液滴定,测得平均消耗 溶液20.00mL,则草酸钴样品的纯度为
溶液20.00mL,则草酸钴样品的纯度为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐3】回答下列问题:
(1)砷酸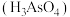 分步电离的平衡常数(25℃)为
分步电离的平衡常数(25℃)为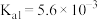 ,
,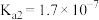 ,
,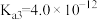 。
。 第一步水解的离子方程式为
第一步水解的离子方程式为___________ ,该步水解的平衡常数(25℃)为___________ 。
(2)以镁铝复合氧化物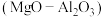 为载体的负载型镍铜双金属催化剂
为载体的负载型镍铜双金属催化剂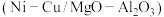 是一种新型高效加氢或脱氢催化剂,其制备流程如下:
是一种新型高效加氢或脱氢催化剂,其制备流程如下:
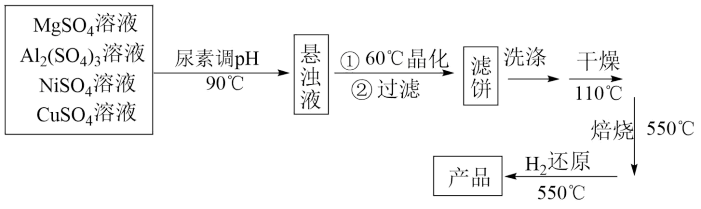
已知:常温下,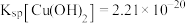 ,
,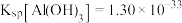 。回答下列问题:
。回答下列问题:
①在加热条件下,尿素 在水中发生水解反应,放出
在水中发生水解反应,放出___________ 和___________ 两种气体(写化学式)。
②“晶化”过程中,需保持恒温60℃,可采用的加热方式为___________
③“洗涤”过程中,检验滤饼是否洗净的方法是___________ 。
④常温下,若“悬浊液”中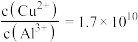 ,则溶液的
,则溶液的
___________ 。
(3)请写出泡沫灭火器灭火的原理___________ (用离子方程式表示)
(1)砷酸
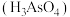 分步电离的平衡常数(25℃)为
分步电离的平衡常数(25℃)为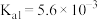 ,
,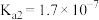 ,
,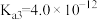 。
。 第一步水解的离子方程式为
第一步水解的离子方程式为(2)以镁铝复合氧化物
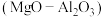 为载体的负载型镍铜双金属催化剂
为载体的负载型镍铜双金属催化剂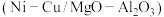 是一种新型高效加氢或脱氢催化剂,其制备流程如下:
是一种新型高效加氢或脱氢催化剂,其制备流程如下:
已知:常温下,
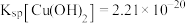 ,
,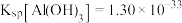 。回答下列问题:
。回答下列问题:①在加热条件下,尿素
 在水中发生水解反应,放出
在水中发生水解反应,放出②“晶化”过程中,需保持恒温60℃,可采用的加热方式为
③“洗涤”过程中,检验滤饼是否洗净的方法是
④常温下,若“悬浊液”中
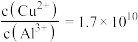 ,则溶液的
,则溶液的
(3)请写出泡沫灭火器灭火的原理
您最近一年使用:0次



