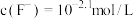常温条件下,0.1 mol/LNaCN溶液与0.05 HCl mol/L溶液等体积混合后,溶液微粒浓度排序正确的是(已知HCN的电离平衡常数 )
)
 )
)A.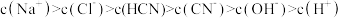 |
B.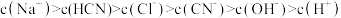 |
C.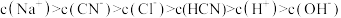 |
D. |
更新时间:2021-11-23 10:10:54
|
相似题推荐
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】Na2CO3溶液(足量)的电解装置图如图所示,下列说法错误的是


A.K闭合后,A电极上发生的电极反应应为4CO +2H2O-4e-=4HCO +2H2O-4e-=4HCO +O2↑ +O2↑ |
| B.a处产生的气体和b处产生的气体的质量比为16∶1 |
C.K未闭合时,左侧电极室溶液中:c(Na+)>c(CO )>c(OH-)>c(HCO )>c(OH-)>c(HCO )>c(H+) )>c(H+) |
| D.当A极室生成1 mol NaHCO3时,B极室NaOH增加1 mol |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】向一定浓度的 和
和 溶液中分别滴加NaOH溶液,
溶液中分别滴加NaOH溶液, 和
和 水溶液中含砷的各微粒分布系数
水溶液中含砷的各微粒分布系数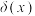 (平衡时某物种浓度占各种物种浓度之和的分数)随pH变化如图所示,下列表述正确的是
(平衡时某物种浓度占各种物种浓度之和的分数)随pH变化如图所示,下列表述正确的是

 和
和 溶液中分别滴加NaOH溶液,
溶液中分别滴加NaOH溶液, 和
和 水溶液中含砷的各微粒分布系数
水溶液中含砷的各微粒分布系数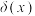 (平衡时某物种浓度占各种物种浓度之和的分数)随pH变化如图所示,下列表述正确的是
(平衡时某物种浓度占各种物种浓度之和的分数)随pH变化如图所示,下列表述正确的是
A.图1中m点: |
B. 的 的 为 为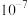 |
C.图2中 时, 时, |
D.把 和 和 的水溶液混合在一起时, 的水溶液混合在一起时, 的 的 会变小 会变小 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐1】一定温度下,0.1mol·L-1Na2CO3水溶液中存在水解平衡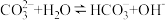 ,下列说法错误的是
,下列说法错误的是
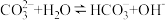 ,下列说法错误的是
,下列说法错误的是| A.通入CO2,溶液pH减小 | B.升高温度,该水解平衡常数增大 |
C.加入NaOH固体, 减小 减小 | D.稀释溶液, 减小 减小 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】下列有关电解质及其溶液的说法正确的是
A.向0.1mol·L-1CH3COOH溶液中加入少量水,溶液中 增大 增大 |
B.将CH3COONa溶液从20℃升温至30℃,溶液中 减小 减小 |
| C.厕所清洁剂、醋、肥皂和厨房清洁剂等物质是按酸碱性的一定顺序依次排列的 |
| D.将AgCl与AgBr的饱和溶液等体积混合,再加入足量浓AgNO3溶液,溶液中会有等物质的量的沉淀生成[已知:Ksp(AgCl)>Ksp(AgBr)] |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐1】pC类似于pH,指极稀溶液中溶质浓度的负对数。如图为25℃时H2CO3溶液中各微粒的pC—pH图(若离子浓度小于10-5mol·L-1,可认为该离子不存在)。下列说法错误的是

A.向Na2CO3溶液中滴加盐酸,溶液中总是存在:c(Na+)+c(H+)=2c(CO )+c(OH-)+c(HCO )+c(OH-)+c(HCO )+c(Cl-) )+c(Cl-) |
B.当c(HCO ):c(H2CO3)=1:1时,此时溶液中H2CO3的电离程度小于HCO ):c(H2CO3)=1:1时,此时溶液中H2CO3的电离程度小于HCO 的水解程度 的水解程度 |
| C.Kal(H2CO3)·Ka2(H2CO3)<Kw |
D.25℃时,0.1mol·L-1Na2CO3和0.1mol·L-1NaHCO3的混合溶液中离子浓度的大小关系为c(Na+)>c(HCO )>c(CO )>c(CO )>c(OH-)>c(H+) )>c(OH-)>c(H+) |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】其他条件不变,升高温度,下列数据不一定增大的是
A. 的水解常数 的水解常数 | B. 电离常数 电离常数 |
C.可逆反应的化学平衡常数 | D.蒸馏水中的 电离度 电离度 |
您最近一年使用:0次


 使
使 和
和 形成氟化物沉淀而分离。测得不同条件下体系中
形成氟化物沉淀而分离。测得不同条件下体系中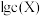 [
[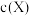 为
为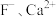 或
或 的物质的量浓度,单位为
的物质的量浓度,单位为 ]与
]与 的关系如下图所示,已知
的关系如下图所示,已知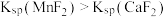 ,下列说法正确的是
,下列说法正确的是
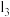 代表
代表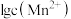
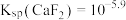
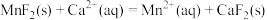 的平衡常数
的平衡常数
 时,
时,