常温下,向100 mL 0.01 mol·L-1HA溶液中逐滴加入0.02 mol·L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计)。下列说法中,不正确 的是
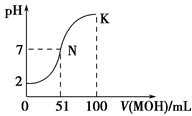

| A.HA为一元强酸 |
| B.MOH为一元弱碱 |
| C.N点水的电离程度小于K点水的电离程度 |
| D.若K点对应溶液的pH=10,则有c(MOH)+c(OH-)-c(H+)=0.005 mol·L-1 |
2013·山东济南·一模 查看更多[9]
上海市宝山中学2022-2023学年高三上学期期中考试化学试题(已下线)第11练 酸碱中和滴定-2022年【寒假分层作业】高二化学(人教版2019选择性必修1)上海市徐汇中学2021-2022学年高三上学期期中考试化学试题上海市嘉定区2021届高三一模化学试题福建省三明市第一中学2017-2018学年高二下学期开学考试化学试题2015-2016学年福建省泉州市四校高二上学期期末化学试卷2016届宁夏银川市第二中学高三上学期统练(三)化学试卷(已下线)2014届贵州省遵义市省级示范高中高三第二次联考理综化学试卷(已下线)2013届山东省济南市高三3月模拟考试理综化学试卷
更新时间:2016-12-09 04:39:17
|
相似题推荐
单选题
|
适中
(0.65)
解题方法
【推荐1】下列有关水的电离平衡或pH变化的判断中,正确的是
| A.随着温度的升高,Kw 减小 |
| B.随着温度的升高,纯水的pH增大 |
| C.向0.1mol/L氨水的平衡体系中加入少量NH4Cl固体,溶液中c(OH-)减小 |
| D.向水中通入少量HCl,水的电离平衡向正反应方向移动,c(H+)增大 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】常温下,将一定浓度的盐酸和醋酸加水稀释,溶液的导电能力随溶液体积变化的曲线如图所示。下列说法正确的是
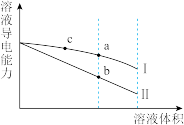

| A.两溶液稀释前的浓度相同 |
| B.a、b、c三点溶液的pH由大到小顺序为b>a>c |
| C.b点的KW值比a点的KW值大 |
| D.a点水电离的n(H+)大于c点水电离的 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐3】常温下浓度均为0.1 mol/L的四种盐溶液,其pH如表所示,下列说法正确的是
| 序号 | ① | ② | ③ | ④ |
| 溶液 | CH3COONa | NaHCO3 | Na2CO3 | NaClO |
| pH | 8.8 | 9.7 | 11.6 | 10.3 |
| A.等浓度的CH3COOH和HClO溶液,pH小的是HClO溶液 |
| B.Na2CO3和NaHCO3溶液中粒子种类不同 |
| C.溶液中水的电离程度:①>②>④>③ |
D.NaHCO3溶液中: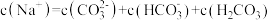 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐1】在25 ℃条件下,下列说法正确的是
| A.100mL 0.1mol/LCH3COONa溶液中,c(Na+)+c(H+)=c(CH3COO- ) |
| B.向水中加入少量固体硫酸氢钠(不考虑温度变化),溶液中c(H+)增大,Kw不变 |
C.向0.1mol/L  溶液中加入少量的水,溶液中 溶液中加入少量的水,溶液中 减小 减小 |
D. 的HA溶液与 的HA溶液与 的NaOH溶液等体积混合,所得溶液pH一定等于7.0 的NaOH溶液等体积混合,所得溶液pH一定等于7.0 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】将 的盐酸平均分成两份,一份加适量水,另一份加入与该盐酸物质的量浓度相同的适量
的盐酸平均分成两份,一份加适量水,另一份加入与该盐酸物质的量浓度相同的适量 溶液,pH都升高了1,则加入的水与
溶液,pH都升高了1,则加入的水与 溶液的体积比为
溶液的体积比为
 的盐酸平均分成两份,一份加适量水,另一份加入与该盐酸物质的量浓度相同的适量
的盐酸平均分成两份,一份加适量水,另一份加入与该盐酸物质的量浓度相同的适量 溶液,pH都升高了1,则加入的水与
溶液,pH都升高了1,则加入的水与 溶液的体积比为
溶液的体积比为A. | B.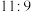 | C.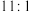 | D. |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】醋酸钡[(CH3COO)2Ba·H2O]是一种媒染剂,下列是有关0.1 mol/L醋酸钡溶液中粒子浓度的比较,其中不正确的是
| A.c(Ba2+)>c(CH3COO-)>c(OH-)>c(H+) |
| B.c(H+)+2c(Ba2+)=c(CH3COO-)+c(OH-) |
| C.c(H+)=c(OH-)-c(CH3COOH) |
| D.2c(Ba2+)=c(CH3COO-)+c(CH3COOH) |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】室温下向10mL0.1mol/LNaOH溶液中加入0.1mol/L的一元酸HA溶液pH的变化曲线如图所示。下列说法正确的是( )
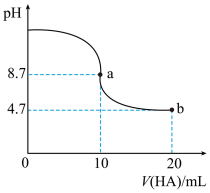

| A.a点所示溶液中c(A-)+c(HA)=0.1mol/L |
| B.a、b两点所示溶液中水的电离程度不同 |
| C.pH=7时,c(Na+)=c(A-)+c(HA) |
| D.b点所示溶液中c(HA)>c(A-) |
您最近一年使用:0次

 )+c(HCO
)+c(HCO )+c(H2CO3)
)+c(H2CO3) )也相等
)也相等


