锑(Sb)常用作阻燃剂、电极材料、催化剂等物质的原材料。一种以辉锑矿(主要成分为Sb2S3,还含有Fe2O3、Al2O3、MgO、SiO2等)为原料提取锑的工艺如图:
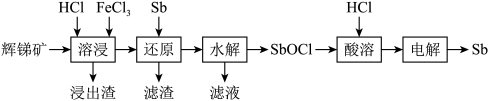
已知:溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
回答下列问题:
(1)“溶浸”时氧化产物是S,Sb2S3被氧化的化学方程式为____ 。
(2)“水解”时需控制溶液pH=2.5。
①Sb3+发生水解的离子方程式为____ 。
②下列能促进该水解反应的措施有____ (填字母)。
A.升高温度 B.增大c(H+) C.增大c(Cl-) D.加入Na2CO3粉末
③为避免水解产物中混入Fe(OH)3,Fe3+浓度应小于____ mol•L-1。
(3)“滤液”中含有的金属阳离子有____ 。向“滤液”中通入足量____ (填化学式)气体,再将滤液pH调至3.5,可析出Fe(OH)3沉淀。
(4)Sb可由SbCl 电解制得,阴极的电极反应式为
电解制得,阴极的电极反应式为____ 。

已知:溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
| 金属离子 | Fe3+ | Al3+ | Fe2+ | Mg2+ |
| 开始沉淀时(c=0.01mol•L-1)的pH | 2.2 | 3.7 | 7.5 | 9.6 |
| 完全沉淀时(c=1.0×10-5mol•L-1)的pH | 3.2 | 4.7 | 9.0 | 11.1 |
(1)“溶浸”时氧化产物是S,Sb2S3被氧化的化学方程式为
(2)“水解”时需控制溶液pH=2.5。
①Sb3+发生水解的离子方程式为
②下列能促进该水解反应的措施有
A.升高温度 B.增大c(H+) C.增大c(Cl-) D.加入Na2CO3粉末
③为避免水解产物中混入Fe(OH)3,Fe3+浓度应小于
(3)“滤液”中含有的金属阳离子有
(4)Sb可由SbCl
 电解制得,阴极的电极反应式为
电解制得,阴极的电极反应式为
更新时间:2022-11-01 10:06:29
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
名校
【推荐1】从铝土矿(主要成分为A12O3,还含有少量SiO2、Fe2O3,等杂质)中提取A12O3并生产AlN的工艺流程如下:
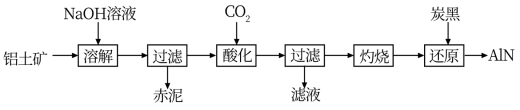
注:SiO2在NaOH“溶解”时转化为铝硅酸钠沉淀
回答下列问题:
(1)赤泥的主要成分为_______ (填化学式)。
(2)“酸化”时通入过量CO2的离子方程式_______ 。
(3)“还原”时,炭黑在高温下被氧化为CO,反应的化学方程式为_______ 。
(4)将铝粉和氧化铁 的混合物点燃,反应放出大量的热量,称为铝热反应。该反应在生活中常被用于_______ 。

注:SiO2在NaOH“溶解”时转化为铝硅酸钠沉淀
回答下列问题:
(1)赤泥的主要成分为
(2)“酸化”时通入过量CO2的离子方程式
(3)“还原”时,炭黑在高温下被氧化为CO,反应的化学方程式为
(4)将铝粉和
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐2】如图是中学化学中常见物质的转化关系。E为红棕色气体,单质G可被磁铁吸引, 和
和 的浓溶液靠近会出现白烟。
的浓溶液靠近会出现白烟。
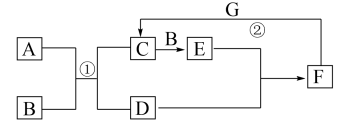
回答下列问题:
(1)D的电子式为_____ ,C的化学式是_____ 。
(2)实验室中常将F的浓溶液保存在_____ 色细口瓶中并置于阴凉处。用化学方程式解释原因______ 。
(3)过量G发生反应②后,向溶液中加入足量氢氧化钠溶液,现象为_____ 。
(4)为防止E污染环境,可用CH4与其反应生成无污染气体和水,写出该反应的化学方程式______ 。
 和
和 的浓溶液靠近会出现白烟。
的浓溶液靠近会出现白烟。
回答下列问题:
(1)D的电子式为
(2)实验室中常将F的浓溶液保存在
(3)过量G发生反应②后,向溶液中加入足量氢氧化钠溶液,现象为
(4)为防止E污染环境,可用CH4与其反应生成无污染气体和水,写出该反应的化学方程式
您最近一年使用:0次
【推荐3】从废钼催化剂(主要成分为MoO3、MoS2,含少量NiS、NiO、Fe2O3等)中回收利用有价金属的一种工艺流程如图所示。
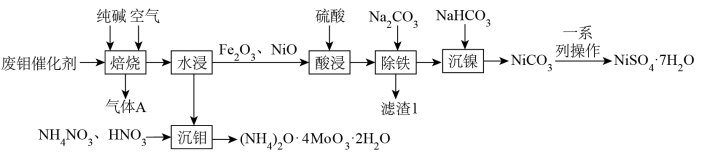
已知:①“沉钼”前钼元素主要以 形式存在。
形式存在。
②该条件下Ksp(NiCO3)=1.5×10-7。
③温度低于20℃时,以NiSO4·7H2O形式结晶;温度高于30℃,以NiSO4·6H2O形式结晶。
请回答下列问题:
(1)“焙烧”时将纯碱和废钼催化剂磨成粉末后采取如图所示的“多层逆流焙烧”,其目的是____________________ ; “焙烧”时产生的气体A主要成分有__________ (填化学式)。

(2)实验室检验滤渣1中含有三价铁元素的操作方法是____________________ 。
(3)若“除铁”后所得滤液中c(Ni2+)=1.0mol·L-1,“沉镍”后所得滤液中c( )=1.0×10-5mol·L-1,则沉镍率=
)=1.0×10-5mol·L-1,则沉镍率=__________ [沉镍率= ,计算过程中不考虑溶液体积变化]。
,计算过程中不考虑溶液体积变化]。
(4)“沉钼”时的离子方程式为____________________ 。
(5)将“一系列操作”的下列实验步骤补充完整:
i.向NiCO3中滴加稀硫酸直至恰好完全溶解;
ii.蒸发浓缩、__________ ,过滤、洗涤得NiSO4·7H2O晶体。

已知:①“沉钼”前钼元素主要以
 形式存在。
形式存在。②该条件下Ksp(NiCO3)=1.5×10-7。
③温度低于20℃时,以NiSO4·7H2O形式结晶;温度高于30℃,以NiSO4·6H2O形式结晶。
请回答下列问题:
(1)“焙烧”时将纯碱和废钼催化剂磨成粉末后采取如图所示的“多层逆流焙烧”,其目的是

(2)实验室检验滤渣1中含有三价铁元素的操作方法是
(3)若“除铁”后所得滤液中c(Ni2+)=1.0mol·L-1,“沉镍”后所得滤液中c(
 )=1.0×10-5mol·L-1,则沉镍率=
)=1.0×10-5mol·L-1,则沉镍率= ,计算过程中不考虑溶液体积变化]。
,计算过程中不考虑溶液体积变化]。(4)“沉钼”时的离子方程式为
(5)将“一系列操作”的下列实验步骤补充完整:
i.向NiCO3中滴加稀硫酸直至恰好完全溶解;
ii.蒸发浓缩、
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】下表为25℃的三种弱酸的电离平衡常数:
回答下列问题:
(1)用离子方程式表示NaNO2溶液呈碱性的原因_________________________ 。
(2)A-、CO32-、HCO3-在水中结合H+的能力由大到小的顺序为_______________ 。
(3)写出NaA溶液中通少量CO2的离子方程式____________________ 。
(4)现有Na2CO3和NaHCO3两种白色固体物质,欲探究Na2CO3和NaHCO3稳定性的相对强弱,设计了以下实验:
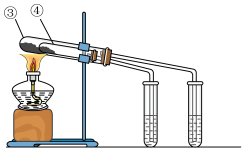
①如上图所示,试管④中装入的固体应该是_________ (填化学式)。
②通过上述实验,得出的结论是:Na2CO3比NaHCO3的稳定性更_______ (填“强”或“弱”)。
| 化学式 | HA(A代表某种酸根) | HNO2 | H2CO3 |
| Ka | Ka=4.9×10-10 | Ka=4.6×10-4 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
回答下列问题:
(1)用离子方程式表示NaNO2溶液呈碱性的原因
(2)A-、CO32-、HCO3-在水中结合H+的能力由大到小的顺序为
(3)写出NaA溶液中通少量CO2的离子方程式
(4)现有Na2CO3和NaHCO3两种白色固体物质,欲探究Na2CO3和NaHCO3稳定性的相对强弱,设计了以下实验:

①如上图所示,试管④中装入的固体应该是
②通过上述实验,得出的结论是:Na2CO3比NaHCO3的稳定性更
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐2】有A、B、C、D四种强电解质,它们在水中电离时可产生下列离子(每种物质只含一种阳离子和一种阴离子且互不重复)。
已知:①A、C溶液的pH均大于7,B溶液的pH小于7,A、B溶液中水的电离程度相同;D物质的焰色反应呈黄色;②C溶液和D溶液相遇时只生成白色沉淀,B溶液和C溶液相遇时只生成有刺激性气味的气体,A溶液和D溶液混合时无明显现象。
(1)A的名称是_______ B的化学式_______
(2)写出C溶液和D溶液反应的化学方程式___________
(3)25 ℃时,pH=9的A溶液和pH=9的C溶液中水的电离程度小的是___ (填A或C)。
(4) A溶液的pH大于7,用离子方程式表示原因______ 。
| 阳离子 | K+、Na+、Ba2+、NH |
| 阴离子 | CH3COO-、Cl-、OH-、SO |
(1)A的名称是
(2)写出C溶液和D溶液反应的化学方程式
(3)25 ℃时,pH=9的A溶液和pH=9的C溶液中水的电离程度小的是
(4) A溶液的pH大于7,用离子方程式表示原因
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】常温下,有两种溶液:①0.1 mol·L−1 CH3COOH溶液 ②0.1 mol·L−1 CH3COONa溶液。
(1)溶液①的pH______ 7(填“大于”、“小于”或“等于”),醋酸电离平衡常数Ka=____________ (表达式)。
(2)溶液①②等体积混合后溶液呈______ 性,混合溶液的物料守恒关系为:________________________________ 。
(3)下列说法正确的是________ (填序号)。
a.两种溶液中c(CH3COO−)都小于0.1 mol·L−1
b.两种溶液中c(CH3COO−)都等于0.1 mol·L−1
c.CH3COOH溶液中c(CH3COO−)小于CH3COONa溶液中c(CH3COO−)
(1)溶液①的pH
(2)溶液①②等体积混合后溶液呈
(3)下列说法正确的是
a.两种溶液中c(CH3COO−)都小于0.1 mol·L−1
b.两种溶液中c(CH3COO−)都等于0.1 mol·L−1
c.CH3COOH溶液中c(CH3COO−)小于CH3COONa溶液中c(CH3COO−)
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】为回收利用废镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等),科研人员研制了一种回收镍的新工艺。工艺流程如图所示:

已知:①常温下,有关氢氧化物开始沉淀和沉淀完全的pH如下表所示:
②常温下,Ksp(CaF2)=2.7×10-11。请回答下列问题:
(1)加快酸浸速率的常用措施有______________ (任写一条即可得分)。
(2)“浸出渣”主要成分为CaSO4·2H2O和______ 两种物质。
(3)“操作B”的过程是,先在40~50℃加入H2O2,其作用是_______________ (用离子方程式表示);再调pH至3.7~7.7,操作B可除去溶液中的____ (填元素名称)元素。
(4)操作C可除去溶液中的Ca2+,若控制溶液中F-,浓度为3.0×10-3mol·L-1,则溶液中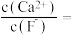
____ 。
(5)在碱性条件下,电解产生2NiOOH·H2O的原理分两步:
①Cl-在阳极被氧化为ClO-,则阳极的电极反应为____________ 。
②Ni2+被ClO-氧化产生2NiOOH·H2O沉淀,则该步反应的离子方程式为______________________ 。

已知:①常温下,有关氢氧化物开始沉淀和沉淀完全的pH如下表所示:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.7 |
| 沉淀完全的pH | 3.7 | 9.7 | 9.2 |
②常温下,Ksp(CaF2)=2.7×10-11。请回答下列问题:
(1)加快酸浸速率的常用措施有
(2)“浸出渣”主要成分为CaSO4·2H2O和
(3)“操作B”的过程是,先在40~50℃加入H2O2,其作用是
(4)操作C可除去溶液中的Ca2+,若控制溶液中F-,浓度为3.0×10-3mol·L-1,则溶液中
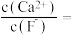
(5)在碱性条件下,电解产生2NiOOH·H2O的原理分两步:
①Cl-在阳极被氧化为ClO-,则阳极的电极反应为
②Ni2+被ClO-氧化产生2NiOOH·H2O沉淀,则该步反应的离子方程式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】碱式碳酸铜可用作有机催化剂。工业上以辉铜矿(主要成分为 ,含
,含 及少量
及少量 )为原料制备碱式碳酸铜,工业流程如下:
)为原料制备碱式碳酸铜,工业流程如下:
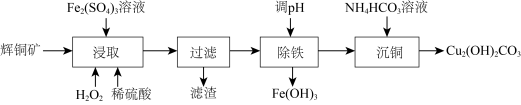
(1)滤渣可能含S、___________ (填化学式)。
(2)①“浸取”时能提高辉铜矿Cu浸取率的措施有___________ (填2条)。
②某小组测得Cu浸取率随 浓度及温度影响的变化曲线如下:
浓度及温度影响的变化曲线如下:

a.由图一可知 适宜的浓度范围为
适宜的浓度范围为___________ ;由图一中的a点分析,浸取时 也起到了氧化辉铜矿的作用,该反应的离子方程式为
也起到了氧化辉铜矿的作用,该反应的离子方程式为___________ 。
b.图二中高于85℃时Cu浸取率下降的原因是___________ 。
(3)“除铁”步骤调pH可加入试剂___________ (填选项字母);
a.氨气 b. c.
c. d.
d.
(4)常温下,“过滤”后的滤液中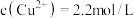 ,则“除铁”步骤调pH应小于
,则“除铁”步骤调pH应小于___________ 。[常温下, ]。
]。
 ,含
,含 及少量
及少量 )为原料制备碱式碳酸铜,工业流程如下:
)为原料制备碱式碳酸铜,工业流程如下:
(1)滤渣可能含S、
(2)①“浸取”时能提高辉铜矿Cu浸取率的措施有
②某小组测得Cu浸取率随
 浓度及温度影响的变化曲线如下:
浓度及温度影响的变化曲线如下:
a.由图一可知
 适宜的浓度范围为
适宜的浓度范围为 也起到了氧化辉铜矿的作用,该反应的离子方程式为
也起到了氧化辉铜矿的作用,该反应的离子方程式为b.图二中高于85℃时Cu浸取率下降的原因是
(3)“除铁”步骤调pH可加入试剂
a.氨气 b.
 c.
c. d.
d.
(4)常温下,“过滤”后的滤液中
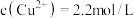 ,则“除铁”步骤调pH应小于
,则“除铁”步骤调pH应小于 ]。
]。
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】锌及锌合金(如黄铜)广泛应用于生产、生活。某小组拟以锌矿(主要成分是ZnS,含少量FeS等杂质)为原料采用多种方法,最终电解 溶液冶炼锌,流程如图。回答下列问题:
溶液冶炼锌,流程如图。回答下列问题: 是两性氢氧化物,易溶于NaOH溶液,也溶于氨水,能发生反应:
是两性氢氧化物,易溶于NaOH溶液,也溶于氨水,能发生反应:
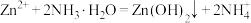
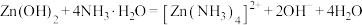 。
。
②常温下,几种金属离子转化成氢氧化物沉淀的pH如表:
(1)已知Zn与S元素的电负性差值为0.93,则两者间更趋向形成________ 键(填“共价”或“离子”)。
(2)已知 的部分结构如图所示,
的部分结构如图所示, 中
中 采用
采用 杂化,则
杂化,则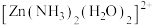 有
有________ 种结构。 分子中的H-N-H键角比
分子中的H-N-H键角比 中的小的原因是
中的小的原因是________ 。 ,除生成
,除生成 外,还能回收非金属单质。ZnS参与反应的离子方程式为
外,还能回收非金属单质。ZnS参与反应的离子方程式为________ 。
(4)“氧化,调pH”时试剂A不宜选择NaOH溶液,也不宜选择氨水,原因是________ 。
(5)通常认为离子浓度 时表示该离子已完全除尽。根据表格数据计算
时表示该离子已完全除尽。根据表格数据计算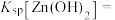
________ 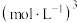 。
。
(6)立方ZnS的晶胞结构如图(a为S、b为Zn),S的配位数为________ ;设阿伏加德罗常数的值为 ,晶胞棱长为xpm,则ZnS晶胞的密度为
,晶胞棱长为xpm,则ZnS晶胞的密度为________  (列出计算表达式)。
(列出计算表达式)。
 溶液冶炼锌,流程如图。回答下列问题:
溶液冶炼锌,流程如图。回答下列问题:
 是两性氢氧化物,易溶于NaOH溶液,也溶于氨水,能发生反应:
是两性氢氧化物,易溶于NaOH溶液,也溶于氨水,能发生反应: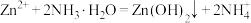
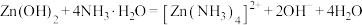 。
。②常温下,几种金属离子转化成氢氧化物沉淀的pH如表:
| 金属离子 | 开始沉淀的pH | 完全沉淀的pH |
 | 6.5 | 9.7 |
 | 5.4 | 8.0 |
 | 2.3 | 4.1 |
(1)已知Zn与S元素的电负性差值为0.93,则两者间更趋向形成
(2)已知
 的部分结构如图所示,
的部分结构如图所示, 中
中 采用
采用 杂化,则
杂化,则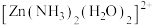 有
有 分子中的H-N-H键角比
分子中的H-N-H键角比 中的小的原因是
中的小的原因是
 ,除生成
,除生成 外,还能回收非金属单质。ZnS参与反应的离子方程式为
外,还能回收非金属单质。ZnS参与反应的离子方程式为(4)“氧化,调pH”时试剂A不宜选择NaOH溶液,也不宜选择氨水,原因是
(5)通常认为离子浓度
 时表示该离子已完全除尽。根据表格数据计算
时表示该离子已完全除尽。根据表格数据计算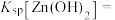
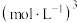 。
。(6)立方ZnS的晶胞结构如图(a为S、b为Zn),S的配位数为
 ,晶胞棱长为xpm,则ZnS晶胞的密度为
,晶胞棱长为xpm,则ZnS晶胞的密度为 (列出计算表达式)。
(列出计算表达式)。
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】已知碳酸氢钠的溶解度较小。在饱和氯化钠溶液中通入二氧化碳和氨气,可析出碳酸氢钠固体。某学习小组制备少量 的流程如下:
的流程如下:
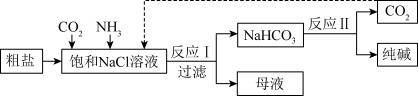
(1)粗盐中含有大量的NaCl,以及少量的 、
、 、
、 等离子。为得到纯净的饱和NaCl溶液,对粗盐溶液进行了如下操作。下列操作步骤排序不合理的是___________(填正确答案标号)
等离子。为得到纯净的饱和NaCl溶液,对粗盐溶液进行了如下操作。下列操作步骤排序不合理的是___________(填正确答案标号)
a.加入过量的氢氧化钠溶液;
b.加入过量的碳酸钠溶液;
c.加入过量的氯化钡溶液;
d.加入足量的稀盐酸;
e.过滤;
f.加热煮沸一段时间,得到饱和NaCl溶液。
(2)向“饱和NaCl溶液”通入 和
和 的顺序是先通入
的顺序是先通入___________ ,后通入___________ 。
(3)过滤用到的玻璃仪器除烧杯和玻璃棒外,还需要___________ 。
(4)反应Ⅰ的化学方程式为___________ 。
(5)纯碱和小苏打都是白色固体,下列区分这两种物质的方法正确的是___________。(填正确答案标号)
(6)“过滤”后的母液中最主要的成分是___________ (填写化学式)。检验这一成分中的阳离子的具体方法是___________ 。
 的流程如下:
的流程如下:
(1)粗盐中含有大量的NaCl,以及少量的
 、
、 、
、 等离子。为得到纯净的饱和NaCl溶液,对粗盐溶液进行了如下操作。下列操作步骤排序不合理的是___________(填正确答案标号)
等离子。为得到纯净的饱和NaCl溶液,对粗盐溶液进行了如下操作。下列操作步骤排序不合理的是___________(填正确答案标号)a.加入过量的氢氧化钠溶液;
b.加入过量的碳酸钠溶液;
c.加入过量的氯化钡溶液;
d.加入足量的稀盐酸;
e.过滤;
f.加热煮沸一段时间,得到饱和NaCl溶液。
| A.acbedf | B.cabedf | C.acbdef | D.cbaedf |
 和
和 的顺序是先通入
的顺序是先通入(3)过滤用到的玻璃仪器除烧杯和玻璃棒外,还需要
(4)反应Ⅰ的化学方程式为
(5)纯碱和小苏打都是白色固体,下列区分这两种物质的方法正确的是___________。(填正确答案标号)
| A.分别用炒锅加热两种样品,全部分解挥发,没有残留物的是小苏打 |
| B.用洁净铁丝蘸取两种样品在煤气火焰上灼烧,使火焰颜色发生明显变化的是小苏打 |
| C.用两只小玻璃杯,分别加入等量的两种样品,再逐滴加入食醋,产生气泡快的是小苏打 |
| D.先将两种样品配成溶液,分别加入足量石灰水,无白色沉淀生成的是小苏打 |
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】Ⅰ.高锰酸钾生产过程中会产生较多的废锰渣,工业上将废锰渣(含MnO2及少量KOH、MgO、Fe2O3)再利用,以它为原料来制备MnSO4·H2O。请回答下列问题:
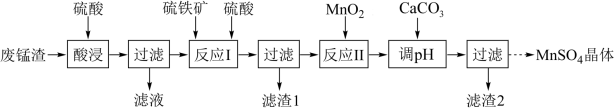
已知:反应Ⅰ的离子方程式为:MnO2 + FeS2 + 4H+ = 2S + Mn2+ + Fe2+ + 2H2O
(1)为提高酸浸过程中浸出率,实验中可采取的措施有___________ 、___________ (任写两种)。
(2)已知:室温下Ksp[Fe(OH)2]=4.9×10-17,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Mn(OH)2]=2×10-13,反应Ⅱ后溶液中c(Mn2+)=0.2mol·L-1。
①反应Ⅱ中MnO2的作用是___________ 。
②欲使溶液中c(Fe3+)<10-5mol·L-1,“调pH”过程需控制溶液pH的范围是___________ 。
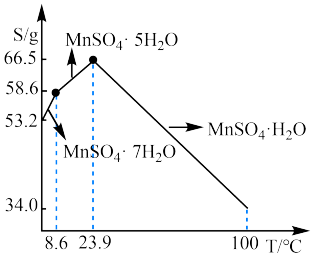
(3)已知硫酸锰在不同温度下的溶解度和析出晶体的组成如图所示。从滤液制取较多MnSO4·H2O的操作是:控制温度在80~90℃之间,然后___________ 、___________ ,使固体MnSO4·H2O与溶液分离;获得的MnSO4·H2O晶体常用酒精洗涤,优点是___________ 。
(4)测定产品纯度。
①取制得的MnSO4晶体0.3020g,溶于适量水中,加硫酸酸化;
②用过量NaBiO3(难溶于水)将Mn2+完全氧化为MnO ,过滤、洗涤;
,过滤、洗涤;
③将几次洗涤的滤液与过滤所得的滤液合并,向其中加入Na2C2O4固体1.072g,充分反应;
④再用0.0320mol·L-1 KMnO4溶液滴定步骤③反应后的溶液,用去40.00mL。
已知:C2O + MnO
+ MnO →CO2 + Mn2+(未配平)。
→CO2 + Mn2+(未配平)。
a.用KMnO4溶液滴定时,滴定终点的现象为___________ 。
b.计算产品中MnSO4的质量分数___________ 。
Ⅱ.某实验小组为检验MnSO4受热分解是否生成SO2或SO3,设计探究实验装置如图所示:
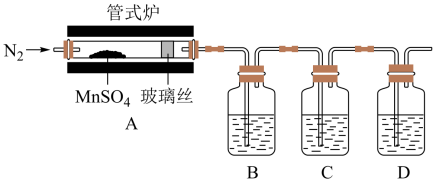
(5)装置B、C、D中的溶液依次为___________ (填字母)。
a.Ba(NO3)2 b.BaCl2 c.品红 d.浓硫酸 e.Ca(OH)2 f.NaOH
(6)实验结束时,为防止倒吸,正确的操作方法是___________ 。

已知:反应Ⅰ的离子方程式为:MnO2 + FeS2 + 4H+ = 2S + Mn2+ + Fe2+ + 2H2O
(1)为提高酸浸过程中浸出率,实验中可采取的措施有
(2)已知:室温下Ksp[Fe(OH)2]=4.9×10-17,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Mn(OH)2]=2×10-13,反应Ⅱ后溶液中c(Mn2+)=0.2mol·L-1。
①反应Ⅱ中MnO2的作用是
②欲使溶液中c(Fe3+)<10-5mol·L-1,“调pH”过程需控制溶液pH的范围是
(3)已知硫酸锰在不同温度下的溶解度和析出晶体的组成如图所示。从滤液制取较多MnSO4·H2O的操作是:控制温度在80~90℃之间,然后

(4)测定产品纯度。
①取制得的MnSO4晶体0.3020g,溶于适量水中,加硫酸酸化;
②用过量NaBiO3(难溶于水)将Mn2+完全氧化为MnO
 ,过滤、洗涤;
,过滤、洗涤;③将几次洗涤的滤液与过滤所得的滤液合并,向其中加入Na2C2O4固体1.072g,充分反应;
④再用0.0320mol·L-1 KMnO4溶液滴定步骤③反应后的溶液,用去40.00mL。
已知:C2O
 + MnO
+ MnO →CO2 + Mn2+(未配平)。
→CO2 + Mn2+(未配平)。a.用KMnO4溶液滴定时,滴定终点的现象为
b.计算产品中MnSO4的质量分数
Ⅱ.某实验小组为检验MnSO4受热分解是否生成SO2或SO3,设计探究实验装置如图所示:

(5)装置B、C、D中的溶液依次为
a.Ba(NO3)2 b.BaCl2 c.品红 d.浓硫酸 e.Ca(OH)2 f.NaOH
(6)实验结束时,为防止倒吸,正确的操作方法是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】间溴苯甲醛(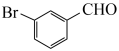 ),是香料、染料、有机合成中间体,常温比较稳定,高温易被氧化。相关物质的沸点如下(101kPa)。
),是香料、染料、有机合成中间体,常温比较稳定,高温易被氧化。相关物质的沸点如下(101kPa)。
其实验装置与制备步骤如下:
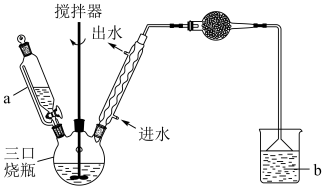
步骤1:将三颈瓶中的一定配比的无水AlCl3(作催化剂)、1,2-二氯乙烷和5.3g苯甲醛充分混合后,升温至60℃,缓慢滴加经浓硫酸干燥过的足量液溴,保温反应一段时间,冷却。
步骤2:将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液。有机相用10%NaHCO3溶液洗涤后再水洗。
步骤3:经洗涤的有机相加入适量无水MgSO4固体,放置一段时间后过滤。
步骤4:减压蒸馏收集122~124℃的馏分。
回答下列问题:
(1)仪器a的名称为___________ ,其作用为___________ ;
(2)实验装置中冷凝管的主要作用是冷凝回流,要进行冷凝回流的原因是___________ ;
(3)步骤1反应方程式为___________ 。
(4)步骤2中使用稀盐酸的目的主要是为了除去___________ ,10%NaHCO3溶液洗涤有机相,是为了除去溶于有机相的___________ (填化学式)。
(5)步骤4中采用减压蒸馏技术,是为了防止___________ 。
(6)若实验得到3.7g间溴苯甲醛,则间溴苯甲醛产率为___________ 。
 ),是香料、染料、有机合成中间体,常温比较稳定,高温易被氧化。相关物质的沸点如下(101kPa)。
),是香料、染料、有机合成中间体,常温比较稳定,高温易被氧化。相关物质的沸点如下(101kPa)。| 物质 | 溴 | 苯甲醛 | 1,2-二氯乙烷 | 间溴苯甲醛 | 无水AlCl3 |
| 沸点/℃ | 58.8 | 179 | 83.5 | 229 | 178 |
| 溶解性 | 微溶于水 | 微溶于水 | 难溶于水 | 难溶于水 | 遇水水解 |
| 相对分子质量 | 160 | 106 | ___________ | 185 | ___________ |

步骤1:将三颈瓶中的一定配比的无水AlCl3(作催化剂)、1,2-二氯乙烷和5.3g苯甲醛充分混合后,升温至60℃,缓慢滴加经浓硫酸干燥过的足量液溴,保温反应一段时间,冷却。
步骤2:将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液。有机相用10%NaHCO3溶液洗涤后再水洗。
步骤3:经洗涤的有机相加入适量无水MgSO4固体,放置一段时间后过滤。
步骤4:减压蒸馏收集122~124℃的馏分。
回答下列问题:
(1)仪器a的名称为
(2)实验装置中冷凝管的主要作用是冷凝回流,要进行冷凝回流的原因是
(3)步骤1反应方程式为
(4)步骤2中使用稀盐酸的目的主要是为了除去
(5)步骤4中采用减压蒸馏技术,是为了防止
(6)若实验得到3.7g间溴苯甲醛,则间溴苯甲醛产率为
您最近一年使用:0次



