转化 的方法主要有电催化、热还原等。
的方法主要有电催化、热还原等。
(1) 电催化制CO。在电解过程中向电解质中加入离子导体(
电催化制CO。在电解过程中向电解质中加入离子导体( )可以提高CO的选择性(CO是指
)可以提高CO的选择性(CO是指 转化生成CO的百分比,下同)。
转化生成CO的百分比,下同)。
①离子导体M中含有H、B、C、N、F等元素,其中B、C、N、F四种元素的第一电离能由小到大的顺序为_______ 。 的空间构型是
的空间构型是_______ 。
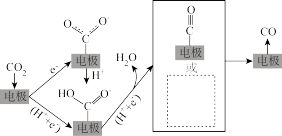
②电催化还原 制CO的示意图如下图所示。请在虚线框中画出还有可能得到的中间体的结构示意图
制CO的示意图如下图所示。请在虚线框中画出还有可能得到的中间体的结构示意图_______ 。
(2) 热还原制
热还原制 和CO。在常压、
和CO。在常压、 催化下,
催化下, 和
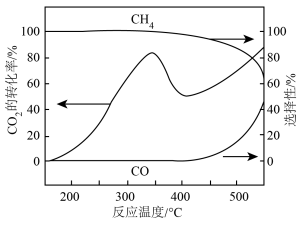
和 混和气体(体积比1:4)进行反应,测得
混和气体(体积比1:4)进行反应,测得 转化率、
转化率、 和CO的选择性随温度变化如图所示。
和CO的选择性随温度变化如图所示。
反应I:

反应II:

①400℃后,随温度升高 转化率不断上升的原因是
转化率不断上升的原因是_______ 。
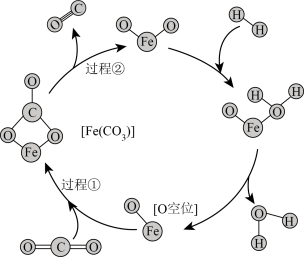
②反应II中 和
和 在
在 (存在O空位)催化剂的作用下,可以提高CO的选择性,反应机理如图所示。从电负性的角度,过程①和②能发生的原因是
(存在O空位)催化剂的作用下,可以提高CO的选择性,反应机理如图所示。从电负性的角度,过程①和②能发生的原因是_______ 。
 的方法主要有电催化、热还原等。
的方法主要有电催化、热还原等。(1)
 电催化制CO。在电解过程中向电解质中加入离子导体(
电催化制CO。在电解过程中向电解质中加入离子导体( )可以提高CO的选择性(CO是指
)可以提高CO的选择性(CO是指 转化生成CO的百分比,下同)。
转化生成CO的百分比,下同)。①离子导体M中含有H、B、C、N、F等元素,其中B、C、N、F四种元素的第一电离能由小到大的顺序为
 的空间构型是
的空间构型是②电催化还原
 制CO的示意图如下图所示。请在虚线框中画出还有可能得到的中间体的结构示意图
制CO的示意图如下图所示。请在虚线框中画出还有可能得到的中间体的结构示意图
(2)
 热还原制
热还原制 和CO。在常压、
和CO。在常压、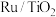 催化下,
催化下, 和
和 混和气体(体积比1:4)进行反应,测得
混和气体(体积比1:4)进行反应,测得 转化率、
转化率、 和CO的选择性随温度变化如图所示。
和CO的选择性随温度变化如图所示。
反应I:


反应II:


①400℃后,随温度升高
 转化率不断上升的原因是
转化率不断上升的原因是②反应II中
 和
和 在
在 (存在O空位)催化剂的作用下,可以提高CO的选择性,反应机理如图所示。从电负性的角度,过程①和②能发生的原因是
(存在O空位)催化剂的作用下,可以提高CO的选择性,反应机理如图所示。从电负性的角度,过程①和②能发生的原因是
22-23高三上·江苏连云港·期中 查看更多[2]
更新时间:2022-11-11 08:22:48
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】工业上可通过煤的液化合成甲醇,主反应为:
CO(g)+2H2(g) CH3OH(1)△H=xkJ/mol
CH3OH(1)△H=xkJ/mol
(1)已知常温下CH3OH(1)、H2和CO的燃烧热分别为726.5kJ/mol、285.5kJ/mol、283.0kJ/mol,则x=___________ ;为提高合成甲醇反应的选择性,关键因素是___________ 。
(2)TK下,在容积为1.00L的某密闭容器中进行反应CO(g)+2H2(g) CH3OH(g)△H<0,相关数据如图。
CH3OH(g)△H<0,相关数据如图。
①该反应0~10min的平均速率υ(H2)___________ mol/(L·min);M和N点的逆反应速率较大的是___________ (填“υ逆(M)”、“υ逆(N)”或“不能确定”)。
②10min时容器内CO的体积分数为___________ 。
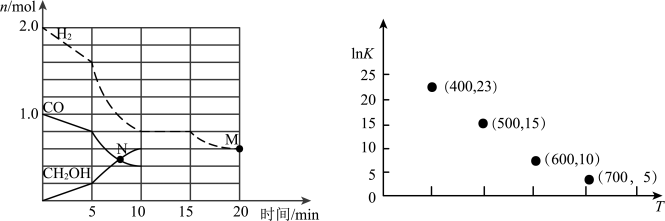
③对于气相反应,常用某组分(B)的平衡压强(PB)代替物质的量浓度(cB)表示平衡常数(以Kp表示),其中PB=P总×B的体积分数。若在TK下平衡气体总压强为xMPa,则该反应的平衡常数Kp=___________ (写出表达式,不必化简)。实验测得不同温度下的lnKp(化学平衡常数Kp的自然对数)如图,请分析lnKp随T呈现上述变化趋势的原因______________________ 。
CO(g)+2H2(g)
 CH3OH(1)△H=xkJ/mol
CH3OH(1)△H=xkJ/mol(1)已知常温下CH3OH(1)、H2和CO的燃烧热分别为726.5kJ/mol、285.5kJ/mol、283.0kJ/mol,则x=
(2)TK下,在容积为1.00L的某密闭容器中进行反应CO(g)+2H2(g)
 CH3OH(g)△H<0,相关数据如图。
CH3OH(g)△H<0,相关数据如图。①该反应0~10min的平均速率υ(H2)
②10min时容器内CO的体积分数为

③对于气相反应,常用某组分(B)的平衡压强(PB)代替物质的量浓度(cB)表示平衡常数(以Kp表示),其中PB=P总×B的体积分数。若在TK下平衡气体总压强为xMPa,则该反应的平衡常数Kp=
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】氯化亚砜(SOCl2)在科研和工业上应用比较广泛。回答下列问题:
I.工业上利用尾气SO2与SCl2、Cl2反应合成氯化亚砜。发生如下反应:
①Cl2(g)+SO2(g) SO2Cl2(g) △H =-471.7kJ•mol-1
SO2Cl2(g) △H =-471.7kJ•mol-1
②SO2Cl2(g)+SCl2(g) 2SOCl2(g) △H=-5.6kJ•mol-1
2SOCl2(g) △H=-5.6kJ•mol-1
567K时,在10L密闭容器中,充入一定量的Cl2、SO2和SCl2,测得初始压强为P0反应过程中容器内总压强(P)随时间(t)变化(反应达到平衡时的温度与起始温度相同)如图所示,起始各组分及达平衡时SO2Cl2(g)的物质的量如表。
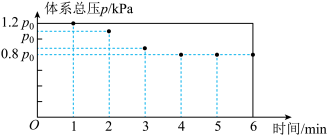
(1)图中数据显示0~l min体系压强增大的原因是____ 。
(2)反应①、②达到平衡时,SCl2的转化率为__ 。
(3)pK=-lgK,567K时,上述反应②的pK=___ (结果保留两位有效数字,已知lg2=0.30)。
(4)567K下,若压缩容器体积为5L,则平衡时c(SO2)__ (填“大于” “小于”或“等于”)上述反应平衡时的c(SO2)。
II.氯化亚砜常用于合成正丁酰氯。向连有尾气吸收装置的容器中按照物质的量1:1.5投料比加入正丁酸和氯化亚砜,反应为CH3CH2CH2COOH+SOCl2 CH3CH2CH2COCl+SO2↑+HCl↑。实验测得温度和时间对反应的影响如表:
CH3CH2CH2COCl+SO2↑+HCl↑。实验测得温度和时间对反应的影响如表:
(5)若开始在较高温度下反应,则会放出大量气体。通过分析上表数据,选择合理实验方法的序号为___ 。说明你选用实验方法的理由:____ 。
I.工业上利用尾气SO2与SCl2、Cl2反应合成氯化亚砜。发生如下反应:
①Cl2(g)+SO2(g)
 SO2Cl2(g) △H =-471.7kJ•mol-1
SO2Cl2(g) △H =-471.7kJ•mol-1②SO2Cl2(g)+SCl2(g)
 2SOCl2(g) △H=-5.6kJ•mol-1
2SOCl2(g) △H=-5.6kJ•mol-1567K时,在10L密闭容器中,充入一定量的Cl2、SO2和SCl2,测得初始压强为P0反应过程中容器内总压强(P)随时间(t)变化(反应达到平衡时的温度与起始温度相同)如图所示,起始各组分及达平衡时SO2Cl2(g)的物质的量如表。

| 各组分 | Cl2 | SO2(g) | SCl2(g) | SO2Cl2(g) | SOCl2(g) |
| 起始/mol | 0.5 | 0.5 | 0.5 | 0 | 0 |
| 平衡/mol | 0.2 |
(1)图中数据显示0~l min体系压强增大的原因是
(2)反应①、②达到平衡时,SCl2的转化率为
(3)pK=-lgK,567K时,上述反应②的pK=
(4)567K下,若压缩容器体积为5L,则平衡时c(SO2)
II.氯化亚砜常用于合成正丁酰氯。向连有尾气吸收装置的容器中按照物质的量1:1.5投料比加入正丁酸和氯化亚砜,反应为CH3CH2CH2COOH+SOCl2
 CH3CH2CH2COCl+SO2↑+HCl↑。实验测得温度和时间对反应的影响如表:
CH3CH2CH2COCl+SO2↑+HCl↑。实验测得温度和时间对反应的影响如表:| 序号 | 实验方法 | 收率/% |
| 1 | 25℃,反应6h | 73.60 |
| 2 | 25℃,反应8h | 74.60 |
| 3 | 75℃,反应2h | 75.00 |
| 4 | 75℃,反应3h | 76.00 |
| 5 | 先25℃,反应1h;后75℃,反应0~1h | 81.10 |
| 6 | 先25℃,反应1h;后75℃,反应0~1h | 87.10 |
(5)若开始在较高温度下反应,则会放出大量气体。通过分析上表数据,选择合理实验方法的序号为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】运用化学反应原理研究化学反应有重要意义。
(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g) 2SO3(g),混合体系中SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态)。
2SO3(g),混合体系中SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态)。
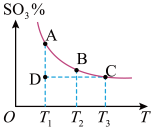
①若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡_______ (填“向左”“向右”或“不”)移动。
②若反应进行到状态D时,v(逆)_______ (填“>”“<”或“=”)v(正)
③平衡常数K(A)_______ K(C)(填“>”“<”或“=”)
(2)课本里介绍的合成氨技术叫哈伯法:N2(g)+3H2(g) 2NH3(g) ΔH<0,应用此法反应达到平衡时反应物的转化率不高。
2NH3(g) ΔH<0,应用此法反应达到平衡时反应物的转化率不高。
①能使该反应的反应速率增大,且平衡向正反应方向移动的措施是_______ (填编号)。
A.使用更高效的催化剂 B.升高温度
C.及时分离出氨气 D.充入氮气,增大氮气的浓度(保持容器体积不变)
②若在某温度下,2L的密闭容器中发生合成氨的反应,如图表示N2的物质的量随时间的变化曲线。从第11min起,升高温度,则n(N2)的变化曲线为_______ (填编号)。

(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)
 2SO3(g),混合体系中SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态)。
2SO3(g),混合体系中SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态)。
①若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡
②若反应进行到状态D时,v(逆)
③平衡常数K(A)
(2)课本里介绍的合成氨技术叫哈伯法:N2(g)+3H2(g)
 2NH3(g) ΔH<0,应用此法反应达到平衡时反应物的转化率不高。
2NH3(g) ΔH<0,应用此法反应达到平衡时反应物的转化率不高。①能使该反应的反应速率增大,且平衡向正反应方向移动的措施是
A.使用更高效的催化剂 B.升高温度
C.及时分离出氨气 D.充入氮气,增大氮气的浓度(保持容器体积不变)
②若在某温度下,2L的密闭容器中发生合成氨的反应,如图表示N2的物质的量随时间的变化曲线。从第11min起,升高温度,则n(N2)的变化曲线为

您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】我国是世界稀土资源大国,稀土元素是镧系、钪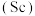 、钇
、钇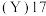 种元素的总称,它们位于元素周期表中同一副族。
种元素的总称,它们位于元素周期表中同一副族。
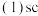 原子的价层电子排布式为
原子的价层电子排布式为______ ,第一电离能Sc______ Y 填“大于”或“小于”
填“大于”或“小于” 。
。
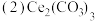 是生产铈的中间化合物,它可由氟碳酸铈
是生产铈的中间化合物,它可由氟碳酸铈
 精矿制得:
精矿制得:
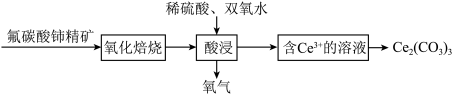
 中,Ce的化合价为
中,Ce的化合价为______ 。
 氧化焙烧生成二氧化铈
氧化焙烧生成二氧化铈 ,其在酸浸时发生反应的离子方程式为
,其在酸浸时发生反应的离子方程式为______ 。
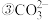 离子的立体构型的名称为
离子的立体构型的名称为______ ,中心原子的杂化方式为______ ,分子或离子中的大 键可用符号
键可用符号 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大 键的电子数
键的电子数 如苯分子中的大
如苯分子中的大 键可表示为
键可表示为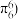 ,则
,则 中的大
中的大 键应表示为
键应表示为______ 。
 常温、常压下
常温、常压下 是铈最稳定的化合物,广泛用于玻璃、原子能、电子管等工业。
是铈最稳定的化合物,广泛用于玻璃、原子能、电子管等工业。 晶胞是立方萤石型,则铈离子的配位数为
晶胞是立方萤石型,则铈离子的配位数为______ ,如图中离子坐标参数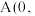 0,
0, ;
;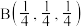 :
: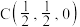 ,若将B选为晶胞顶点坐标参数
,若将B选为晶胞顶点坐标参数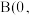 0,
0, ,则D离子处于
,则D离子处于______ 位置,坐标参数为______ 。已知该晶胞的棱长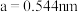 ,其密度为
,其密度为______ 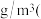 列出计算式即可
列出计算式即可 。
。

 、钇
、钇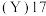 种元素的总称,它们位于元素周期表中同一副族。
种元素的总称,它们位于元素周期表中同一副族。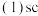 原子的价层电子排布式为
原子的价层电子排布式为 填“大于”或“小于”
填“大于”或“小于” 。
。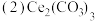 是生产铈的中间化合物,它可由氟碳酸铈
是生产铈的中间化合物,它可由氟碳酸铈
 精矿制得:
精矿制得:
 中,Ce的化合价为
中,Ce的化合价为 氧化焙烧生成二氧化铈
氧化焙烧生成二氧化铈 ,其在酸浸时发生反应的离子方程式为
,其在酸浸时发生反应的离子方程式为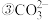 离子的立体构型的名称为
离子的立体构型的名称为 键可用符号
键可用符号 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大 键的电子数
键的电子数 如苯分子中的大
如苯分子中的大 键可表示为
键可表示为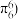 ,则
,则 中的大
中的大 键应表示为
键应表示为 常温、常压下
常温、常压下 是铈最稳定的化合物,广泛用于玻璃、原子能、电子管等工业。
是铈最稳定的化合物,广泛用于玻璃、原子能、电子管等工业。 晶胞是立方萤石型,则铈离子的配位数为
晶胞是立方萤石型,则铈离子的配位数为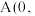 0,
0, ;
;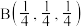 :
: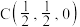 ,若将B选为晶胞顶点坐标参数
,若将B选为晶胞顶点坐标参数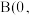 0,
0, ,则D离子处于
,则D离子处于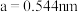 ,其密度为
,其密度为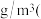 列出计算式即可
列出计算式即可 。
。
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】完成下列问题
(1)基态硫原子核外电子的空间运动状态有___________ 种;其核外电子运动最高能级的电子云轮廓图的形状为___________ 。
(2)基态砷原子的价层电子的轨道表示式为___________ 。
(3)元素Mg的第一电离能大于Al的第一电离能的原因是___________ 。
(4)硫化氢和水分子结构相似,硫化氢晶体中,一个硫化氢分子周围有12个紧邻分子,而冰中一个水分子周围只有4个紧邻分子,原因为:___________ 。
(5) 是离子晶体,其晶格能可通过图(a)的Born−Haber循环计算得到。
是离子晶体,其晶格能可通过图(a)的Born−Haber循环计算得到。

可知,Li原子的第一电离能为___________  ,
, 键键能为
键键能为___________ 
(6) 、
、 、
、 的还原性由强到弱的顺序为
的还原性由强到弱的顺序为___________ ,键角由大到小的顺序为___________ ,已知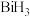 的沸点高于
的沸点高于 ,其原因是
,其原因是___________ 。
(1)基态硫原子核外电子的空间运动状态有
(2)基态砷原子的价层电子的轨道表示式为
(3)元素Mg的第一电离能大于Al的第一电离能的原因是
(4)硫化氢和水分子结构相似,硫化氢晶体中,一个硫化氢分子周围有12个紧邻分子,而冰中一个水分子周围只有4个紧邻分子,原因为:
(5)
 是离子晶体,其晶格能可通过图(a)的Born−Haber循环计算得到。
是离子晶体,其晶格能可通过图(a)的Born−Haber循环计算得到。
可知,Li原子的第一电离能为
 ,
, 键键能为
键键能为
(6)
 、
、 、
、 的还原性由强到弱的顺序为
的还原性由强到弱的顺序为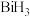 的沸点高于
的沸点高于 ,其原因是
,其原因是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】碳、氧、硅、锗、氟、氯、溴、镍元素在化学中占有极其重要的地位。
(1)第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是________ 。
(2)从电负性角度分析,碳、氧和硅元素的非金属性由强至弱的顺序为____________________ 。
(3)CH4中共用电子对偏向C,SiH4中共用电子对偏向H,则C、Si、H的电负性由大到小的顺序为__________________ 。
(4)基态锗(Ge)原子的电子排布式是____________ ,Ge的最高价氯化物分子式是________ 。该元素可能的性质或应用有________ (填字母)。
A.是一种活泼的金属元素
B.其电负性大于硫
C.其单质可作为半导体材料
D.锗的第一电离能高于碳而电负性低于碳
(5)溴与氯能以________ 键结合形成BrCl,BrCl分子中,________ 显正电性。BrCl与水发生反应的化学方程式为______________________________________________ 。
(1)第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是
(2)从电负性角度分析,碳、氧和硅元素的非金属性由强至弱的顺序为
(3)CH4中共用电子对偏向C,SiH4中共用电子对偏向H,则C、Si、H的电负性由大到小的顺序为
(4)基态锗(Ge)原子的电子排布式是
A.是一种活泼的金属元素
B.其电负性大于硫
C.其单质可作为半导体材料
D.锗的第一电离能高于碳而电负性低于碳
(5)溴与氯能以
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】已知A、B、C、D、E、F是原子序数依次增大的前四周期元素。A元素原子中电子只有一种自旋取向;B元素原子最高能级的不同轨道都有电子,且自旋方向相同;C是地壳中含量最高的元素;D核外电子总数是最外层电子数的3倍;E元素只有一个不成对电子;F元素原子最外层只有一个电子,其次外层内的所有轨道的电子均成对。回答下列问题:
(1)六种元素中电负性最大的是______ (填元素符号),B、C、D三种元素的第一电离能由大到小的顺序是______ ,其中D基态原子的核外电子排布式为______ 。
(2)E的基态原子最外层轨道表示式为______ 。E单质与湿润的 反应可制备
反应可制备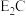 ,其化学方程式为
,其化学方程式为______ 。
(3)F元素有两种常见离子,化合价为+1和+2,从结构上分析F的基态离子中更稳定的是______ ,原因是______ 。
(1)六种元素中电负性最大的是
(2)E的基态原子最外层轨道表示式为
 反应可制备
反应可制备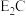 ,其化学方程式为
,其化学方程式为(3)F元素有两种常见离子,化合价为+1和+2,从结构上分析F的基态离子中更稳定的是
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】我国秦俑彩绘和汉代器物上用的颜料被称为中国蓝”、“中国紫”,近年来,人们对这些颜料的成分进行了研究,发现其成分主要为BaCuSi4O10、BaCuSi2O6
(1)基态Cu原子核外有_______ 个运动状态不同的电子,其在周期表中的位置_______ 。Si、O、Ba元素电负性由大到小的顺序为_______ 。
(2)“中国蓝”的发色中心是以Cu2+为中心离子的配合物,其中提供孤电子对的是_______ 元素。
(3)比较Si、SiC、 CO2 三种物质晶体状态时熔点由高到低的顺序为_______ ,原因为_______ 。
(4)C、N元素与颜料中的氧元素同周期。
①写出CO的一种常见等电子体分子的电子式_______ ;NO 的VSEPR模型为
的VSEPR模型为_______ ,酸性:HNO2_______ HNO3(填“强于”或“弱于”)。
②C、N元素能形成一种类石墨的聚合物半导体g-C3N4其单层平面结构如图1,晶胞结构如图2。
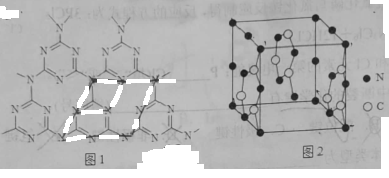
i.g-C3N4中氮原子的杂化类型是_______ 。
ii.已知该晶胞的体积为Vcm3,中间层原子均在晶胞内部。设阿伏加德罗常数的值为NA,则g-C3N4的密度为_______ 。
iii.根据图2,在图1中用平行四边形画出个最小重复单元_____ 。
(1)基态Cu原子核外有
(2)“中国蓝”的发色中心是以Cu2+为中心离子的配合物,其中提供孤电子对的是
(3)比较Si、SiC、 CO2 三种物质晶体状态时熔点由高到低的顺序为
(4)C、N元素与颜料中的氧元素同周期。
①写出CO的一种常见等电子体分子的电子式
 的VSEPR模型为
的VSEPR模型为②C、N元素能形成一种类石墨的聚合物半导体g-C3N4其单层平面结构如图1,晶胞结构如图2。

i.g-C3N4中氮原子的杂化类型是
ii.已知该晶胞的体积为Vcm3,中间层原子均在晶胞内部。设阿伏加德罗常数的值为NA,则g-C3N4的密度为
iii.根据图2,在图1中用平行四边形画出个最小重复单元
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】(1)p电子的原子轨道呈______ 形;
(2)共价键的类型有两种分别是σ键和π键,σ键的对称方式为______ ;
(3)某元素位于元素周期表中第四周期,第VA族,元素符号是______ ,最高价氧化物对应的水化物的化学式______ ;
(4)用“>”或“<”填空:①能量:4p______ 5s ②离子半径:F-______ Na+;
(5)二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,常温下是一种橙黄色有恶臭的液体,它的分子结构如图所示。

①S2Cl2的结构式为______ ,其化学键类型有______ (填“极性键”“非极性键”或“极性键和非极性键”)。
②电负性:S______ Cl(填“>”或“<”),每个S原子有______ 对孤电子对。
(2)共价键的类型有两种分别是σ键和π键,σ键的对称方式为
(3)某元素位于元素周期表中第四周期,第VA族,元素符号是
(4)用“>”或“<”填空:①能量:4p
(5)二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,常温下是一种橙黄色有恶臭的液体,它的分子结构如图所示。

①S2Cl2的结构式为
②电负性:S
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】亚硝酸钠(NaNO2)是一种重要的化工原料。亚硝酸钠易潮解,易溶于水和液氨,微溶于乙醇、甲醇、乙醚等有机溶剂。25℃时,用pH试纸测得0.1mol•L-1NaNO2溶液的pH 7。
7。
(1)NaNO2溶液pH>7的原因是_____ (用离子方程式表示),该NaNO2溶液中c(HNO2)=_____ (用溶液中其他离子的浓度关系式表示)。
(2)常温下,pH=3的HNO2溶液和pH=11的NaOH溶液等体积混合后溶液pH_____ (填“大于”“小于”或“等于”,下同)7,c(Na+)_____ c(NO )。
)。
(3)依据VSEPR模型推测CO 的空间结构为
的空间结构为_____ 。分子中的大π键可用符号Π 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Π
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Π ),则CO
),则CO 中的大π键应表示为
中的大π键应表示为_____ 。
(4)UO2可用于制备UF4发生反应:2UO2+5NH4HF2 2UF4•2NH4F+3NH3↑+4H2O↑,其中HF
2UF4•2NH4F+3NH3↑+4H2O↑,其中HF 的结构可表示为
的结构可表示为 ,反应中断裂的化学键有
,反应中断裂的化学键有______ (填序号)。
a.氢键 b.极性键 c.离子键 d.金属键 e.非极性键
 7。
7。(1)NaNO2溶液pH>7的原因是
(2)常温下,pH=3的HNO2溶液和pH=11的NaOH溶液等体积混合后溶液pH
 )。
)。(3)依据VSEPR模型推测CO
 的空间结构为
的空间结构为 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Π
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Π ),则CO
),则CO 中的大π键应表示为
中的大π键应表示为(4)UO2可用于制备UF4发生反应:2UO2+5NH4HF2
 2UF4•2NH4F+3NH3↑+4H2O↑,其中HF
2UF4•2NH4F+3NH3↑+4H2O↑,其中HF 的结构可表示为
的结构可表示为 ,反应中断裂的化学键有
,反应中断裂的化学键有a.氢键 b.极性键 c.离子键 d.金属键 e.非极性键
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】铬是一种重要的元素,在合金、电镀、鞣制领域都有重要的应用,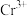 的配位能力很强,可以形成多种配离子。
的配位能力很强,可以形成多种配离子。
(1)基态 原子价层电子的轨道表达式为
原子价层电子的轨道表达式为___________ ,同周期元素的基态原子最外层电子数与 相同的元素有
相同的元素有___________ (写元素符号)。
(2)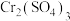 是最重要的铬(Ⅲ)盐之一,阴离子
是最重要的铬(Ⅲ)盐之一,阴离子 的空间构型为
的空间构型为___________ ,基态 原子核外电子中成对电子数和未成对电子数之比为
原子核外电子中成对电子数和未成对电子数之比为___________ 。
(3) 中
中 的数目为
的数目为___________ ,含有的的配体是___________ ,配位数是___________ ,配位原子是___________ 。
(4)比较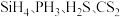 的键角,按由大到小顺序排列:
的键角,按由大到小顺序排列:___________ 。
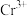 的配位能力很强,可以形成多种配离子。
的配位能力很强,可以形成多种配离子。(1)基态
 原子价层电子的轨道表达式为
原子价层电子的轨道表达式为 相同的元素有
相同的元素有(2)
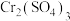 是最重要的铬(Ⅲ)盐之一,阴离子
是最重要的铬(Ⅲ)盐之一,阴离子 的空间构型为
的空间构型为 原子核外电子中成对电子数和未成对电子数之比为
原子核外电子中成对电子数和未成对电子数之比为(3)
 中
中 的数目为
的数目为(4)比较
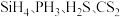 的键角,按由大到小顺序排列:
的键角,按由大到小顺序排列:
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】引起灰霾的PM2.5微细粒子包含(NH4)2SO4、NH4NO3、含锌有机颗粒物及扬尘等。通过测定灰霾中锌等重金属的含量,可知交通污染是目前造成我国灰霾天气主要原因之一。
(1)Zn2+在基态时核外电子排布式为_________ 。
(2)PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾污染,光化学烟雾中含有NOx、O3、CH2=CH-CHO、HCOOH、CH3COOONO2(PAN)等二次污染物。
①N2O分子的立体构型为______ 。
②CH2=CH-CHO分子中碳原子的杂化方式为______
③1mol HCOOH 中含σ键数目为_____ 。
④NO 能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4,该配合物中心离子的配体为______ ,Fe的化合价为_____ 。
(1)Zn2+在基态时核外电子排布式为
(2)PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾污染,光化学烟雾中含有NOx、O3、CH2=CH-CHO、HCOOH、CH3COOONO2(PAN)等二次污染物。
①N2O分子的立体构型为
②CH2=CH-CHO分子中碳原子的杂化方式为
③1mol HCOOH 中含σ键数目为
④NO 能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4,该配合物中心离子的配体为
您最近一年使用:0次



