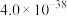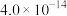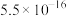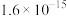甲醇是重要的化工基础原料和清洁液体燃料,在 加氢合成
加氢合成 的体系中,同时发生下列竞争反应:
的体系中,同时发生下列竞争反应:
(ⅰ)
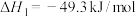
(ⅱ)
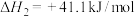
由CO也能直接加氢合成甲醇:(ⅲ)

(1)
_____ kJ/mol。
(2)反应(ⅱ) 的正、逆反应平衡常数随温度变化曲线如图所示。
的正、逆反应平衡常数随温度变化曲线如图所示。
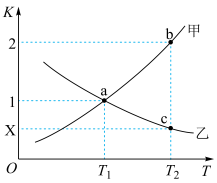
下列分析正确的是______ 。
A.曲线甲为K(逆),曲线乙为K(正) B.a点时,一定有 C.c点时,x=0.5
C.c点时,x=0.5
(3)催化剂M、N对 反应进程的能量影响如下图(a)所示,两种催化剂对应的
反应进程的能量影响如下图(a)所示,两种催化剂对应的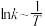 关系如下图(b)所示(已知;
关系如下图(b)所示(已知; ,其中
,其中 为活化能,k为速率常数,R和C为常数)。
为活化能,k为速率常数,R和C为常数)。
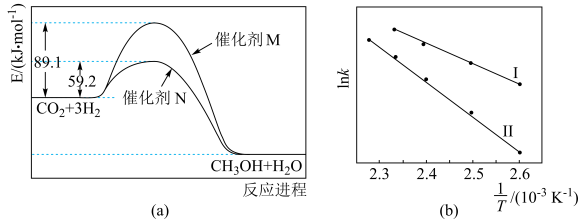
①使用催化剂M时,逆反应的活化能为______ kJ/mol。
②催化剂N对应曲线是图(b)中的______ (填“Ⅰ”或“Ⅱ”)
(4)为进一步研究 与
与 反应制
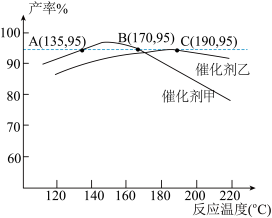
反应制 的过程中原料气组成对反应速率的影响,分别向三个压强恒定为P的密闭容器(装有等量催化剂,且在实验温度范围内催化剂活性变化不大)中通入相同碳氢比的三种混合气,相同时间内。测得生成甲醇的速率与温度的关系如图所示。
的过程中原料气组成对反应速率的影响,分别向三个压强恒定为P的密闭容器(装有等量催化剂,且在实验温度范围内催化剂活性变化不大)中通入相同碳氢比的三种混合气,相同时间内。测得生成甲醇的速率与温度的关系如图所示。
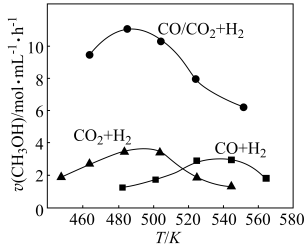
①三个容器中,甲醇的生成速率达峰值后均随温度升高而下降的原因是_______ 。
②结合研究目的,参照图中三条曲线,你可得出的结论是____ (写一条)。
(5)恒温下,在压强恒定为P的装置中,按 加入反应物,发生反应(ⅰ)、(ⅱ)。达到平衡时,若
加入反应物,发生反应(ⅰ)、(ⅱ)。达到平衡时,若 转化率为20%,甲醇的选择性为50%。列出反应(ⅰ)
转化率为20%,甲醇的选择性为50%。列出反应(ⅰ)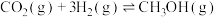
 的平衡常数计算式:
的平衡常数计算式:
______ (不必化简)。(已知: 的选择性
的选择性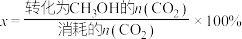 ;
; 为用分压代替浓度的平衡常数。)
为用分压代替浓度的平衡常数。)
(6) 是一种贮氢的金属氢化物,可通过氢化镁和镍单质球磨制成。
是一种贮氢的金属氢化物,可通过氢化镁和镍单质球磨制成。 晶胞形状为如图立方体。边长为a nm,Ni原子占据顶点和面心,
晶胞形状为如图立方体。边长为a nm,Ni原子占据顶点和面心, 处于八个小立方体的体心。
处于八个小立方体的体心。
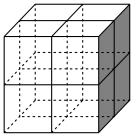
①Ni原子的价电子排布式为______ 。
② 位于Ni原子形成的
位于Ni原子形成的______ (填“八面体空隙”或“四面体空隙”)。
③该晶体的密度为_____  (用含a、
(用含a、 代数式表示)。
代数式表示)。
 加氢合成
加氢合成 的体系中,同时发生下列竞争反应:
的体系中,同时发生下列竞争反应:(ⅰ)

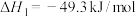
(ⅱ)

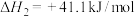
由CO也能直接加氢合成甲醇:(ⅲ)


(1)

(2)反应(ⅱ)
 的正、逆反应平衡常数随温度变化曲线如图所示。
的正、逆反应平衡常数随温度变化曲线如图所示。
下列分析正确的是
A.曲线甲为K(逆),曲线乙为K(正) B.a点时,一定有
 C.c点时,x=0.5
C.c点时,x=0.5(3)催化剂M、N对
 反应进程的能量影响如下图(a)所示,两种催化剂对应的
反应进程的能量影响如下图(a)所示,两种催化剂对应的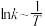 关系如下图(b)所示(已知;
关系如下图(b)所示(已知; ,其中
,其中 为活化能,k为速率常数,R和C为常数)。
为活化能,k为速率常数,R和C为常数)。
①使用催化剂M时,逆反应的活化能为
②催化剂N对应曲线是图(b)中的
(4)为进一步研究
 与
与 反应制
反应制 的过程中原料气组成对反应速率的影响,分别向三个压强恒定为P的密闭容器(装有等量催化剂,且在实验温度范围内催化剂活性变化不大)中通入相同碳氢比的三种混合气,相同时间内。测得生成甲醇的速率与温度的关系如图所示。
的过程中原料气组成对反应速率的影响,分别向三个压强恒定为P的密闭容器(装有等量催化剂,且在实验温度范围内催化剂活性变化不大)中通入相同碳氢比的三种混合气,相同时间内。测得生成甲醇的速率与温度的关系如图所示。
①三个容器中,甲醇的生成速率达峰值后均随温度升高而下降的原因是
②结合研究目的,参照图中三条曲线,你可得出的结论是
(5)恒温下,在压强恒定为P的装置中,按
 加入反应物,发生反应(ⅰ)、(ⅱ)。达到平衡时,若
加入反应物,发生反应(ⅰ)、(ⅱ)。达到平衡时,若 转化率为20%,甲醇的选择性为50%。列出反应(ⅰ)
转化率为20%,甲醇的选择性为50%。列出反应(ⅰ)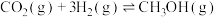
 的平衡常数计算式:
的平衡常数计算式:
 的选择性
的选择性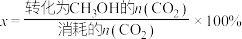 ;
; 为用分压代替浓度的平衡常数。)
为用分压代替浓度的平衡常数。)(6)
 是一种贮氢的金属氢化物,可通过氢化镁和镍单质球磨制成。
是一种贮氢的金属氢化物,可通过氢化镁和镍单质球磨制成。 晶胞形状为如图立方体。边长为a nm,Ni原子占据顶点和面心,
晶胞形状为如图立方体。边长为a nm,Ni原子占据顶点和面心, 处于八个小立方体的体心。
处于八个小立方体的体心。
①Ni原子的价电子排布式为
②
 位于Ni原子形成的
位于Ni原子形成的③该晶体的密度为
 (用含a、
(用含a、 代数式表示)。
代数式表示)。
更新时间:2024-01-30 08:31:11
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】作为新质生产力培育的重要领域,目前氢能发展正处在提质增效的关键阶段。甲醇水蒸气重整制氢的方法是目前比较成熟的制氢方法,其部分反应过程如图1所示:_______ kJ⋅mol⁻¹,该条件下反应Ⅲ的热化学方程式为_______ 。
(2)下图为T℃平衡时含碳产物的选择性(如CO的选择性是指反应生成CO的甲醇占转化的甲醇的百分比)及产氢率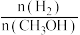 随水醇比
随水醇比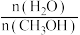 的变化图像如图2,曲线
的变化图像如图2,曲线_______ (填“a”、“b”或“c”)是CO的选择性曲线。由图2可知,工业生产中最优水醇比暴_______ (填序号)。
(3)甲醇水蒸气重整反应是在吸附剂CaO存在的情况下进行的,已知吸附剂CaO的碳酸化反应为: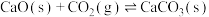 ,T℃时,
,T℃时, 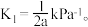 在温度为T℃的恒压容器的石英管中加入适量CaO,按
在温度为T℃的恒压容器的石英管中加入适量CaO,按 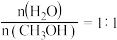 通入水蒸气和甲醇,测得压强为P₀kPa,,反应平衡时氢气的分压为b kPa,若此时氧化钙对二氧化碳的吸收率为50%,则CO₂的平衡分压为
通入水蒸气和甲醇,测得压强为P₀kPa,,反应平衡时氢气的分压为b kPa,若此时氧化钙对二氧化碳的吸收率为50%,则CO₂的平衡分压为_______ kPa,反应I的Kₚ₁=_______ 。若继续加入甲醇反应至新平衡,与原平衡相比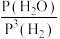
_______ (填“增大”“减小”或“不变”)

(2)下图为T℃平衡时含碳产物的选择性(如CO的选择性是指反应生成CO的甲醇占转化的甲醇的百分比)及产氢率
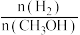 随水醇比
随水醇比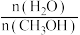 的变化图像如图2,曲线
的变化图像如图2,曲线
(3)甲醇水蒸气重整反应是在吸附剂CaO存在的情况下进行的,已知吸附剂CaO的碳酸化反应为:
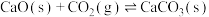 ,T℃时,
,T℃时, 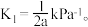 在温度为T℃的恒压容器的石英管中加入适量CaO,按
在温度为T℃的恒压容器的石英管中加入适量CaO,按 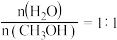 通入水蒸气和甲醇,测得压强为P₀kPa,,反应平衡时氢气的分压为b kPa,若此时氧化钙对二氧化碳的吸收率为50%,则CO₂的平衡分压为
通入水蒸气和甲醇,测得压强为P₀kPa,,反应平衡时氢气的分压为b kPa,若此时氧化钙对二氧化碳的吸收率为50%,则CO₂的平衡分压为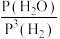
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】甲醇是一种优质燃料,在工业上常用CO和H2合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g)。
CH3OH(g)。
已知:①CO(g)+1/2O2(g)=CO2(g) H1
H1
②H2(g)+1/2O2(g)=H2O(g) ΔH2
③CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) ΔH3
回答下列问题:
(1)CO(g)+2H2(g) CH3OH(g)的平衡常数K表达式
CH3OH(g)的平衡常数K表达式___________ ,该反应的反应热ΔH4=__________ (用ΔH1、ΔH2、ΔH3)。
(2)若在绝热、恒容的密闭容器中充入1 mol CO、2 mol H2,发生CO(g)+2H2(g) CH3OH(g)反应,下列示意图正确且能说明反应在进行到t1时刻为平衡状态的是
CH3OH(g)反应,下列示意图正确且能说明反应在进行到t1时刻为平衡状态的是___________ (填选项字母,单选)。
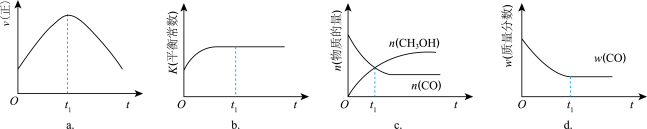
(3)T1℃时,在一个体积为5 L的恒容容器中充入1 mol CO、2 mol H2,经过5 min达到平衡,CO的转化率为0.8,则5 min内用H2表示的反应速率为v(H2)=___________ ,T1℃时,CO(g)+2H2(g) CH3OH(g)的平衡常数K=
CH3OH(g)的平衡常数K=___________ 。
(4)为了提高燃料的利用率可以将甲醇设计为燃料电池,写出KOH作电解质溶液时,甲醇燃料电池的负极反应式:___________ 。该电池负极与水库的铁闸相连时,可以保护铁闸不被腐蚀,这种电化学保护方法叫做___________ 。
(5)含有甲醇的废水随意排放会造成水污染,可用ClO2将其氧化为CO2,然后再加碱中和即可。写出处理甲醇酸性废水过程中,ClO2与甲醇反应的离子方程式:___________ 。
 CH3OH(g)。
CH3OH(g)。已知:①CO(g)+1/2O2(g)=CO2(g)
 H1
H1 ②H2(g)+1/2O2(g)=H2O(g) ΔH2
③CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) ΔH3
回答下列问题:
(1)CO(g)+2H2(g)
 CH3OH(g)的平衡常数K表达式
CH3OH(g)的平衡常数K表达式(2)若在绝热、恒容的密闭容器中充入1 mol CO、2 mol H2,发生CO(g)+2H2(g)
 CH3OH(g)反应,下列示意图正确且能说明反应在进行到t1时刻为平衡状态的是
CH3OH(g)反应,下列示意图正确且能说明反应在进行到t1时刻为平衡状态的是
(3)T1℃时,在一个体积为5 L的恒容容器中充入1 mol CO、2 mol H2,经过5 min达到平衡,CO的转化率为0.8,则5 min内用H2表示的反应速率为v(H2)=
 CH3OH(g)的平衡常数K=
CH3OH(g)的平衡常数K=(4)为了提高燃料的利用率可以将甲醇设计为燃料电池,写出KOH作电解质溶液时,甲醇燃料电池的负极反应式:
(5)含有甲醇的废水随意排放会造成水污染,可用ClO2将其氧化为CO2,然后再加碱中和即可。写出处理甲醇酸性废水过程中,ClO2与甲醇反应的离子方程式:
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐3】I.二氧化碳是地球温室效应的罪魁祸首,目前人们处理二氧化碳的方法之一是使其与氢气反应合成甲醇。已知氢气、甲醇燃烧的热化学方程式如下:
①2H2(g)+O2(g)=2H2O(l) △H=- 283.0kJ/mol;
②2CH3OH (1)+3O2=2CO2(g)+4H2O(1) △H=- 726.0kJ/mol。
(1)写出二氧化碳与氢气合成甲醇液体的热化学方程式____ 。
(2)已知:CO2 (g)+3H2 (g)=CH3OH (g)+H2O(g) △H=- 49.0kJ/mol,将6molCO2和8mol H2充入4L的密闭容器中,测得H2的物质的量随时间变化如图所示(实线),图中数据a(l,6)表示在1min时H2的物质的量是6mol。

①b点正反应速率____ (填“大于”“等于”或“小于”)逆反应速率。此温度下该反应的平衡常数为____ 。
②仅改变某一实验条件再进行两次实验测得H2的物质的量随时间变化如图中虚线所示。曲线Ⅱ对应的实验条件改变是____ ,体积不变再充入3 mol CO2和4mol H2,H2O(g)的体积分数____ (填“增大”“不变”或“减小”)
Ⅱ.粗镍样品中含Fe、Zn、Ag、Cu等四种金属杂质,为获得高纯度的镍,某兴趣小组同学拟用铅蓄电池为电源,粗镍及石墨为电极,电解硝酸镍溶液对粗镍进行提纯。(已知,氧化性:Fe2+ <Ni2+ <Cu2+)
(1)铅蓄电池的负极电极反应式为___ 。
(2)粗镍提纯的阴极反应式为___ 。电解结束后,阳极附近产生的沉淀物的主要成分为____ 。
①2H2(g)+O2(g)=2H2O(l) △H=- 283.0kJ/mol;
②2CH3OH (1)+3O2=2CO2(g)+4H2O(1) △H=- 726.0kJ/mol。
(1)写出二氧化碳与氢气合成甲醇液体的热化学方程式
(2)已知:CO2 (g)+3H2 (g)=CH3OH (g)+H2O(g) △H=- 49.0kJ/mol,将6molCO2和8mol H2充入4L的密闭容器中,测得H2的物质的量随时间变化如图所示(实线),图中数据a(l,6)表示在1min时H2的物质的量是6mol。

①b点正反应速率
②仅改变某一实验条件再进行两次实验测得H2的物质的量随时间变化如图中虚线所示。曲线Ⅱ对应的实验条件改变是
Ⅱ.粗镍样品中含Fe、Zn、Ag、Cu等四种金属杂质,为获得高纯度的镍,某兴趣小组同学拟用铅蓄电池为电源,粗镍及石墨为电极,电解硝酸镍溶液对粗镍进行提纯。(已知,氧化性:Fe2+ <Ni2+ <Cu2+)
(1)铅蓄电池的负极电极反应式为
(2)粗镍提纯的阴极反应式为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】冶金工业、硝酸工业的废气废液中含氮化合物污染严重,必须处理达标后才能排放。
Ⅰ.用活性炭处理工厂尾气中的氮氧化物。
(1)已知:①4NH3(g)+5O2(g) =4NO(g)+6H2O(l) ΔH1=a kJ·mol−1
②4NH3(g)+3O2(g) =2N2(g)+6H2O(l) ΔH2=b kJ·mol−1
③C(s)+O2(g) =CO2(g) ΔH3=c kJ·mol−1
则反应C(s)+2NO(g) N2(g)+CO2(g)的ΔH=
N2(g)+CO2(g)的ΔH=________ 。
(2)在容积不变的密闭容器中,一定量的NO与足量的C发生反应:C(s)+2NO(g) N2(g) + CO2(g) ΔH= Q kJ·mol−1,平衡时c(NO)与温度T的关系如图1所示,下列说法正确的是
N2(g) + CO2(g) ΔH= Q kJ·mol−1,平衡时c(NO)与温度T的关系如图1所示,下列说法正确的是________ 。
A.其他条件不变,改变活性炭的用量,平衡一定不移动
B.该反应的Q>0,所以T1、T2、T3对应的平衡常数:K1<K2<K3
C.温度为T2时,若反应体系处于状态D,则此时 υ(正)>υ(逆)
D.若状态B、C、D体系的压强分别为p(B)、p(C)、p(D),则p(D)=p(C)>p(B)


(3)已知某温度时,反应C(s)+2NO(g) N2(g)+CO2(g)的平衡常数K=
N2(g)+CO2(g)的平衡常数K= ,在该温度下的2L密闭容器中投入足量的活性炭和2.0 mol NO发生反应,t1时刻达到平衡,请在图2中画出反应过程中c(NO)随时间t的变化曲线。
,在该温度下的2L密闭容器中投入足量的活性炭和2.0 mol NO发生反应,t1时刻达到平衡,请在图2中画出反应过程中c(NO)随时间t的变化曲线。_________________
Ⅱ.用纳米铁粉或电解法处理废水中的硝酸盐。
(4)纳米铁粉处理污水中NO3−的离子方程式为:4Fe+NO3–+10H+=4Fe2++NH4++3H2O。
实验证实,pH偏低将会导致NO3−的去除率下降,其原因是________________ 。相同条件下,纳米铁粉去除不同水样中NO3−的速率有较大差异(见下图),产生该差异的可能原因是________________________ 。

(5)电解法处理水中硝酸盐的原理是:以金属Pt作电极,用质子交换膜把溶液分为阴阳两极区,阴极区为含硝酸盐的工业废水,接通直流电源进行电解,产物为N2。请写出阴极的电极反应式____________ 。
Ⅰ.用活性炭处理工厂尾气中的氮氧化物。
(1)已知:①4NH3(g)+5O2(g) =4NO(g)+6H2O(l) ΔH1=a kJ·mol−1
②4NH3(g)+3O2(g) =2N2(g)+6H2O(l) ΔH2=b kJ·mol−1
③C(s)+O2(g) =CO2(g) ΔH3=c kJ·mol−1
则反应C(s)+2NO(g)
 N2(g)+CO2(g)的ΔH=
N2(g)+CO2(g)的ΔH=(2)在容积不变的密闭容器中,一定量的NO与足量的C发生反应:C(s)+2NO(g)
 N2(g) + CO2(g) ΔH= Q kJ·mol−1,平衡时c(NO)与温度T的关系如图1所示,下列说法正确的是
N2(g) + CO2(g) ΔH= Q kJ·mol−1,平衡时c(NO)与温度T的关系如图1所示,下列说法正确的是A.其他条件不变,改变活性炭的用量,平衡一定不移动
B.该反应的Q>0,所以T1、T2、T3对应的平衡常数:K1<K2<K3
C.温度为T2时,若反应体系处于状态D,则此时 υ(正)>υ(逆)
D.若状态B、C、D体系的压强分别为p(B)、p(C)、p(D),则p(D)=p(C)>p(B)


(3)已知某温度时,反应C(s)+2NO(g)
 N2(g)+CO2(g)的平衡常数K=
N2(g)+CO2(g)的平衡常数K= ,在该温度下的2L密闭容器中投入足量的活性炭和2.0 mol NO发生反应,t1时刻达到平衡,请在图2中画出反应过程中c(NO)随时间t的变化曲线。
,在该温度下的2L密闭容器中投入足量的活性炭和2.0 mol NO发生反应,t1时刻达到平衡,请在图2中画出反应过程中c(NO)随时间t的变化曲线。Ⅱ.用纳米铁粉或电解法处理废水中的硝酸盐。
(4)纳米铁粉处理污水中NO3−的离子方程式为:4Fe+NO3–+10H+=4Fe2++NH4++3H2O。
实验证实,pH偏低将会导致NO3−的去除率下降,其原因是

(5)电解法处理水中硝酸盐的原理是:以金属Pt作电极,用质子交换膜把溶液分为阴阳两极区,阴极区为含硝酸盐的工业废水,接通直流电源进行电解,产物为N2。请写出阴极的电极反应式
您最近一年使用:0次
【推荐2】党的二十大报告指出,要积极稳妥推进碳达峰、碳中和。二氧化碳的捕集、利用与封存(CCUS)已成为科学家研究的重要课题。
I.工业上用 和
和 在一定条件下可以合成乙烯:
在一定条件下可以合成乙烯: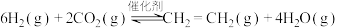

已知:①
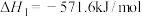
②
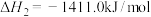
③
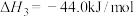
(1)
__________ (用 、
、 、
、 表示)。
表示)。
(2)恒温恒容下,向密闭容器按投料比 通入原料气,能判断该反应处于平衡状态的是_______(填标号)。
通入原料气,能判断该反应处于平衡状态的是_______(填标号)。
(3)向密闭容器按投料比 通入原料气(,不同温度对
通入原料气(,不同温度对 的平衡转化率和催化剂催化效率的影响如图所示,则压强
的平衡转化率和催化剂催化效率的影响如图所示,则压强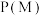
__________ 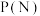 ,原因是:
,原因是:__________ 。

Ⅱ. 催化加氢可以直接合成二甲醚。涉及以下主要反应:
催化加氢可以直接合成二甲醚。涉及以下主要反应:
①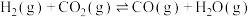

②

恒压条件下, 、起始量相等时,
、起始量相等时, 的平衡转化率和的选择性随温度变化如下图所示。
的平衡转化率和的选择性随温度变化如下图所示。
已知:的选择性 %
%
(4)300℃时,通入 、
、 各
各 ,平衡时
,平衡时 的选择性、
的选择性、 的平衡转化率均为30%,则此温度下反应①的平衡常数
的平衡转化率均为30%,则此温度下反应①的平衡常数
__________ (保留2位有效数字)。
(5)温度高于300℃, 的平衡转化率随温度升高而增大的原因可能是
的平衡转化率随温度升高而增大的原因可能是__________ 。
Ⅲ.电化学法也可还原二氧化碳制乙烯,原理如下图所示。
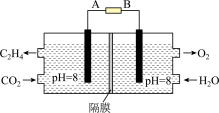
(6)该电池的阴极电极反应式为:__________ 。
I.工业上用
 和
和 在一定条件下可以合成乙烯:
在一定条件下可以合成乙烯: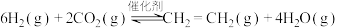

已知:①

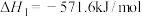
②

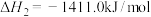
③

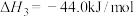
(1)

 、
、 、
、 表示)。
表示)。(2)恒温恒容下,向密闭容器按投料比
 通入原料气,能判断该反应处于平衡状态的是_______(填标号)。
通入原料气,能判断该反应处于平衡状态的是_______(填标号)。A. |
| B.混合气体的密度保持不变 |
| C.混合气体的平均相对分子质量保持不变 |
D.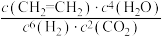 保持不变 保持不变 |
(3)向密闭容器按投料比
 通入原料气(,不同温度对
通入原料气(,不同温度对 的平衡转化率和催化剂催化效率的影响如图所示,则压强
的平衡转化率和催化剂催化效率的影响如图所示,则压强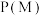
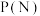 ,原因是:
,原因是:
Ⅱ.
 催化加氢可以直接合成二甲醚。涉及以下主要反应:
催化加氢可以直接合成二甲醚。涉及以下主要反应:①
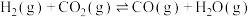

②


恒压条件下,
 、起始量相等时,
、起始量相等时, 的平衡转化率和的选择性随温度变化如下图所示。
的平衡转化率和的选择性随温度变化如下图所示。
已知:的选择性
 %
%(4)300℃时,通入
 、
、 各
各 ,平衡时
,平衡时 的选择性、
的选择性、 的平衡转化率均为30%,则此温度下反应①的平衡常数
的平衡转化率均为30%,则此温度下反应①的平衡常数
(5)温度高于300℃,
 的平衡转化率随温度升高而增大的原因可能是
的平衡转化率随温度升高而增大的原因可能是Ⅲ.电化学法也可还原二氧化碳制乙烯,原理如下图所示。

(6)该电池的阴极电极反应式为:
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】化学固定、催化活化循环利用 的研究,备受重视。铜基催化剂上
的研究,备受重视。铜基催化剂上 加氢合成甲醇是重要的利用途径。该工艺主要发生合成甲醇的反应I和逆水汽变换反应Ⅱ。
加氢合成甲醇是重要的利用途径。该工艺主要发生合成甲醇的反应I和逆水汽变换反应Ⅱ。
I.
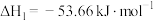 ,
,
Ⅱ.
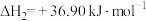 ,
,
Ⅲ:

已知甲醇的选择性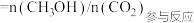
请回答:
(1)
_______ ,反应Ⅲ自发进行的条件是_______ 。
(2)恒温恒容条件下,原料气 (g)、
(g)、 (g)以物质的量浓度1:3投料时,控制合适条件(不考虑反应Ⅲ),甲醇的选择性为50%。已知初始
(g)以物质的量浓度1:3投料时,控制合适条件(不考虑反应Ⅲ),甲醇的选择性为50%。已知初始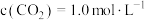 ,
, 平衡转化率为50%,则该条件下
平衡转化率为50%,则该条件下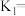
_______ 。
(3)以50Cu/45Zn/5Al为催化剂,催化剂表面金属能吸附 、CO、
、CO、 分子,反应I和Ⅱ发生在催化剂表面的不同活性位点。在240℃、2MPa条件下,将原料气按照a、b、c、d四种方式以相同流速通过催化剂,测得各组分转化率(X)和选择性(S)如表1所示。另测得
分子,反应I和Ⅱ发生在催化剂表面的不同活性位点。在240℃、2MPa条件下,将原料气按照a、b、c、d四种方式以相同流速通过催化剂,测得各组分转化率(X)和选择性(S)如表1所示。另测得 转化率、甲醇选择性与温度、原料气组成关系如图8、图9所示。
转化率、甲醇选择性与温度、原料气组成关系如图8、图9所示。
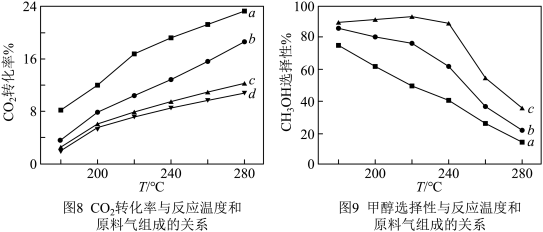
表1 催化剂性能与原料气组成的关系
①分析表1数据,推测随着原料气中掺杂CO体积分数的增大, 转化率迅速降低、甲醇选择性急剧增大的原因
转化率迅速降低、甲醇选择性急剧增大的原因_______ 。
②结合表1、图8、图9等有关知识,下列说法正确的是_______ 。
A.其他条件一定时,原料气中CO体积分数越大,生成甲醇越多
B.一定范围内升高温度利于 与催化剂活性位点结合,可以提高
与催化剂活性位点结合,可以提高 的转化率
的转化率
C.根据图9中的a线,推测温度对反应Ⅱ的速率影响比反应I大
D.增大流速,原料气与催化剂碰撞的机会多,甲醇产率一定增加
③请在图9中画出按照d投料时甲醇的选择性随温度变化的曲线_______ 。
 的研究,备受重视。铜基催化剂上
的研究,备受重视。铜基催化剂上 加氢合成甲醇是重要的利用途径。该工艺主要发生合成甲醇的反应I和逆水汽变换反应Ⅱ。
加氢合成甲醇是重要的利用途径。该工艺主要发生合成甲醇的反应I和逆水汽变换反应Ⅱ。I.

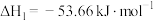 ,
,
Ⅱ.

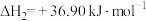 ,
,
Ⅲ:


已知甲醇的选择性
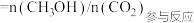
请回答:
(1)

(2)恒温恒容条件下,原料气
 (g)、
(g)、 (g)以物质的量浓度1:3投料时,控制合适条件(不考虑反应Ⅲ),甲醇的选择性为50%。已知初始
(g)以物质的量浓度1:3投料时,控制合适条件(不考虑反应Ⅲ),甲醇的选择性为50%。已知初始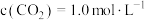 ,
, 平衡转化率为50%,则该条件下
平衡转化率为50%,则该条件下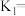
(3)以50Cu/45Zn/5Al为催化剂,催化剂表面金属能吸附
 、CO、
、CO、 分子,反应I和Ⅱ发生在催化剂表面的不同活性位点。在240℃、2MPa条件下,将原料气按照a、b、c、d四种方式以相同流速通过催化剂,测得各组分转化率(X)和选择性(S)如表1所示。另测得
分子,反应I和Ⅱ发生在催化剂表面的不同活性位点。在240℃、2MPa条件下,将原料气按照a、b、c、d四种方式以相同流速通过催化剂,测得各组分转化率(X)和选择性(S)如表1所示。另测得 转化率、甲醇选择性与温度、原料气组成关系如图8、图9所示。
转化率、甲醇选择性与温度、原料气组成关系如图8、图9所示。
表1 催化剂性能与原料气组成的关系
原料气(体积分数)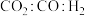 (%) (%) | 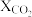 | 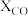 | 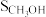 | 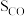 |
| (a)16:0:84 | 18 | 0 | 43 | 56 |
| (b)16:0.6:83.4 | 12 | 0 | 61 | 38 |
| (c)16:2:82 | 11 | 0 | 89 | 11 |
| (d)16:4:80 | 9 | 6.0 | 99 | 0 |
 转化率迅速降低、甲醇选择性急剧增大的原因
转化率迅速降低、甲醇选择性急剧增大的原因②结合表1、图8、图9等有关知识,下列说法正确的是
A.其他条件一定时,原料气中CO体积分数越大,生成甲醇越多
B.一定范围内升高温度利于
 与催化剂活性位点结合,可以提高
与催化剂活性位点结合,可以提高 的转化率
的转化率C.根据图9中的a线,推测温度对反应Ⅱ的速率影响比反应I大
D.增大流速,原料气与催化剂碰撞的机会多,甲醇产率一定增加
③请在图9中画出按照d投料时甲醇的选择性随温度变化的曲线
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】当今,世界多国相继规划了碳达峰、碳中和的时间节点。因此,研发二氧化碳利用技术,降低空气中二氧化碳含量成为研究热点。
(1)目前工业上有一种方法是用 来生产甲醇。一定条件下,在体积为
来生产甲醇。一定条件下,在体积为 的恒容密闭容器中,发生反应:
的恒容密闭容器中,发生反应: 。为了加快反应速率,可采取什么措施(写两条)
。为了加快反应速率,可采取什么措施(写两条)______ 、______ 。
(2) 甲烷化加快了能源结构由化石燃料向可再生碳资源的转变,反应为:
甲烷化加快了能源结构由化石燃料向可再生碳资源的转变,反应为:
 。在两种不同催化剂条件下反应相同时间,测得
。在两种不同催化剂条件下反应相同时间,测得 转化率和生成
转化率和生成 选择性随温度变化的影响如图所示。
选择性随温度变化的影响如图所示。

对比上述两种催化剂的催化性能,工业上应选择的催化剂是______ ,使用的合适温度为______ 。
(3)工业上在 催化下利用
催化下利用 发生如下反应I生产甲醇,同时伴有反应II发生。
发生如下反应I生产甲醇,同时伴有反应II发生。
I.

II.
在温度T时,在容积不变的密闭容器中,充入
 和
和
 ,起始压强为
,起始压强为 ,
, 达平衡时生成
达平衡时生成
 ,测得压强为
,测得压强为 。
。
i.当以下数值不变时,不能说明该反应达到平衡的是______ (填序号)。
A.气体密度 B. 百分含量
百分含量
C. 与
与 体积比 D.
体积比 D. 的体积分数
的体积分数
ii.已知反应I的正反应速率方程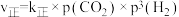 ,逆反应速率方程为
,逆反应速率方程为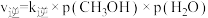 ,其中
,其中 、
、 分别为正逆反应速率常数。达到平衡后,若加入高效催化剂,
分别为正逆反应速率常数。达到平衡后,若加入高效催化剂, 将
将______ (填“增大”、“减小”或“不变”);若升高温度,
______ (填“增大”、“减小”或“不变”)。
iii.平衡时 的物质的量为
的物质的量为______ ,温度T时反应II的化学平衡常数为______ ,若反应速率用单位时间内分压变化表示,则 内反应I的平均反应速率
内反应I的平均反应速率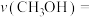
______  。
。
iv.在温度T时,若向加入催化剂的密闭容器中充入
 、
、
 、
、
 和
和
 ,此时反应II的
,此时反应II的
______  (填“
(填“ ”、“
”、“ ”或“
”或“ ”)。
”)。
(1)目前工业上有一种方法是用
 来生产甲醇。一定条件下,在体积为
来生产甲醇。一定条件下,在体积为 的恒容密闭容器中,发生反应:
的恒容密闭容器中,发生反应: 。为了加快反应速率,可采取什么措施(写两条)
。为了加快反应速率,可采取什么措施(写两条)(2)
 甲烷化加快了能源结构由化石燃料向可再生碳资源的转变,反应为:
甲烷化加快了能源结构由化石燃料向可再生碳资源的转变,反应为:
 。在两种不同催化剂条件下反应相同时间,测得
。在两种不同催化剂条件下反应相同时间,测得 转化率和生成
转化率和生成 选择性随温度变化的影响如图所示。
选择性随温度变化的影响如图所示。
对比上述两种催化剂的催化性能,工业上应选择的催化剂是
(3)工业上在
 催化下利用
催化下利用 发生如下反应I生产甲醇,同时伴有反应II发生。
发生如下反应I生产甲醇,同时伴有反应II发生。I.


II.

在温度T时,在容积不变的密闭容器中,充入

 和
和
 ,起始压强为
,起始压强为 ,
, 达平衡时生成
达平衡时生成
 ,测得压强为
,测得压强为 。
。i.当以下数值不变时,不能说明该反应达到平衡的是
A.气体密度 B.
 百分含量
百分含量C.
 与
与 体积比 D.
体积比 D. 的体积分数
的体积分数ii.已知反应I的正反应速率方程
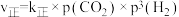 ,逆反应速率方程为
,逆反应速率方程为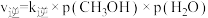 ,其中
,其中 、
、 分别为正逆反应速率常数。达到平衡后,若加入高效催化剂,
分别为正逆反应速率常数。达到平衡后,若加入高效催化剂, 将
将
iii.平衡时
 的物质的量为
的物质的量为 内反应I的平均反应速率
内反应I的平均反应速率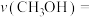
 。
。iv.在温度T时,若向加入催化剂的密闭容器中充入

 、
、
 、
、
 和
和
 ,此时反应II的
,此时反应II的
 (填“
(填“ ”、“
”、“ ”或“
”或“ ”)。
”)。
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐2】含硫废气的处理越来越成为化工生产等领域的重要课题。回答下列问题:
Ⅰ.CO可将工业尾气中的 转化为化工原料羰基硫(COS):
转化为化工原料羰基硫(COS): 。
。
(1)恒温恒容条件下,密闭容器中发生上述反应,下列事实不能说明反应达到平衡状态的是_______ (填序号)。
a.
b.COS和 的浓度之和保持不变
的浓度之和保持不变
c.混合气体的平均相对分子质量不变
d.单位时间内断裂 键与断裂
键与断裂 键数目相等
键数目相等
(2)T℃时,在恒容的密闭容器中充入等物质的量CO和 发生反应,实验测得反应前容器内压强为
发生反应,实验测得反应前容器内压强为 ,10min达到平衡时
,10min达到平衡时 的分压为
的分压为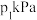 。
。
①CO的平衡转化率为_______ (用含 、
、 的代数式表示),
的代数式表示),
②该反应的平衡常数
_______ (用含 、
、 的代数式表示,列出表达式即可)。
的代数式表示,列出表达式即可)。
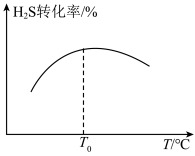
(3)在某密闭容器中,以一定投料比进行上述反应,相同时间内 的转化率与温度(T)的关系如图所示,
的转化率与温度(T)的关系如图所示,
_______ (填“>”或“<”)0,其原因是_______ 。
Ⅱ.工业尾气中的 是环境污染的主要原因之一,工业上可采用钙基固硫法或电解法降低尾气中的含硫量。
是环境污染的主要原因之一,工业上可采用钙基固硫法或电解法降低尾气中的含硫量。
(4)已知:
a.
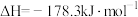
b.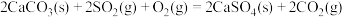

c.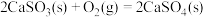

则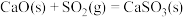

_______ 。在一定温度下,该反应达到平衡时向容器中通入少量 ,则反应再次达到平衡时
,则反应再次达到平衡时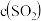 将
将_______ (填“增大”“减小”或“不变”)。
(5)利用如图所示装置可吸收工业尾气中的 ,同时还可吸收尾气中的NO。电解池中膜c为
,同时还可吸收尾气中的NO。电解池中膜c为_______ (填“阴”或“阳”)离子交换膜,阴极的电极反应为_______ ,当利用此装置吸收标准状况下2.24LNO时,阳极区溶液质量变化量为_______ 。
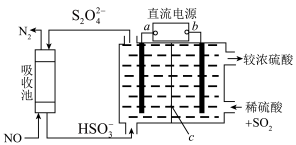
Ⅰ.CO可将工业尾气中的
 转化为化工原料羰基硫(COS):
转化为化工原料羰基硫(COS): 。
。(1)恒温恒容条件下,密闭容器中发生上述反应,下列事实不能说明反应达到平衡状态的是
a.

b.COS和
 的浓度之和保持不变
的浓度之和保持不变c.混合气体的平均相对分子质量不变
d.单位时间内断裂
 键与断裂
键与断裂 键数目相等
键数目相等(2)T℃时,在恒容的密闭容器中充入等物质的量CO和
 发生反应,实验测得反应前容器内压强为
发生反应,实验测得反应前容器内压强为 ,10min达到平衡时
,10min达到平衡时 的分压为
的分压为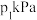 。
。①CO的平衡转化率为
 、
、 的代数式表示),
的代数式表示),②该反应的平衡常数

 、
、 的代数式表示,列出表达式即可)。
的代数式表示,列出表达式即可)。(3)在某密闭容器中,以一定投料比进行上述反应,相同时间内
 的转化率与温度(T)的关系如图所示,
的转化率与温度(T)的关系如图所示,

Ⅱ.工业尾气中的
 是环境污染的主要原因之一,工业上可采用钙基固硫法或电解法降低尾气中的含硫量。
是环境污染的主要原因之一,工业上可采用钙基固硫法或电解法降低尾气中的含硫量。(4)已知:
a.

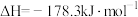
b.
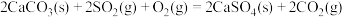

c.
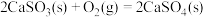

则
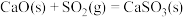

 ,则反应再次达到平衡时
,则反应再次达到平衡时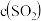 将
将(5)利用如图所示装置可吸收工业尾气中的
 ,同时还可吸收尾气中的NO。电解池中膜c为
,同时还可吸收尾气中的NO。电解池中膜c为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】乙酸乙酯是重要的工业溶剂和香料,广泛用于化纤、橡胶、食品工业等。
 在标准状态时,由元素最稳定的单质生成1mol纯化合物时的反应热称为该化合物的标准摩尔生成。请写出标准状态下,乙酸和乙醇反应的热化学方程式为
在标准状态时,由元素最稳定的单质生成1mol纯化合物时的反应热称为该化合物的标准摩尔生成。请写出标准状态下,乙酸和乙醇反应的热化学方程式为___________ 。

 取等物质的量的乙酸、乙醇在TK下密闭容器中发生液相
取等物质的量的乙酸、乙醇在TK下密闭容器中发生液相 反应物和生成物均为液体
反应物和生成物均为液体 酯化反应,达到平衡,乙酸的转化率为
酯化反应,达到平衡,乙酸的转化率为 ,则该温度下用物质的量分数表示的平衡常数
,则该温度下用物质的量分数表示的平衡常数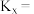
________ ; 注:对于可逆反应:
注:对于可逆反应: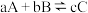 达到化学平衡时,
达到化学平衡时, )。而相同条件下实验室采用回流并分离出水的方式制备乙酸乙酯时,乙酸转化率可以高达
)。而相同条件下实验室采用回流并分离出水的方式制备乙酸乙酯时,乙酸转化率可以高达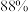 ,可能的原因是
,可能的原因是__________ 。
 若将乙醇与乙酸在催化剂作用下发生气相
若将乙醇与乙酸在催化剂作用下发生气相 反应物和生成物均为气体
反应物和生成物均为气体 酯化反应,其平衡常数与温度关系为:
酯化反应,其平衡常数与温度关系为: 式中T为温度,单位为
式中T为温度,单位为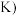 ,则气相酯化反应为
,则气相酯化反应为________  填“吸热”或“放热”
填“吸热”或“放热” 反应。
反应。
 乙酸和乙醇酯化反应在甲、乙两种催化剂的作用下,在相同时间内乙酸乙酯的产率随温度变化如图所示。由图可知,产率为
乙酸和乙醇酯化反应在甲、乙两种催化剂的作用下,在相同时间内乙酸乙酯的产率随温度变化如图所示。由图可知,产率为 时,应该选择催化剂和温度分别是
时,应该选择催化剂和温度分别是________ 、________ ;使用催化剂乙时,当温度高于 ,随温度升高,乙酸乙酯产率下降的原因
,随温度升高,乙酸乙酯产率下降的原因________________________ 。
 为了保护环境,
为了保护环境, 的排放必须控制。化学工作者尝试各种方法将燃煤产生的二氧化碳回收利用,以达到低碳排放的目的。如图是通过人工光合作用,以
的排放必须控制。化学工作者尝试各种方法将燃煤产生的二氧化碳回收利用,以达到低碳排放的目的。如图是通过人工光合作用,以 和
和 为原料制备乙醇
为原料制备乙醇 和
和 的原理示意图:
的原理示意图:

 判断
判断 迁移的方向
迁移的方向________  选填“从左向右”、“从右向左”
选填“从左向右”、“从右向左” 。
。
 写出电极b的电极反应式:
写出电极b的电极反应式:________________ 。
 在标准状态时,由元素最稳定的单质生成1mol纯化合物时的反应热称为该化合物的标准摩尔生成。请写出标准状态下,乙酸和乙醇反应的热化学方程式为
在标准状态时,由元素最稳定的单质生成1mol纯化合物时的反应热称为该化合物的标准摩尔生成。请写出标准状态下,乙酸和乙醇反应的热化学方程式为
 取等物质的量的乙酸、乙醇在TK下密闭容器中发生液相
取等物质的量的乙酸、乙醇在TK下密闭容器中发生液相 反应物和生成物均为液体
反应物和生成物均为液体 酯化反应,达到平衡,乙酸的转化率为
酯化反应,达到平衡,乙酸的转化率为 ,则该温度下用物质的量分数表示的平衡常数
,则该温度下用物质的量分数表示的平衡常数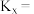
 注:对于可逆反应:
注:对于可逆反应: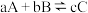 达到化学平衡时,
达到化学平衡时, )。而相同条件下实验室采用回流并分离出水的方式制备乙酸乙酯时,乙酸转化率可以高达
)。而相同条件下实验室采用回流并分离出水的方式制备乙酸乙酯时,乙酸转化率可以高达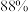 ,可能的原因是
,可能的原因是 若将乙醇与乙酸在催化剂作用下发生气相
若将乙醇与乙酸在催化剂作用下发生气相 反应物和生成物均为气体
反应物和生成物均为气体 酯化反应,其平衡常数与温度关系为:
酯化反应,其平衡常数与温度关系为: 式中T为温度,单位为
式中T为温度,单位为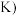 ,则气相酯化反应为
,则气相酯化反应为 填“吸热”或“放热”
填“吸热”或“放热” 反应。
反应。 乙酸和乙醇酯化反应在甲、乙两种催化剂的作用下,在相同时间内乙酸乙酯的产率随温度变化如图所示。由图可知,产率为
乙酸和乙醇酯化反应在甲、乙两种催化剂的作用下,在相同时间内乙酸乙酯的产率随温度变化如图所示。由图可知,产率为 时,应该选择催化剂和温度分别是
时,应该选择催化剂和温度分别是 ,随温度升高,乙酸乙酯产率下降的原因
,随温度升高,乙酸乙酯产率下降的原因
 为了保护环境,
为了保护环境, 的排放必须控制。化学工作者尝试各种方法将燃煤产生的二氧化碳回收利用,以达到低碳排放的目的。如图是通过人工光合作用,以
的排放必须控制。化学工作者尝试各种方法将燃煤产生的二氧化碳回收利用,以达到低碳排放的目的。如图是通过人工光合作用,以 和
和 为原料制备乙醇
为原料制备乙醇 和
和 的原理示意图:
的原理示意图:
 判断
判断 迁移的方向
迁移的方向 选填“从左向右”、“从右向左”
选填“从左向右”、“从右向左” 。
。 写出电极b的电极反应式:
写出电极b的电极反应式:
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐1】铁、铬、锰统称为黑色金属,它们的单质、合金及其化合物在科研和生产中有着重要用途。
请回答下列问题:
(1)基态铁原子的价电子轨道表示式为__ 。铁、铬、锰属于周期表中的___ 区元素。
(2)基态铬原子和基态锰原子中第一电离能较大的是___ (填元素符号),原因为___ 。
(3)化学式为CrC13·6H2O的化合物有三种结构,一种呈紫罗兰色,一种呈暗绿色,一种呈亮绿色,已知Cr3+的配位数均为6,将它们配制成等体积等浓度的溶液,分别加入足量AgNO3溶液,所得AgC1沉淀的物质的量之比为3:2:1。
①呈暗绿色的配合物内界的化学式为___ 。
②H2O分子的VSEPR模型为___ 。
(4)MnF2和MnCl2均为离子化合物,MnF2的熔点高于MnCl2熔点的原因为___ 。
(5)一氧化锰在医药、冶炼上用途广泛,其立方晶胞结构如图所示。

①该晶胞中由O2-形成的正八面体空隙数目为__ 。
②设NA为阿伏加 德罗常数的值,晶胞中距离最近的两个O2-之间的距离为apm,则MnO晶体的密度ρ=____ g·cm-3。(用含a、NA的代数式表示)。
请回答下列问题:
(1)基态铁原子的价电子轨道表示式为
(2)基态铬原子和基态锰原子中第一电离能较大的是
(3)化学式为CrC13·6H2O的化合物有三种结构,一种呈紫罗兰色,一种呈暗绿色,一种呈亮绿色,已知Cr3+的配位数均为6,将它们配制成等体积等浓度的溶液,分别加入足量AgNO3溶液,所得AgC1沉淀的物质的量之比为3:2:1。
①呈暗绿色的配合物内界的化学式为
②H2O分子的VSEPR模型为
(4)MnF2和MnCl2均为离子化合物,MnF2的熔点高于MnCl2熔点的原因为
(5)一氧化锰在医药、冶炼上用途广泛,其立方晶胞结构如图所示。

①该晶胞中由O2-形成的正八面体空隙数目为
②设NA为阿伏加 德罗常数的值,晶胞中距离最近的两个O2-之间的距离为apm,则MnO晶体的密度ρ=
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐2】某三元锂电池放电时,正极材料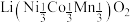 部分变为
部分变为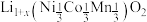 。从废旧三元锂电池正极材料(还含少量Al、Fe等杂质)中回收锂、钴、镍的工艺流程如下:
。从废旧三元锂电池正极材料(还含少量Al、Fe等杂质)中回收锂、钴、镍的工艺流程如下:

回答下列问题:
(1)“酸浸”时,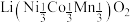 氧化
氧化 的离子方程式为
的离子方程式为__________________ 。
(2)25℃时,几种难溶电解质的溶度积如下:
该“浸出液”中金属离子的起始浓度范围均在0.001~0.01mol/L之间,“除杂”时所得“滤渣”中可能含有的物质有____________ (填化学式)。
(3)“萃取1”是将____________ (填离子符号)萃取入“有机相1”中而除去。“萃取2”时, 、
、 的萃取率与水相pH的关系如图所示。“萃取2”时水相pH控制的最佳范围为
的萃取率与水相pH的关系如图所示。“萃取2”时水相pH控制的最佳范围为____________ (填标号)。

A.4.0~4.5 B.4.5~5.0 C.5.0~5.5 D.5.5~6.0
(4)“沉锂”时,锂的沉淀率越大,最终溶液的pH越小,其原因是________________________ (请结合离子方程式解释原因)。
(5)镍与铁性质相似,均易与一氧化碳作用形成羰基配合物,中心原子价电子数与配位体提供的成键电子数遵循 规则。如:
规则。如: ,则镍与CO形成的配合物化学式为
,则镍与CO形成的配合物化学式为______ ,该镍与CO形成的配合物中 键和
键和 键数目之比为
键数目之比为______ 。
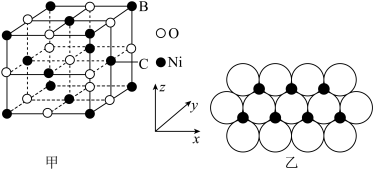
(6)NiO的晶胞结构如图甲所示,其中离子坐标参数A为(0,0,0),B为(1,1,1),则C的离子坐标参数为______ 。一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为 作密置单层排列,
作密置单层排列, 填充其中(如图乙),已知
填充其中(如图乙),已知 的半径为a pm,设阿伏加德罗常数值为
的半径为a pm,设阿伏加德罗常数值为 ,每平方米面积上具有该晶体的质量为
,每平方米面积上具有该晶体的质量为______ g(用含a、 的代数式表示)。
的代数式表示)。
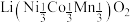 部分变为
部分变为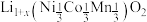 。从废旧三元锂电池正极材料(还含少量Al、Fe等杂质)中回收锂、钴、镍的工艺流程如下:
。从废旧三元锂电池正极材料(还含少量Al、Fe等杂质)中回收锂、钴、镍的工艺流程如下:
回答下列问题:
(1)“酸浸”时,
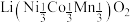 氧化
氧化 的离子方程式为
的离子方程式为(2)25℃时,几种难溶电解质的溶度积如下:
化学式 |
|
|
|
|
|
溶度积 |
|
|
|
|
|
该“浸出液”中金属离子的起始浓度范围均在0.001~0.01mol/L之间,“除杂”时所得“滤渣”中可能含有的物质有
(3)“萃取1”是将
 、
、 的萃取率与水相pH的关系如图所示。“萃取2”时水相pH控制的最佳范围为
的萃取率与水相pH的关系如图所示。“萃取2”时水相pH控制的最佳范围为
A.4.0~4.5 B.4.5~5.0 C.5.0~5.5 D.5.5~6.0
(4)“沉锂”时,锂的沉淀率越大,最终溶液的pH越小,其原因是
(5)镍与铁性质相似,均易与一氧化碳作用形成羰基配合物,中心原子价电子数与配位体提供的成键电子数遵循
 规则。如:
规则。如: ,则镍与CO形成的配合物化学式为
,则镍与CO形成的配合物化学式为 键和
键和 键数目之比为
键数目之比为(6)NiO的晶胞结构如图甲所示,其中离子坐标参数A为(0,0,0),B为(1,1,1),则C的离子坐标参数为
 作密置单层排列,
作密置单层排列, 填充其中(如图乙),已知
填充其中(如图乙),已知 的半径为a pm,设阿伏加德罗常数值为
的半径为a pm,设阿伏加德罗常数值为 ,每平方米面积上具有该晶体的质量为
,每平方米面积上具有该晶体的质量为 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
【推荐3】钴是航空、军事和机械工业中不可或缺的金属,一种从含钴废料(主要含钴、钡、钛的化合物)中提取金属钴的工艺流程如下:
回答下列问题:
(1)晶体钴中钴原子的堆积方式如图所示,钴原子的配位数为_______ 。_______ (填化学式),此工序中浸出温度与Co浸出率的关系如图所示,综合考虑成本和浸出率,选择的最佳浸出温度为_______ ℃。_______ 。
(4)电镀废水中含有的络合态镍(II)和甘氨酸铬(III)等重金属污染已成为世界性环境问题。常用的处理方法是纳米零价铁法。
①制备纳米零价铁:
将FeCl3和NaBH4溶液在乙醇和水的混合溶液中混合搅拌(N2氛围),充分反应得到纳米零价铁、H3BO3、HCl、NaCl和H2.写出该反应的化学方程式:_______ 。
②纳米零价铁处理甘氨酸铬:
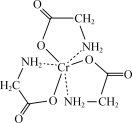
I.甘氨酸铬(结构简式如图所示)分子中与铬配位的原子为_______ 。_______ 。

回答下列问题:
(1)晶体钴中钴原子的堆积方式如图所示,钴原子的配位数为


(4)电镀废水中含有的络合态镍(II)和甘氨酸铬(III)等重金属污染已成为世界性环境问题。常用的处理方法是纳米零价铁法。
①制备纳米零价铁:
将FeCl3和NaBH4溶液在乙醇和水的混合溶液中混合搅拌(N2氛围),充分反应得到纳米零价铁、H3BO3、HCl、NaCl和H2.写出该反应的化学方程式:
②纳米零价铁处理甘氨酸铬:
I.甘氨酸铬(结构简式如图所示)分子中与铬配位的原子为

您最近一年使用:0次