氮氧化物是形成雾霾的重要原因之一,综合治理氮氧化物,还自然一片蓝天。回答下列问题:
(1)通常可采用氢气进行催化还原,消除NO造成的污染。
已知:①N2(g)+O2(g)=2NO(g) H=akJ/mol;
H=akJ/mol;
②2H2(g)+O2(g)=2H2O(1) H=bkJ/mol;
H=bkJ/mol;
③H2O(g)=H2O(l) H=ckJ/mol
H=ckJ/mol
写出H2与NO反应生成N2和水蒸气的热化学方程式:___________ 。
(2)已知Cl2可与NO作用:2NO(g)+Cl2(g) 2ClNO(g)
2ClNO(g)  H<0,反应的速率方程式为:v正=k正·c2(NO)·c(Cl2),v逆=k逆·c2(ClNO),k正、k逆表示速率常数,与温度、活化能有关。
H<0,反应的速率方程式为:v正=k正·c2(NO)·c(Cl2),v逆=k逆·c2(ClNO),k正、k逆表示速率常数,与温度、活化能有关。
①升高温度,k正的变化程度___________ (填“大于”小于”或“等于”)k逆的变化程度。
②某温度条件下,向2L恒容密闭容器中加入2molNO和1molCl2,测得初始压强是平衡时压强的1.2倍。则该温度下平衡常数K=___________ 。若平衡时压强为p,则Kp=___________ (用p表示)。
(3)工业烟气中的氮氧化物可用NH3催化还原,发生反应:4NH3(g)+6NO(g)=5N2(g)+6H2O(g) H<0,研究表明不同氨氮比m=
H<0,研究表明不同氨氮比m= 条件下测得NO的残留率与温度关系如图所示。
条件下测得NO的残留率与温度关系如图所示。___________ 。
②随着温度不断升高,NO的残留率趋近相同,说明温度对NO残留率的影响___________ (填“大于”或“小于”)氨氮比的影响。
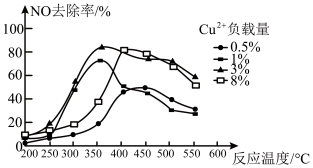
(4)工业烟气中的氮氧化物也可用C2H4脱硝。为研究温度、催化剂中Cu2+负载量对NO去除率的影响,控制其它条件一定,实验结果如图所示。为达到最高的NO去除率,应选择的反应温度约为___________ (填序号,下同),Cu2+负载量为___________ 。
(1)通常可采用氢气进行催化还原,消除NO造成的污染。
已知:①N2(g)+O2(g)=2NO(g)
 H=akJ/mol;
H=akJ/mol;②2H2(g)+O2(g)=2H2O(1)
 H=bkJ/mol;
H=bkJ/mol;③H2O(g)=H2O(l)
 H=ckJ/mol
H=ckJ/mol写出H2与NO反应生成N2和水蒸气的热化学方程式:
(2)已知Cl2可与NO作用:2NO(g)+Cl2(g)
 2ClNO(g)
2ClNO(g)  H<0,反应的速率方程式为:v正=k正·c2(NO)·c(Cl2),v逆=k逆·c2(ClNO),k正、k逆表示速率常数,与温度、活化能有关。
H<0,反应的速率方程式为:v正=k正·c2(NO)·c(Cl2),v逆=k逆·c2(ClNO),k正、k逆表示速率常数,与温度、活化能有关。①升高温度,k正的变化程度
②某温度条件下,向2L恒容密闭容器中加入2molNO和1molCl2,测得初始压强是平衡时压强的1.2倍。则该温度下平衡常数K=
(3)工业烟气中的氮氧化物可用NH3催化还原,发生反应:4NH3(g)+6NO(g)=5N2(g)+6H2O(g)
 H<0,研究表明不同氨氮比m=
H<0,研究表明不同氨氮比m= 条件下测得NO的残留率与温度关系如图所示。
条件下测得NO的残留率与温度关系如图所示。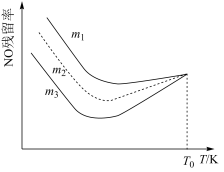
②随着温度不断升高,NO的残留率趋近相同,说明温度对NO残留率的影响
(4)工业烟气中的氮氧化物也可用C2H4脱硝。为研究温度、催化剂中Cu2+负载量对NO去除率的影响,控制其它条件一定,实验结果如图所示。为达到最高的NO去除率,应选择的反应温度约为
更新时间:2024-05-04 17:22:58
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】利用“萨巴蒂尔反应”,空间站的水气整合系统将CO2转化为CH4和水蒸气,配合O2
生成系统可实现O2的再生。回答下列问题:
I.萨巴蒂尔反应为CO2(g)十4H2(g) CH4(g) + 2H2O(g) ∆H
CH4(g) + 2H2O(g) ∆H
(1)已知25°C和101 kPa时,①H2(g)的燃烧热△H=- 285. 8 kJ●mol-1;
②CH4(g)的燃烧热∆H=- 890. 3 kJ●mol-1;
③H2O(g)=H2O (l) ∆H=-44.0 kJ●mol-1。
则萨巴蒂尔反应的∆H=_______ kJ●mol-1。
(2)萨巴蒂尔反应的前三步反应历程如图所示,其中吸附在催化剂Pt/SiO2表面的物质用“*”标注,Ts表示过渡态。从物质吸附在催化剂表面到形成过渡态的过程会_______ (填“放出”或“吸收”)热量,反应历程中最小能垒(活化能)步骤的化学方程式为_______ 。

II.CO2在一定条件下能与H2O发生氧再生反应:CO2(g) +2H2O(g) CH4(g)+ 2O2(g) ∆H=+802.3 kJ●mol-1
CH4(g)+ 2O2(g) ∆H=+802.3 kJ●mol-1
(3)恒压p0条件下,按c(CO2) : c(H2O)=1 : 2投料,进行氧再生反应,测得不同温度下平衡时体系中各物质浓度的关系如图所示。350 ℃时,该反应的平衡常数Kp=_______ (以分压表示,分压=总压×物质的量分数)。为了提高CO2的转化率,除升高温度外,还可采取的措施为_______ (写出一条)。

(4)氧再生反应还可以通过酸性条件下半导体光催化转化实现,反应机理如图甲所示:

①光催化CO2转化为CH4时,阴极的电极反应式为_______ 。
②催化剂的催化效率和CH4的生成速率随温度的变化关系如图乙所示。300~400℃之间,CH4生成速率加快的原因是_______ 。

(5)氧再生反应所需的能量可由合成氨反应提供。合成氨反应的焓变和熵变如下:N2 (g) +3H2(g) 2NH3(g) ∆H= -92.4 kJ●mol-1 ∆S=-200J·K-1●mol-1常温(298 K)下,合成氨反应的自由能∆G=
2NH3(g) ∆H= -92.4 kJ●mol-1 ∆S=-200J·K-1●mol-1常温(298 K)下,合成氨反应的自由能∆G=_______ kJ ●mol-1, 合成氨反应在常温下_______ (填“能”或“不能”)自发进行。
生成系统可实现O2的再生。回答下列问题:
I.萨巴蒂尔反应为CO2(g)十4H2(g)
 CH4(g) + 2H2O(g) ∆H
CH4(g) + 2H2O(g) ∆H(1)已知25°C和101 kPa时,①H2(g)的燃烧热△H=- 285. 8 kJ●mol-1;
②CH4(g)的燃烧热∆H=- 890. 3 kJ●mol-1;
③H2O(g)=H2O (l) ∆H=-44.0 kJ●mol-1。
则萨巴蒂尔反应的∆H=
(2)萨巴蒂尔反应的前三步反应历程如图所示,其中吸附在催化剂Pt/SiO2表面的物质用“*”标注,Ts表示过渡态。从物质吸附在催化剂表面到形成过渡态的过程会

II.CO2在一定条件下能与H2O发生氧再生反应:CO2(g) +2H2O(g)
 CH4(g)+ 2O2(g) ∆H=+802.3 kJ●mol-1
CH4(g)+ 2O2(g) ∆H=+802.3 kJ●mol-1(3)恒压p0条件下,按c(CO2) : c(H2O)=1 : 2投料,进行氧再生反应,测得不同温度下平衡时体系中各物质浓度的关系如图所示。350 ℃时,该反应的平衡常数Kp=

(4)氧再生反应还可以通过酸性条件下半导体光催化转化实现,反应机理如图甲所示:

①光催化CO2转化为CH4时,阴极的电极反应式为
②催化剂的催化效率和CH4的生成速率随温度的变化关系如图乙所示。300~400℃之间,CH4生成速率加快的原因是

(5)氧再生反应所需的能量可由合成氨反应提供。合成氨反应的焓变和熵变如下:N2 (g) +3H2(g)
 2NH3(g) ∆H= -92.4 kJ●mol-1 ∆S=-200J·K-1●mol-1常温(298 K)下,合成氨反应的自由能∆G=
2NH3(g) ∆H= -92.4 kJ●mol-1 ∆S=-200J·K-1●mol-1常温(298 K)下,合成氨反应的自由能∆G=
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐2】从含铅废料(PbSO4、PbO2、PbO等)中回收铅,实现铅的再生意义重大。一种回收铅的工作流程如下:
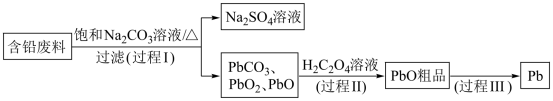
(1)铅和碳元素同主族,比碳多4个电子层,则铅元素的原子序数为______ ;铅蓄电池放电对,PbO2作______ 极。
(2)过程Ⅰ,已知:PbSO4、PbCO3的溶解度(20℃)见图1;相关物质溶解度见图2。

①根据图1写出过程Ⅰ的离子方程式:__________________ 。
②生产过程中的温度应保持在40℃,若温度降低,PbSO4的转化速率下降。根据图2,解释原因:
i.温度降低,反应速率降低;
ii.___________________ (请你提出一种合理解释)
(3)过程Ⅱ:发生反应2PbO2+H2C2O4=2PbO+H2O2+2CO2↑
请写出草酸的电子式________ 。PbO与Al2O3性质相似,PbO与氢氧化钠溶液反应的离子方程式是______________________ 。
(4)过程Ⅲ:将PbO粗品溶解在H2SO4和NaCl的混合溶液中,得到含Na2PbCl4的电解液,电解Na2PbCl4溶液生成Pb,如图。

①阴极的电极反应式是_____________________ 。
②电解一段时间后,Na2PbCl4浓度极大下降,为了能使电解过程持续进行,阴极区采取的方法是____________ 。

(1)铅和碳元素同主族,比碳多4个电子层,则铅元素的原子序数为
(2)过程Ⅰ,已知:PbSO4、PbCO3的溶解度(20℃)见图1;相关物质溶解度见图2。

①根据图1写出过程Ⅰ的离子方程式:
②生产过程中的温度应保持在40℃,若温度降低,PbSO4的转化速率下降。根据图2,解释原因:
i.温度降低,反应速率降低;
ii.
(3)过程Ⅱ:发生反应2PbO2+H2C2O4=2PbO+H2O2+2CO2↑
请写出草酸的电子式
(4)过程Ⅲ:将PbO粗品溶解在H2SO4和NaCl的混合溶液中,得到含Na2PbCl4的电解液,电解Na2PbCl4溶液生成Pb,如图。

①阴极的电极反应式是
②电解一段时间后,Na2PbCl4浓度极大下降,为了能使电解过程持续进行,阴极区采取的方法是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐3】铂(78Pt)被誉为“第一重要的高技术金属”,因独特的物理化学性质,被广泛应用于汽车、石油化工、电气电子等现代工业中。水合肼还原精炼法是铂精炼的方法之一,流程如下:

已知:①氯铂酸铵[(NH4)2PtCl6],黄色,难溶于水,易溶于盐酸并生成H2PtCl6;
②氯亚铂酸铵[(NH4)2PtCl4],红色,易溶于水。
回答下列问题:
(1)铂位于周期表中第______ 周期,试写出一种金属铂在中学化学中的应用____________
(2)工业原料粗氯铂酸铵中含有大量氯化铵等可溶性的盐,在实验室中预处理时,需将样品溶解过滤后洗涤,洗涤沉淀方法是____________
(3)在还原溶解中观察到的现象:__________
(4)氧化沉淀过程的反应方程式为:___________
(5)有研究表明,氯铂酸铵制取金属铂,除了煅烧外,也可将其溶解于盐酸中,加入Zn,得到产品,反应过程有Zn+2HCl = ZnCl2+H2↑;_________
(6)水合肼还原精炼法在溶解时的固液比、溶液的酸度(盐酸浓度)、反应时间等对于精炼铂的产率,均有较大的影响。在不同酸度下达到较高产率所需时间,以及不同固液比在最佳酸度下反应时间与产率关系如图所示,由此可得最佳的反应条件是_________


已知:①氯铂酸铵[(NH4)2PtCl6],黄色,难溶于水,易溶于盐酸并生成H2PtCl6;
②氯亚铂酸铵[(NH4)2PtCl4],红色,易溶于水。
回答下列问题:
(1)铂位于周期表中第
(2)工业原料粗氯铂酸铵中含有大量氯化铵等可溶性的盐,在实验室中预处理时,需将样品溶解过滤后洗涤,洗涤沉淀方法是
(3)在还原溶解中观察到的现象:
(4)氧化沉淀过程的反应方程式为:
(5)有研究表明,氯铂酸铵制取金属铂,除了煅烧外,也可将其溶解于盐酸中,加入Zn,得到产品,反应过程有Zn+2HCl = ZnCl2+H2↑;
(6)水合肼还原精炼法在溶解时的固液比、溶液的酸度(盐酸浓度)、反应时间等对于精炼铂的产率,均有较大的影响。在不同酸度下达到较高产率所需时间,以及不同固液比在最佳酸度下反应时间与产率关系如图所示,由此可得最佳的反应条件是

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】化学反应往往伴随着能量变化。已知下列反应:

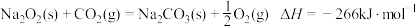
请回答下列问题:
(1) 的燃烧热
的燃烧热 =
=_______  。
。
(2)在催化剂作用下,一氧化碳可与过氧化钠反应生成固体碳酸钠,该反应的热化学方程式为_______ 。
(3)工业废气中的 可用碱液吸收。发生的反应如下:
可用碱液吸收。发生的反应如下:
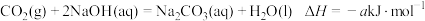

①反应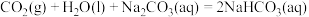 的
的 =
=_______  (用含a、b的代数式表示)。
(用含a、b的代数式表示)。
②标况下,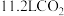 与足量的
与足量的 溶液充分反应后,放出的热量为
溶液充分反应后,放出的热量为_______  (用含a或b的代数式表示)。
(用含a或b的代数式表示)。
(4)生产液晶显示器的过程中使用的化学清洗剂 是一种温室气体,其存储能量的能力是
是一种温室气体,其存储能量的能力是 的12000~20000倍,在大气中的寿命可长达740年之久,表中是几种化学键的键能:
的12000~20000倍,在大气中的寿命可长达740年之久,表中是几种化学键的键能:
写出利用 和
和 制备
制备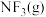 的热化学方程式:
的热化学方程式:_______ 。

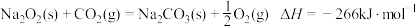
请回答下列问题:
(1)
 的燃烧热
的燃烧热 =
= 。
。(2)在催化剂作用下,一氧化碳可与过氧化钠反应生成固体碳酸钠,该反应的热化学方程式为
(3)工业废气中的
 可用碱液吸收。发生的反应如下:
可用碱液吸收。发生的反应如下: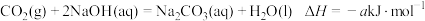

①反应
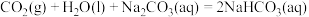 的
的 =
= (用含a、b的代数式表示)。
(用含a、b的代数式表示)。②标况下,
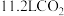 与足量的
与足量的 溶液充分反应后,放出的热量为
溶液充分反应后,放出的热量为 (用含a或b的代数式表示)。
(用含a或b的代数式表示)。(4)生产液晶显示器的过程中使用的化学清洗剂
 是一种温室气体,其存储能量的能力是
是一种温室气体,其存储能量的能力是 的12000~20000倍,在大气中的寿命可长达740年之久,表中是几种化学键的键能:
的12000~20000倍,在大气中的寿命可长达740年之久,表中是几种化学键的键能:| 化学键 | N≡N | F—F | N—F |
键能/( ) ) | 941.7 | 154.8 | 283.0 |
 和
和 制备
制备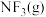 的热化学方程式:
的热化学方程式:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】苯乙烯是用来制备重要高分子聚苯乙烯的原料。以水蒸气做稀释剂、催化剂存在条件下,乙苯催化脱氢可生成苯乙烯。可能发生如下两个反应:
主反应: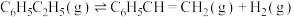

副反应: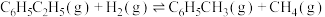

(1)已知,在298K、101kPa条件下,某些物质的相对能量( )变化关系如图所示:
)变化关系如图所示:


___________  。
。
(2)在不同的温度条件下,以水烃比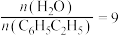 投料,在膜反应器中发生乙苯脱氢反应。膜反应器可以通过多孔膜移去
投料,在膜反应器中发生乙苯脱氢反应。膜反应器可以通过多孔膜移去 ,提高乙苯的平衡转化率,原理如图所示。
,提高乙苯的平衡转化率,原理如图所示。

已知 移出率
移出率
①忽略副反应。维持体系总压强p恒定,在温度T时,已知乙苯的平衡转化率为 ,
, 的移出率为b,则在该温度下主反应的平衡常数
的移出率为b,则在该温度下主反应的平衡常数
___________ (用 等符号表示)。[对于气相反应,用某组分B的平衡压强
等符号表示)。[对于气相反应,用某组分B的平衡压强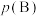 代替物质的量浓度
代替物质的量浓度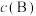 也可表示平衡常数,记作
也可表示平衡常数,记作 ,如
,如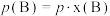 ,p为平衡总压强,
,p为平衡总压强,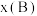 为平衡系统中B的物质的量分数];
为平衡系统中B的物质的量分数];
②乙苯的平衡转化率增长百分数与 的移出率在不同温度条件下的关系如下表:
的移出率在不同温度条件下的关系如下表:
高温下副反应程度极小。试说明当温度高于950℃时,乙苯的平衡转化率随 的移去率的变化改变程度不大的原因:
的移去率的变化改变程度不大的原因:___________ ;
③下列说法正确的是___________ 。
A.生成 的总物质的量与苯乙烯相等
的总物质的量与苯乙烯相等
B.因为 被分离至隔离区,故反应器中不发生副反应
被分离至隔离区,故反应器中不发生副反应
C.在恒容的膜反应器中,其他条件不变,增大水烃比,可提高乙苯的转化率
D.膜反应器可降低反应温度,减少副反应的影响
(3)不同催化剂效能与水烃比有关。保持体系总压为常压的条件下,水烃比为9(曲线Ⅰ)时乙苯的平衡转化率与温度的关系的示意图如下:

①请在图中画出水烃比为1时乙苯的平衡转化率与温度的关系曲线(曲线Ⅱ)__________ ;
②工业上,减小水烃比是降低苯乙烯脱氢装置能耗的一个重要方向。若其他条件不变,减少水烃比,为使反应从起始到平衡均达到或接近原有的反应速率、限度,则可相应的改变的条件:___________ 。
A.升温 B.降温 C.增压 D.减压 E.催化剂
主反应:
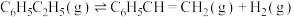

副反应:
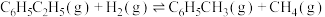

(1)已知,在298K、101kPa条件下,某些物质的相对能量(
 )变化关系如图所示:
)变化关系如图所示:

 。
。(2)在不同的温度条件下,以水烃比
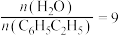 投料,在膜反应器中发生乙苯脱氢反应。膜反应器可以通过多孔膜移去
投料,在膜反应器中发生乙苯脱氢反应。膜反应器可以通过多孔膜移去 ,提高乙苯的平衡转化率,原理如图所示。
,提高乙苯的平衡转化率,原理如图所示。
已知
 移出率
移出率
①忽略副反应。维持体系总压强p恒定,在温度T时,已知乙苯的平衡转化率为
 ,
, 的移出率为b,则在该温度下主反应的平衡常数
的移出率为b,则在该温度下主反应的平衡常数
 等符号表示)。[对于气相反应,用某组分B的平衡压强
等符号表示)。[对于气相反应,用某组分B的平衡压强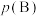 代替物质的量浓度
代替物质的量浓度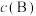 也可表示平衡常数,记作
也可表示平衡常数,记作 ,如
,如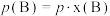 ,p为平衡总压强,
,p为平衡总压强,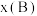 为平衡系统中B的物质的量分数];
为平衡系统中B的物质的量分数];②乙苯的平衡转化率增长百分数与
 的移出率在不同温度条件下的关系如下表:
的移出率在不同温度条件下的关系如下表:| 温度/℃ 增长百分数/%  移出率/% 移出率/% | 700 | 950 | 1000 |
| 60 | 8.43 | 4.38 | 2.77 |
| 80 | 16.8 | 6.1 | 3.8 |
| 90 | 27 | 7.1 | 4.39 |
 的移去率的变化改变程度不大的原因:
的移去率的变化改变程度不大的原因:③下列说法正确的是
A.生成
 的总物质的量与苯乙烯相等
的总物质的量与苯乙烯相等B.因为
 被分离至隔离区,故反应器中不发生副反应
被分离至隔离区,故反应器中不发生副反应C.在恒容的膜反应器中,其他条件不变,增大水烃比,可提高乙苯的转化率
D.膜反应器可降低反应温度,减少副反应的影响
(3)不同催化剂效能与水烃比有关。保持体系总压为常压的条件下,水烃比为9(曲线Ⅰ)时乙苯的平衡转化率与温度的关系的示意图如下:

①请在图中画出水烃比为1时乙苯的平衡转化率与温度的关系曲线(曲线Ⅱ)
②工业上,减小水烃比是降低苯乙烯脱氢装置能耗的一个重要方向。若其他条件不变,减少水烃比,为使反应从起始到平衡均达到或接近原有的反应速率、限度,则可相应的改变的条件:
A.升温 B.降温 C.增压 D.减压 E.催化剂
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】Ⅰ.CH4-CO2催化重整是减少温室气体排放的重要途径。
已知以下的热化学反应方程式:

 kJ·mol-1
kJ·mol-1

 kJ·mol-1
kJ·mol-1

 kJ·mol-1
kJ·mol-1
(1)写出催化重整反应CH4和CO2生成CO和H2的热化学方程式:_______ 。
Ⅱ.CO是煤气的主要成分,与水蒸气反应生成氢气: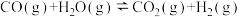 。查阅资料得出相关数据如下:
。查阅资料得出相关数据如下:
(2)通过表格中的数值可以推断:反应
_______ 0,(填“>”或“<”)。该反应升高到一定温度时,反应将不能正向进行,由此判断该反应的
_______ 0,(填“>”或“<”)
(3)在容积为1L的密闭容器中通入1mol CO(g)和1mol H2O(g)发生反应,在400℃时反应达到平衡,此时CO(g)的转化率为_______ 。
(4)在恒温恒容条件下,反应物物质的量均为1mol发生反应,下列不能说明反应达到平衡状态的有_______ (填字母)。
a.体系的压强不再发生变化
b.混合气体的密度不变
c.混合气体的平均相对分子质量不变
d.各组分的物质的量浓度不再改变
e.单位时间内消耗了0.1mol的CO(g),同时消耗了0.1mol的H2(g)
已知以下的热化学反应方程式:

 kJ·mol-1
kJ·mol-1
 kJ·mol-1
kJ·mol-1
 kJ·mol-1
kJ·mol-1(1)写出催化重整反应CH4和CO2生成CO和H2的热化学方程式:
Ⅱ.CO是煤气的主要成分,与水蒸气反应生成氢气:
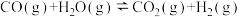 。查阅资料得出相关数据如下:
。查阅资料得出相关数据如下:| 温度(℃) | 400 | 500 |
| 平衡常数 | 9 | 5.3 |


(3)在容积为1L的密闭容器中通入1mol CO(g)和1mol H2O(g)发生反应,在400℃时反应达到平衡,此时CO(g)的转化率为
(4)在恒温恒容条件下,反应物物质的量均为1mol发生反应,下列不能说明反应达到平衡状态的有
a.体系的压强不再发生变化
b.混合气体的密度不变
c.混合气体的平均相对分子质量不变
d.各组分的物质的量浓度不再改变
e.单位时间内消耗了0.1mol的CO(g),同时消耗了0.1mol的H2(g)
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】甲烷是重要的燃料和化工原料,一种利用CO2制备CH4的反应为CO2(g)+4H2(g) CH4(g)+2H2O(g)。T℃下,在2L的恒容密闭容器中通入2molCO2和2molH2,发生上述反应,容器内两种气体的物质的量随时间变化的关系如图所示。回答下列问题:
CH4(g)+2H2O(g)。T℃下,在2L的恒容密闭容器中通入2molCO2和2molH2,发生上述反应,容器内两种气体的物质的量随时间变化的关系如图所示。回答下列问题:___________ ;5~10min内,用H2O(g)表示的平均反应速率v(H2O)=___________ mol/(L·min);下列措施能加快上述反应的正反应速率的是___________ (填标号)。
A.升高温度 B.通入He C.通入CO2 D.分离出CH4
(2)下列情况能说明上述反应已达到平衡状态的是___________ (填标号);反应达到平衡时,H2的转化率为___________ ,平衡时的压强与初始压强的比值为___________ (填最简整数比)。
a.混合气体的密度不再改变
b.n(CO2)∶n(H2)的值不再改变
c.CO2、H2、CH4、H2O同时存在
d.c(CH4):c(H2O)的值不再改变
e.消耗22gCO2的同时生成18gH2O
f.断裂1个H-H键的同时断裂1个C-H键
(3)T℃时,上述反应中相关物质的能量如图所示,若该条件下,反应放出33kJ能量,则共消耗___________ L(换算成标准状况下)H2,生成___________ gCH4。
 CH4(g)+2H2O(g)。T℃下,在2L的恒容密闭容器中通入2molCO2和2molH2,发生上述反应,容器内两种气体的物质的量随时间变化的关系如图所示。回答下列问题:
CH4(g)+2H2O(g)。T℃下,在2L的恒容密闭容器中通入2molCO2和2molH2,发生上述反应,容器内两种气体的物质的量随时间变化的关系如图所示。回答下列问题: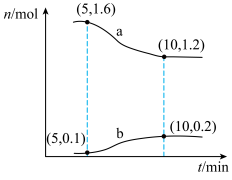
A.升高温度 B.通入He C.通入CO2 D.分离出CH4
(2)下列情况能说明上述反应已达到平衡状态的是
a.混合气体的密度不再改变
b.n(CO2)∶n(H2)的值不再改变
c.CO2、H2、CH4、H2O同时存在
d.c(CH4):c(H2O)的值不再改变
e.消耗22gCO2的同时生成18gH2O
f.断裂1个H-H键的同时断裂1个C-H键
(3)T℃时,上述反应中相关物质的能量如图所示,若该条件下,反应放出33kJ能量,则共消耗
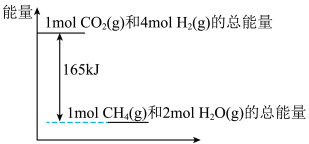
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】二甲醚( )是一种洁净液体燃料,工业上以CO和
)是一种洁净液体燃料,工业上以CO和 为原料生产
为原料生产 。工业制备二甲醚在催化反应室中(压强:2.0~10.0 MIPa.温度:230-280℃)
。工业制备二甲醚在催化反应室中(压强:2.0~10.0 MIPa.温度:230-280℃)
进行下列反应:
反应ⅰ:
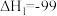 kJ⋅mol
kJ⋅mol
反应ⅱ:
 kJ⋅mol
kJ⋅mol
反应ⅲ:
 kJ⋅mol
kJ⋅mol
(1)在该条件下,若反应i的起始浓度分别为 mol⋅L
mol⋅L ,
, mol⋅L
mol⋅L ,8 min后达到化学平衡状态,CO的转化率为50%,则8 min内CO的平均反应速率为
,8 min后达到化学平衡状态,CO的转化率为50%,则8 min内CO的平均反应速率为_______
(2)在t℃时。反应ⅱ的平衡常数为400,此温度下,在1 L的密闭容器中加入一定的甲醇,反应到某时刻测得各组分的物质的量浓度如下:
此时
_______  (填“>”“<”或“=”)
(填“>”“<”或“=”)
(3)催化总反应为: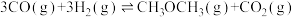

①
_______ kJ⋅mol
②CO的平衡转化率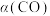 与温度、压强的关系如图所示。图中X代表
与温度、压强的关系如图所示。图中X代表_______ (填“温度”或“压强”)。 。回答下列问题:
。回答下列问题:
①用各物质的平衡浓度表示该反应的平衡常数表达式
_______ 。
②下列有关上述可逆反应的说法正确的是_______ 。
A.断裂 个
个 同时断裂
同时断裂 个
个 键,说明该可逆反应达到平衡
键,说明该可逆反应达到平衡
B.混合气体的平均密度不再改变,说明该可逆反应达到平衡
C.在该容器中充入一定量的氢气,平衡不移动
D.在该容器中充入 ,平衡常数K增大
,平衡常数K增大
E.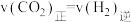 ,说明该可逆反应达到平衡
,说明该可逆反应达到平衡
F.该反应在低温下能自发进行
 )是一种洁净液体燃料,工业上以CO和
)是一种洁净液体燃料,工业上以CO和 为原料生产
为原料生产 。工业制备二甲醚在催化反应室中(压强:2.0~10.0 MIPa.温度:230-280℃)
。工业制备二甲醚在催化反应室中(压强:2.0~10.0 MIPa.温度:230-280℃)进行下列反应:
反应ⅰ:

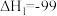 kJ⋅mol
kJ⋅mol
反应ⅱ:

 kJ⋅mol
kJ⋅mol
反应ⅲ:

 kJ⋅mol
kJ⋅mol
(1)在该条件下,若反应i的起始浓度分别为
 mol⋅L
mol⋅L ,
, mol⋅L
mol⋅L ,8 min后达到化学平衡状态,CO的转化率为50%,则8 min内CO的平均反应速率为
,8 min后达到化学平衡状态,CO的转化率为50%,则8 min内CO的平均反应速率为(2)在t℃时。反应ⅱ的平衡常数为400,此温度下,在1 L的密闭容器中加入一定的甲醇,反应到某时刻测得各组分的物质的量浓度如下:
| 物质 |  |  |  |
c/(mol·L ) ) | 0.05 | 2.0 | 2.0 |

 (填“>”“<”或“=”)
(填“>”“<”或“=”)(3)催化总反应为:
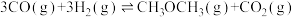

①


②CO的平衡转化率
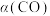 与温度、压强的关系如图所示。图中X代表
与温度、压强的关系如图所示。图中X代表
 。回答下列问题:
。回答下列问题:①用各物质的平衡浓度表示该反应的平衡常数表达式

②下列有关上述可逆反应的说法正确的是
A.断裂
 个
个 同时断裂
同时断裂 个
个 键,说明该可逆反应达到平衡
键,说明该可逆反应达到平衡B.混合气体的平均密度不再改变,说明该可逆反应达到平衡
C.在该容器中充入一定量的氢气,平衡不移动
D.在该容器中充入
 ,平衡常数K增大
,平衡常数K增大E.
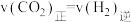 ,说明该可逆反应达到平衡
,说明该可逆反应达到平衡F.该反应在低温下能自发进行
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】乙酸是不仅是生活中的调味品,而且是重要的化工原料,根据所学的相关知回答下列问题。
(1)在实验室我们也可以用如图所示的装置制取乙酸丙酯:

①实验中浓硫酸的作用是_______ ;
②实验中装置中有明显错误,请指出错误_______ 。
(2)在25mL的氢氧化钠溶液中逐滴加入0.2mol/L醋酸溶液,滴定曲线如图所示。

①在B点,a_______ 12.5mL(填“>”“<”或“=”)。
②D点离子浓度大小关系是_______
(3) 乙酸(甲,
乙酸(甲, )和
)和 氯乙酸(CH2ClCOOH乙,
氯乙酸(CH2ClCOOH乙, )的水溶液中,下列可以表示两溶液中由水电离出的
)的水溶液中,下列可以表示两溶液中由水电离出的 与加入水的体积V之间关系的是
与加入水的体积V之间关系的是_______ (填字母)。
a. b.
b. c.
c. d.
d.
(4)在催化剂作用下,CO2和CH4可以直接转化为乙酸:CO2(g)+CH4(g) CH3COOH(g) ∆H=+36.0KJ·mol-1。在不同温度下乙酸的生成速率变化如图所示。
CH3COOH(g) ∆H=+36.0KJ·mol-1。在不同温度下乙酸的生成速率变化如图所示。

①此反应的化学平衡常数表达式为:_______
②欲使乙酸的平衡产率提高,应采取的措施是_______ (填标号)。
A.升高温度 B.降低温度 C.增大压强 D.加入合适的催化剂
③温度在250℃~300℃范围时,乙酸的生成速率减慢的主要原因是_______ 。
(5)工业上主要采用甲醇与CO的羰基化反应来制备乙酸,发生反应如下:CH3OH(g)+CO(g)⇌CH3COOH(l)。在容积为2L恒压密闭容器中通入0.20mol的CH3OH(g)和0.22mol的CO(g),测得甲醇的转化率随温度变化如图所示。

已知在T2温度下,醋酸为液体。则T2时的化学平衡常数为K=_______
(1)在实验室我们也可以用如图所示的装置制取乙酸丙酯:

①实验中浓硫酸的作用是
②实验中装置中有明显错误,请指出错误
(2)在25mL的氢氧化钠溶液中逐滴加入0.2mol/L醋酸溶液,滴定曲线如图所示。

①在B点,a
②D点离子浓度大小关系是
(3)
 乙酸(甲,
乙酸(甲, )和
)和 氯乙酸(CH2ClCOOH乙,
氯乙酸(CH2ClCOOH乙, )的水溶液中,下列可以表示两溶液中由水电离出的
)的水溶液中,下列可以表示两溶液中由水电离出的 与加入水的体积V之间关系的是
与加入水的体积V之间关系的是a.
 b.
b. c.
c. d.
d.
(4)在催化剂作用下,CO2和CH4可以直接转化为乙酸:CO2(g)+CH4(g)
 CH3COOH(g) ∆H=+36.0KJ·mol-1。在不同温度下乙酸的生成速率变化如图所示。
CH3COOH(g) ∆H=+36.0KJ·mol-1。在不同温度下乙酸的生成速率变化如图所示。
①此反应的化学平衡常数表达式为:
②欲使乙酸的平衡产率提高,应采取的措施是
A.升高温度 B.降低温度 C.增大压强 D.加入合适的催化剂
③温度在250℃~300℃范围时,乙酸的生成速率减慢的主要原因是
(5)工业上主要采用甲醇与CO的羰基化反应来制备乙酸,发生反应如下:CH3OH(g)+CO(g)⇌CH3COOH(l)。在容积为2L恒压密闭容器中通入0.20mol的CH3OH(g)和0.22mol的CO(g),测得甲醇的转化率随温度变化如图所示。

已知在T2温度下,醋酸为液体。则T2时的化学平衡常数为K=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】碘及其化合物在人类活动中占有重要地位。回答下列问题:
(1)将 、KI和洗洁精混合后,短时间内产生大量的泡沫。其总反应为
、KI和洗洁精混合后,短时间内产生大量的泡沫。其总反应为 ,能量曲线如下图所示。
,能量曲线如下图所示。

反应过程分为两步:
第一步:
 慢反应
慢反应
第二步:
 快反应
快反应
①
___________ 0(填“>”、“<”或“=”);
②在上图中画出有KI参与,经两步反应生成产物的能量历程图_________ 。
③从热力学角度分析,总反应在___________ 条件下可以自发进行(填“低温”“高温”或“任何温度”)
(2)已知:25℃下,存在以下平衡(不考虑碘与水以及其它反应),
(i)
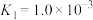
(ii)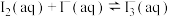

(iii)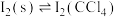
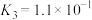
烧杯甲:将 加入20mL水中(含
加入20mL水中(含 沉淀);
沉淀);
烧杯乙:将 加入20mLKI溶液(含
加入20mLKI溶液(含 沉淀)。
沉淀)。
①甲中存在平衡(i),乙中存在平衡(i)和(ii),下列说法错误的是___________ 。
A.烧杯乙中剩余的 沉淀质量比甲的
沉淀质量比甲的 沉淀质量小
沉淀质量小
B.室温下,甲中加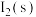 ,溶液中
,溶液中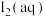 浓度增大
浓度增大
C.乙中通入少量 ,
,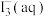 浓度降低
浓度降低
D.通入 ,反应(ii)的平衡常数小于640
,反应(ii)的平衡常数小于640
②为了探究水溶液中含碘微粒的存在形式,进行实验:恒温25℃向10mL KI溶液中加入10mL一定浓度的
KI溶液中加入10mL一定浓度的 溶液,(混合后的体积变化可忽略)。反应后碘元素的相关微粒浓度如表:
溶液,(混合后的体积变化可忽略)。反应后碘元素的相关微粒浓度如表:
其中
___________ (用含c的代数式表示),若___________ (用含a、b、c的代数式表示),说明平衡体系中不含 沉淀。
沉淀。
③向烧杯甲中加入一定量 进行萃取,平衡后无沉淀,上层与下层溶液的碘元素浓度比为
进行萃取,平衡后无沉淀,上层与下层溶液的碘元素浓度比为___________ 。
(3) 可用于电解法制备食盐中的
可用于电解法制备食盐中的 ,装置如图所示。写出电解时阴极反应式
,装置如图所示。写出电解时阴极反应式___________ 。

(1)将
 、KI和洗洁精混合后,短时间内产生大量的泡沫。其总反应为
、KI和洗洁精混合后,短时间内产生大量的泡沫。其总反应为 ,能量曲线如下图所示。
,能量曲线如下图所示。
反应过程分为两步:
第一步:

 慢反应
慢反应第二步:

 快反应
快反应①

②在上图中画出有KI参与,经两步反应生成产物的能量历程图
③从热力学角度分析,总反应在
(2)已知:25℃下,存在以下平衡(不考虑碘与水以及其它反应),
(i)

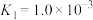
(ii)
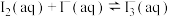

(iii)
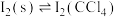
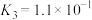
烧杯甲:将
 加入20mL水中(含
加入20mL水中(含 沉淀);
沉淀);烧杯乙:将
 加入20mLKI溶液(含
加入20mLKI溶液(含 沉淀)。
沉淀)。①甲中存在平衡(i),乙中存在平衡(i)和(ii),下列说法错误的是
A.烧杯乙中剩余的
 沉淀质量比甲的
沉淀质量比甲的 沉淀质量小
沉淀质量小B.室温下,甲中加
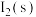 ,溶液中
,溶液中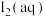 浓度增大
浓度增大C.乙中通入少量
 ,
,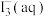 浓度降低
浓度降低D.通入
 ,反应(ii)的平衡常数小于640
,反应(ii)的平衡常数小于640②为了探究水溶液中含碘微粒的存在形式,进行实验:恒温25℃向10mL
 KI溶液中加入10mL一定浓度的
KI溶液中加入10mL一定浓度的 溶液,(混合后的体积变化可忽略)。反应后碘元素的相关微粒浓度如表:
溶液,(混合后的体积变化可忽略)。反应后碘元素的相关微粒浓度如表:| 微粒 |  |  |  |
浓度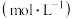 | a | b | c |

 沉淀。
沉淀。③向烧杯甲中加入一定量
 进行萃取,平衡后无沉淀,上层与下层溶液的碘元素浓度比为
进行萃取,平衡后无沉淀,上层与下层溶液的碘元素浓度比为(3)
 可用于电解法制备食盐中的
可用于电解法制备食盐中的 ,装置如图所示。写出电解时阴极反应式
,装置如图所示。写出电解时阴极反应式
您最近一年使用:0次
【推荐2】碳中和是国家重要战略目标,科学家以 和
和 为催化剂用
为催化剂用 将
将 还原
还原 。同时存在副反应:
。同时存在副反应: 。
。
(1)基态镍原子电子排布式为_______ 。
(2)已知 、
、 的燃烧热
的燃烧热 分别为
分别为 ,
,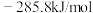 ,室温下
,室温下 与
与 反应生成
反应生成 和液态
和液态 的热化学方程式为
的热化学方程式为_______ 。
(3) 、
、 、
、 的键角从小到大的顺序是
的键角从小到大的顺序是_______ , 、
、 中,C原子的杂化方式分别是
中,C原子的杂化方式分别是_______ 、_______ 。
(4)500℃时,在密闭容器中充入1mol 和4mol
和4mol 进行反应。不考虑副反应,平衡时混合气体总压强为pkPa,其中
进行反应。不考虑副反应,平衡时混合气体总压强为pkPa,其中 与
与 的分压相等,则
的分压相等,则 平衡转化率为
平衡转化率为_______ ,平衡常数
_______ 。(已知:分压=组分物质的量分数×总压)
(5)某温度下, 还原
还原 的转化率和选择性与A、B、C、D四种催化剂的关系如图所示。(已知:
的转化率和选择性与A、B、C、D四种催化剂的关系如图所示。(已知: )
)

该条件下,制取 选用哪种催化剂效果最佳?
选用哪种催化剂效果最佳?_______ (填字母);图中M点是否达到平衡状态?_______ (填“是”或“否”),原因是_______ 。
(6)已知 的晶体结构与
的晶体结构与 相似,其摩尔质量为Mg/mol,晶体密度为
相似,其摩尔质量为Mg/mol,晶体密度为 ,则晶胞中
,则晶胞中 和O最近距离为
和O最近距离为_______ nm(列出计算式, 为阿伏加德罗常数)。
为阿伏加德罗常数)。

 和
和 为催化剂用
为催化剂用 将
将 还原
还原 。同时存在副反应:
。同时存在副反应: 。
。(1)基态镍原子电子排布式为
(2)已知
 、
、 的燃烧热
的燃烧热 分别为
分别为 ,
,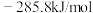 ,室温下
,室温下 与
与 反应生成
反应生成 和液态
和液态 的热化学方程式为
的热化学方程式为(3)
 、
、 、
、 的键角从小到大的顺序是
的键角从小到大的顺序是 、
、 中,C原子的杂化方式分别是
中,C原子的杂化方式分别是(4)500℃时,在密闭容器中充入1mol
 和4mol
和4mol 进行反应。不考虑副反应,平衡时混合气体总压强为pkPa,其中
进行反应。不考虑副反应,平衡时混合气体总压强为pkPa,其中 与
与 的分压相等,则
的分压相等,则 平衡转化率为
平衡转化率为
(5)某温度下,
 还原
还原 的转化率和选择性与A、B、C、D四种催化剂的关系如图所示。(已知:
的转化率和选择性与A、B、C、D四种催化剂的关系如图所示。(已知: )
)
该条件下,制取
 选用哪种催化剂效果最佳?
选用哪种催化剂效果最佳?(6)已知
 的晶体结构与
的晶体结构与 相似,其摩尔质量为Mg/mol,晶体密度为
相似,其摩尔质量为Mg/mol,晶体密度为 ,则晶胞中
,则晶胞中 和O最近距离为
和O最近距离为 为阿伏加德罗常数)。
为阿伏加德罗常数)。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】我国力争实现2030年前碳达峰、2060年前碳中和的目标,CO2的捕集、利用与封存成为科学家研究的重要课题。
(1)CO2甲烷化反应最早由化学家PaulSabatier提出。已知:
反应I:CO2(g)+H2(g) CO(g)+H2O(g) △H=+41.2kJ·mol-1
CO(g)+H2O(g) △H=+41.2kJ·mol-1
反应II:2CO(g)+2H2(g) CO2(g)+CH4(g) △H=-247.1kJ·mol-1
CO2(g)+CH4(g) △H=-247.1kJ·mol-1
①CO2甲烷化反应CO2(g)+4H2(g) CH4(g)+2H2O(g)的△H=
CH4(g)+2H2O(g)的△H=________ kJ·mol-1,为了提高甲烷的产率,反应适宜在________ 条件下进行。
A.低温、高压 B.低温、低压 C.高温、高压 D.高温、低压
②反应I:CO2(g)+H2(g) CO(g)+H2O(g) △H=+41.2kJ·mol-1,已知反应的v正=k正c(CO2)c(H2),v逆=k逆c(H2O)c(CO)(k正、k逆为速率常数,与温度、催化剂有关)若平衡后升高温度,则
CO(g)+H2O(g) △H=+41.2kJ·mol-1,已知反应的v正=k正c(CO2)c(H2),v逆=k逆c(H2O)c(CO)(k正、k逆为速率常数,与温度、催化剂有关)若平衡后升高温度,则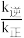
________ (填“增大”、“不变”或“减小”);若反应I在恒容绝热的容器中发生,下列情况下反应一定达到平衡状态的是________ 。
A.容器内的压强不再改变
B.容器内气体密度不再改变
C.容器内c(CO2):c(H2):c(CO):c(H2O)=1:1:1:1
D.单位时间内,断开H-H键的数目和断开H-O键的数目相同
(2)在某催化剂表面:CO2(g)+3H2(g) CH3OH(g)+H2O(g),利用该反应可减少CO2排放,并合成清洁能源。一定条件下,在一密闭容器中充入2molCO2和6molH2发生反应,压强为0.1MPa和5.0MPa下CO2的平衡转化率随温度的变化关系如图所示。
CH3OH(g)+H2O(g),利用该反应可减少CO2排放,并合成清洁能源。一定条件下,在一密闭容器中充入2molCO2和6molH2发生反应,压强为0.1MPa和5.0MPa下CO2的平衡转化率随温度的变化关系如图所示。
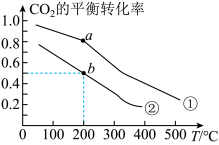
其中表示压强为5.0MPa下CO2的平衡转化率随温度的变化曲线为________ (填“①”或“②”);b点对应的平衡常数Kp=___________ MPa-2。(最后结果用分数表示)(Kp为以平衡分压代替平衡浓度表示的平衡常数,分压=总压×物质的量分数)。
(1)CO2甲烷化反应最早由化学家PaulSabatier提出。已知:
反应I:CO2(g)+H2(g)
 CO(g)+H2O(g) △H=+41.2kJ·mol-1
CO(g)+H2O(g) △H=+41.2kJ·mol-1反应II:2CO(g)+2H2(g)
 CO2(g)+CH4(g) △H=-247.1kJ·mol-1
CO2(g)+CH4(g) △H=-247.1kJ·mol-1①CO2甲烷化反应CO2(g)+4H2(g)
 CH4(g)+2H2O(g)的△H=
CH4(g)+2H2O(g)的△H=A.低温、高压 B.低温、低压 C.高温、高压 D.高温、低压
②反应I:CO2(g)+H2(g)
 CO(g)+H2O(g) △H=+41.2kJ·mol-1,已知反应的v正=k正c(CO2)c(H2),v逆=k逆c(H2O)c(CO)(k正、k逆为速率常数,与温度、催化剂有关)若平衡后升高温度,则
CO(g)+H2O(g) △H=+41.2kJ·mol-1,已知反应的v正=k正c(CO2)c(H2),v逆=k逆c(H2O)c(CO)(k正、k逆为速率常数,与温度、催化剂有关)若平衡后升高温度,则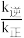
A.容器内的压强不再改变
B.容器内气体密度不再改变
C.容器内c(CO2):c(H2):c(CO):c(H2O)=1:1:1:1
D.单位时间内,断开H-H键的数目和断开H-O键的数目相同
(2)在某催化剂表面:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g),利用该反应可减少CO2排放,并合成清洁能源。一定条件下,在一密闭容器中充入2molCO2和6molH2发生反应,压强为0.1MPa和5.0MPa下CO2的平衡转化率随温度的变化关系如图所示。
CH3OH(g)+H2O(g),利用该反应可减少CO2排放,并合成清洁能源。一定条件下,在一密闭容器中充入2molCO2和6molH2发生反应,压强为0.1MPa和5.0MPa下CO2的平衡转化率随温度的变化关系如图所示。
其中表示压强为5.0MPa下CO2的平衡转化率随温度的变化曲线为
您最近一年使用:0次



