电解质在水溶液中存在各种行为,如电离、水解、沉淀溶解,据所学知识回答下列问题:
(1)t℃时,纯水中c(H+)=1×10-6mol·L-1,该温度下,pH=10的Ba(OH)2溶液的物质的量浓度为_________ mol·L-1。
(2)25℃时,将a mol·L-1的醋酸和b mol·L-1的氢氧化钠溶液等体积混合后,溶液的pH=7,则溶液中c(CH3COO-)+c(CH3COOH)=__________ mol·L-1,a_______ b(填“﹥”、“﹤”或“=”)。
(3)工业上采取用氨水除去SO2,已知25℃,NH3•H2O的Kb=1.8×10-5,H2SO3的Ka1=1.3×10一2,Ka2=6.2×10一8。若氨水的浓度为2.0 mol/ L,溶液中的c(OH-)=_____ mol/ L;将SO2通入该氨水中,当c(OH-)降至2.0×10一6mol/ L时,溶液中的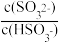 =
=_____________ 。
(4)将AgCl分别放入:①5 mL水②10 mL 0.1 mol·L-1MgCl2溶液③40 mL 0.3mol·L-1盐酸溶液中溶解至溶液饱和④20 mL 0.5mol·L-1NaCl溶液,各溶液中Ag+的浓度分别为a、b、c、d,它们由大到小的排列顺序是____________ (用字母表示)。
(1)t℃时,纯水中c(H+)=1×10-6mol·L-1,该温度下,pH=10的Ba(OH)2溶液的物质的量浓度为
(2)25℃时,将a mol·L-1的醋酸和b mol·L-1的氢氧化钠溶液等体积混合后,溶液的pH=7,则溶液中c(CH3COO-)+c(CH3COOH)=
(3)工业上采取用氨水除去SO2,已知25℃,NH3•H2O的Kb=1.8×10-5,H2SO3的Ka1=1.3×10一2,Ka2=6.2×10一8。若氨水的浓度为2.0 mol/ L,溶液中的c(OH-)=
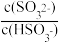 =
=(4)将AgCl分别放入:①5 mL水②10 mL 0.1 mol·L-1MgCl2溶液③40 mL 0.3mol·L-1盐酸溶液中溶解至溶液饱和④20 mL 0.5mol·L-1NaCl溶液,各溶液中Ag+的浓度分别为a、b、c、d,它们由大到小的排列顺序是
更新时间:2019-01-30 12:57:09
|
相似题推荐
计算题
|
适中
(0.65)
【推荐1】在25 ℃时,将a mol·L-1的氨水溶液与0.02 mol·L-1HCl溶液等体积混合后溶液恰好呈中性(忽略溶液混合后体积的变化),用含a的表达式表示25 ℃时NH3·H2O的电离常数Kb=___________ 。用质量分数为17%、密度为0.93 g·cm-3的氨水,配制200 mL a mol·L-1的氨水,所需原氨水的体积V=___________ mL
您最近一年使用:0次
计算题
|
适中
(0.65)
名校
解题方法
【推荐2】(1)25°C时,CH3COOH和NH3H2O的电离常数相等。取10mL0.1molL-1醋酸溶液测得其pH=3。 0.1molL-1氨水(NH3H2O溶液)的pH=_________ 。用pH试纸测定该氨水pH的操作方法为_______ 。
(2)某温度(t°C)时,测得0.01 molL-1的NaOH溶液的pH=11,则该温度下水的KW=_________ 。在此温度下,将pH=a的NaOH溶液VaL与pH=b的H2SO4溶液VbL混合,若所得混合液为中性,且a+b=12, 则Va: Vb_________ 。
(3)25°C时,0.1 molL-1的HA溶液中 。请回答下列问题:
。请回答下列问题:
①HA是_________ (填“强电解质”或“弱电解质”)。
②在加水稀释HA溶液的过程中,随着水量的增加而增大的是_________ (填字母)。
a.c(HA) b. c.c(H+)与c(OH-)的乘积 d.c(OH-)
c.c(H+)与c(OH-)的乘积 d.c(OH-)
(2)某温度(t°C)时,测得0.01 molL-1的NaOH溶液的pH=11,则该温度下水的KW=
(3)25°C时,0.1 molL-1的HA溶液中
 。请回答下列问题:
。请回答下列问题:①HA是
②在加水稀释HA溶液的过程中,随着水量的增加而增大的是
a.c(HA) b.
 c.c(H+)与c(OH-)的乘积 d.c(OH-)
c.c(H+)与c(OH-)的乘积 d.c(OH-)
您最近一年使用:0次
计算题
|
适中
(0.65)
名校
【推荐3】下列物质中:①CH3COOH②NH3③NH4Cl④盐酸⑤NaOH⑥NaHCO3溶液。
(1)属于弱电解质的是____ (填序号,下同),属于强电解质且其水溶液呈碱性的是____ 。
(2)在氨水中存在电离平衡:NH3•H2O NH
NH +OH-。将上述六种物质分别配成0.1mol/L的溶液,向稀氨水中分别滴加少量六种溶液,能使氨水的电离平衡逆向移动且c(NH
+OH-。将上述六种物质分别配成0.1mol/L的溶液,向稀氨水中分别滴加少量六种溶液,能使氨水的电离平衡逆向移动且c(NH )增大的是
)增大的是____ (填序号),此时c(OH-)____ (填“增大”“减小”或“不变”,下同), =
=____ 。
(3)等体积c(H+)相同的盐酸和醋酸分别与0.1mol•L-1的NaOH溶液恰好完全反应,消耗NaOH体积较大的是____ (填化学式),反应过程中醋酸的电离程度____ (填“增大”“减小”或“不变”,下同),n(CH3COO-)____ ,水的电离程度逐渐____ ,水电离的c(H+)=____ 。
(4)已知次氯酸(HClO)的电离平衡常数为Ka=4.0×10-8,向20mL0.1mol•L-1的HClO溶液中滴加少量硫酸,再加水稀释至40mL,此时测得c(H+)=0.05mol•L-1,则溶液中c(ClO-)=____ mol•L-1。
(5)已知亚硫酸(H2SO3)的电离平衡常数为Ka1=1.6×10-2,Ka2=1.0×10-7;碳酸(H2CO3)的电离平衡常数为Ka1=4.0×10-7,Ka2=4.0×10-11。足量的H2SO3溶液和NaHCO3溶液发生反应的主要离子方程式为____ 。
(1)属于弱电解质的是
(2)在氨水中存在电离平衡:NH3•H2O
 NH
NH +OH-。将上述六种物质分别配成0.1mol/L的溶液,向稀氨水中分别滴加少量六种溶液,能使氨水的电离平衡逆向移动且c(NH
+OH-。将上述六种物质分别配成0.1mol/L的溶液,向稀氨水中分别滴加少量六种溶液,能使氨水的电离平衡逆向移动且c(NH )增大的是
)增大的是 =
=(3)等体积c(H+)相同的盐酸和醋酸分别与0.1mol•L-1的NaOH溶液恰好完全反应,消耗NaOH体积较大的是
(4)已知次氯酸(HClO)的电离平衡常数为Ka=4.0×10-8,向20mL0.1mol•L-1的HClO溶液中滴加少量硫酸,再加水稀释至40mL,此时测得c(H+)=0.05mol•L-1,则溶液中c(ClO-)=
(5)已知亚硫酸(H2SO3)的电离平衡常数为Ka1=1.6×10-2,Ka2=1.0×10-7;碳酸(H2CO3)的电离平衡常数为Ka1=4.0×10-7,Ka2=4.0×10-11。足量的H2SO3溶液和NaHCO3溶液发生反应的主要离子方程式为
您最近一年使用:0次
计算题
|
适中
(0.65)
名校
【推荐1】完成下列问题
(1)某温度(t ℃)时水中的离子浓度图象如下图,a点离子积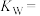
_______ ;该温度下, 的NaOH与
的NaOH与 的
的 等体积混合,溶液显
等体积混合,溶液显_______ 性。

(2)已知室温下, 的电离常数
的电离常数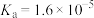 ,若初始时,醋酸中
,若初始时,醋酸中 的浓度为
的浓度为 ,则达到电离平衡时溶液中的
,则达到电离平衡时溶液中的 为
为_______ 。向其中加入少量 固体,当固体溶解后,测得溶液pH
固体,当固体溶解后,测得溶液pH_______ (填“增大”、“减小”或“不变”)。
(1)某温度(t ℃)时水中的离子浓度图象如下图,a点离子积
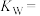
 的NaOH与
的NaOH与 的
的 等体积混合,溶液显
等体积混合,溶液显
(2)已知室温下,
 的电离常数
的电离常数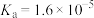 ,若初始时,醋酸中
,若初始时,醋酸中 的浓度为
的浓度为 ,则达到电离平衡时溶液中的
,则达到电离平衡时溶液中的 为
为 固体,当固体溶解后,测得溶液pH
固体,当固体溶解后,测得溶液pH
您最近一年使用:0次
计算题
|
适中
(0.65)
【推荐2】25℃,改变 的
的 溶液的pH,溶液中的
溶液的pH,溶液中的 、
、 、
、 、
、 浓度的对数值lgc与溶液的pH的变化如图所示。
浓度的对数值lgc与溶液的pH的变化如图所示。

(1)求 的
的
___________ ;
(2)求25℃时 的
的 溶液的pH=
溶液的pH=___________ 。
 的
的 溶液的pH,溶液中的
溶液的pH,溶液中的 、
、 、
、 、
、 浓度的对数值lgc与溶液的pH的变化如图所示。
浓度的对数值lgc与溶液的pH的变化如图所示。
(1)求
 的
的
(2)求25℃时
 的
的 溶液的pH=
溶液的pH=
您最近一年使用:0次
计算题
|
适中
(0.65)
名校
解题方法
【推荐1】Ⅰ.氯化铁可用于金属蚀刻,污水处理。
(1)25℃时,FeCl3溶液的pH_______ 7(填“>”、“<”或“=”),原因是(用离子方程式表示)_______ 。把FeCl3溶液蒸干灼烧得到的主要产物是_______ 。
(2)为了探究外界条件对氯化铁水解平衡的影响,某研究性学习小组设计实验方案,获得如下数据:
下列说法正确的是 _______ (填序号)
A.上述实验能判断出温度对氯化铁水解的影响
B.表格中x<y<z
C.上述实验能得出:增大盐的浓度,水解平衡正向移动,水解程度越大
Ⅱ.已知:某酸HA (298K时Ka=4.0×10–7),25℃时,向100mL 0.1mol·L−1HA的溶液中逐滴加入0.2mol·L−1NaOH溶液,所得溶液的pH随NaOH溶液的体积变化如图所示(溶液体积变化忽略不计)。
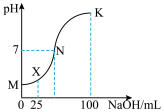
(3)25℃时,0.1mol·L−1HA溶液中由水电离出的c(H+)=_______ mol·L-1。
(4)在X点时,溶液中各离子浓度由大到小的排列顺序是_______ 。
(5)在K点时,溶液中c(OH-)+c(A-)-c(H+)=_______ mol·L−1。
(6)25℃时,NaA的水解平衡常数Kh为_______ (填数值)。
(1)25℃时,FeCl3溶液的pH
(2)为了探究外界条件对氯化铁水解平衡的影响,某研究性学习小组设计实验方案,获得如下数据:
实验 | c(FeCl3)/mol • L−1 | 温度/℃ | pH |
1 | 0.1 | 25 | x |
2 | 0.1 | 35 | y |
3 | 0.2 | 25 | z |
A.上述实验能判断出温度对氯化铁水解的影响
B.表格中x<y<z
C.上述实验能得出:增大盐的浓度,水解平衡正向移动,水解程度越大
Ⅱ.已知:某酸HA (298K时Ka=4.0×10–7),25℃时,向100mL 0.1mol·L−1HA的溶液中逐滴加入0.2mol·L−1NaOH溶液,所得溶液的pH随NaOH溶液的体积变化如图所示(溶液体积变化忽略不计)。

(3)25℃时,0.1mol·L−1HA溶液中由水电离出的c(H+)=
(4)在X点时,溶液中各离子浓度由大到小的排列顺序是
(5)在K点时,溶液中c(OH-)+c(A-)-c(H+)=
(6)25℃时,NaA的水解平衡常数Kh为
您最近一年使用:0次
计算题
|
适中
(0.65)
【推荐2】(1)25 ℃,pH=10的NaOH溶液与PH=12的NaOH溶液等体积混合,则混合后溶液中的PH 约为____________________ 。(已知 lg2=0.3)
(2)T℃ ,水的离子积常数Kw= 1×10-12,欲使PH=1的硫酸溶液与PH=13的NaOH溶液混合后呈中性,则硫酸溶液与NaOH溶液的体积比为_________________ 。
(3)已知25 ℃,碳酸的电离平衡常数Ka1= 4.0×10-7,Ka2= 5.6×10-11,则该温度下NaHCO3的水解平衡常数Kh=________________________ 。
(2)T℃ ,水的离子积常数Kw= 1×10-12,欲使PH=1的硫酸溶液与PH=13的NaOH溶液混合后呈中性,则硫酸溶液与NaOH溶液的体积比为
(3)已知25 ℃,碳酸的电离平衡常数Ka1= 4.0×10-7,Ka2= 5.6×10-11,则该温度下NaHCO3的水解平衡常数Kh=
您最近一年使用:0次
计算题
|
适中
(0.65)
解题方法
【推荐1】难溶电解质的沉淀溶解平衡及其溶度积在生产、科研等领域有着许多的应用。
(1)氯化银在水中存在沉淀溶解平衡:AgCl Ag++Cl-。25℃时,氯化银的Ksp(AgCl)=1.8×10-10。现将足量氯化银分别放入下列溶液:①100mL蒸馏水中;②100mL0.1mol·L-1盐酸中;③100mL0.1mol·L-1氯化铝溶液中;④100mL0.1mol·L-1氯化镁溶液中。充分搅拌后,相同温度下,银离子浓度由大到小的顺序是
Ag++Cl-。25℃时,氯化银的Ksp(AgCl)=1.8×10-10。现将足量氯化银分别放入下列溶液:①100mL蒸馏水中;②100mL0.1mol·L-1盐酸中;③100mL0.1mol·L-1氯化铝溶液中;④100mL0.1mol·L-1氯化镁溶液中。充分搅拌后,相同温度下,银离子浓度由大到小的顺序是_____ (填序号)。在0.1mol·L-1氯化铝溶液中,银离子的浓度最大可达到_____ mol·L-1。
(2)25℃时,1L水中约能溶解2.4×10-3g硫酸钡。
①试计算25℃时硫酸钡的溶度积Ksp(BaSO4)=_____ 。
②当人体中钡离子浓度达到2×10-3mol·L-1时会影响健康,那么硫酸钡可作为“钡餐”的原因是_____ 。
③在25℃时,1L水中约能溶解0.018g碳酸钡,且胃液是酸性的,碳酸钡不能代替硫酸钡作为“钡餐”的理由是_____ 。(要运用题中所给数据,经计算 回答上述②、③两小题)
(3)锅炉水垢会降低燃料利用率,还会形成安全隐患,因此要定期除去锅炉水垢。水垢中含有CaSO4[Ksp(CaSO4)=7.10×10-5],若用1mol·L-1碳酸钠溶液处理,使之转化为疏松、易溶于酸的CacCO3[Ksp(CaCO3)=4.96×10-9],试利用Ksp计算反应的平衡常数说明这一转化的原理_____ 。
(1)氯化银在水中存在沉淀溶解平衡:AgCl
 Ag++Cl-。25℃时,氯化银的Ksp(AgCl)=1.8×10-10。现将足量氯化银分别放入下列溶液:①100mL蒸馏水中;②100mL0.1mol·L-1盐酸中;③100mL0.1mol·L-1氯化铝溶液中;④100mL0.1mol·L-1氯化镁溶液中。充分搅拌后,相同温度下,银离子浓度由大到小的顺序是
Ag++Cl-。25℃时,氯化银的Ksp(AgCl)=1.8×10-10。现将足量氯化银分别放入下列溶液:①100mL蒸馏水中;②100mL0.1mol·L-1盐酸中;③100mL0.1mol·L-1氯化铝溶液中;④100mL0.1mol·L-1氯化镁溶液中。充分搅拌后,相同温度下,银离子浓度由大到小的顺序是(2)25℃时,1L水中约能溶解2.4×10-3g硫酸钡。
①试计算25℃时硫酸钡的溶度积Ksp(BaSO4)=
②当人体中钡离子浓度达到2×10-3mol·L-1时会影响健康,那么硫酸钡可作为“钡餐”的原因是
③在25℃时,1L水中约能溶解0.018g碳酸钡,且胃液是酸性的,碳酸钡不能代替硫酸钡作为“钡餐”的理由是
(3)锅炉水垢会降低燃料利用率,还会形成安全隐患,因此要定期除去锅炉水垢。水垢中含有CaSO4[Ksp(CaSO4)=7.10×10-5],若用1mol·L-1碳酸钠溶液处理,使之转化为疏松、易溶于酸的CacCO3[Ksp(CaCO3)=4.96×10-9],试利用Ksp计算反应的平衡常数说明这一转化的原理
您最近一年使用:0次
计算题
|
适中
(0.65)
【推荐2】某温度下,已知Ksp(AgCl)=1.80×10-10,将2.2×10-3mol·L-1的NaCl和2.0×10-3mol·L-1的AgNO3等体积混合。
(1)判断是否有沉淀生成,写出推理过程____ 。
(2)计算反应后c(Ag+)____ 。
(1)判断是否有沉淀生成,写出推理过程
(2)计算反应后c(Ag+)
您最近一年使用:0次
计算题
|
适中
(0.65)
解题方法
【推荐3】
(1)25℃时,向0.02mol·L-1的MgCl2溶液中加入NaOH固体,如要生成Mg(OH)2沉淀,应使溶液中的c(OH-)最小为____ mol·L-1。
(2)25℃时,向浓度均为0.02mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入NaOH溶液,先生成_______ (填化学式)沉淀;当两种沉淀共存时,
 =
=____ 。已知:25℃时,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。
(1)25℃时,向0.02mol·L-1的MgCl2溶液中加入NaOH固体,如要生成Mg(OH)2沉淀,应使溶液中的c(OH-)最小为
(2)25℃时,向浓度均为0.02mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入NaOH溶液,先生成

 =
=
您最近一年使用:0次

 碳酸电离常数为
碳酸电离常数为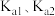 ,当溶液
,当溶液
 时,
时, 溶液中
溶液中 的水解常数
的水解常数 ,则当溶液中
,则当溶液中 时,该溶液的
时,该溶液的


