名校
1 . 二氯异氰尿酸钠(NaC3N3O3Cl2)是一种高效广谱杀菌消毒剂,它常温下为白色固体,难溶于冷水。工业上合成二氯异氰尿酸钠的方法有多种,其中NaClO法是向NaOH溶液通入Cl2产生高浓度NaClO溶液,然后与氰尿酸(C3H3N3O3)反应制取二氯异氰尿酸钠:2NaClO+C3H3N3O3=NaC3N3O3Cl2+NaOH+H2O。
(1)从下面选择所需装置完成实验,按气流从左至右,导管口连接顺序为______ (填小写字母)。
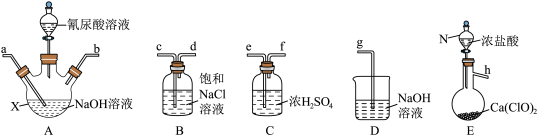
(2)若发现实际操作过程中仪器N中浓盐酸不易流下,可将仪器N换为_________ 。
(3)装置A中制备NaClO溶液完成的现象是___________ ,在加氰尿酸溶液过程仍需不断通入Cl2的理由是___________ 。
(4)有效氯含量是判断产品质量的标准。实验采用碘量法测定产物有效氯的含量,原理为: +H++2H2O=C3H3N3O3+2HClO,HClO+2I-+H+=I2+Cl-+H2O,
+H++2H2O=C3H3N3O3+2HClO,HClO+2I-+H+=I2+Cl-+H2O, ,准确称取1.120g样品,配成250mL溶液;取25.00mL上述溶液于碘量瓶中,加入适量稀硫酸和过量KI溶液,密封在暗处静置5min;加入0.1000mol/LNa2S2O3溶液20.00mL恰好完全反应。
,准确称取1.120g样品,配成250mL溶液;取25.00mL上述溶液于碘量瓶中,加入适量稀硫酸和过量KI溶液,密封在暗处静置5min;加入0.1000mol/LNa2S2O3溶液20.00mL恰好完全反应。
①配制样品溶液时,需要用到的玻璃仪器除烧杯、玻璃棒外,还需要___________ 。
②二氯异氰尿酸钠优质品要求有效氯大于60%,通过计算判断该样品是否为优质品________ 。( 该样品的有效氯  )(写出计算过程)
)(写出计算过程)
③若在检测中加入稀硫酸的量过少,将导致样品的有效氯测定值______ (填“偏高”或“偏低”)。
(5)高铁酸钾是一种重要的多功能绿色净水剂,暗紫色具有金属光泽的粉末,无臭无味,干燥品在室温下稳定,在强碱溶液中稳定。
①配平K2FeO4与水反应的化学方程式,并用单线桥标出电子转移方向和数目________ 。___K2FeO4+____H2O=___Fe(OH)3胶体+____O2↑+____KOH,被还原的元素是___________ 。
②结合高铁酸钾的性质,说明它是一种多功能绿色净水剂的原因:_________ 。
(1)从下面选择所需装置完成实验,按气流从左至右,导管口连接顺序为

(2)若发现实际操作过程中仪器N中浓盐酸不易流下,可将仪器N换为
(3)装置A中制备NaClO溶液完成的现象是
(4)有效氯含量是判断产品质量的标准。实验采用碘量法测定产物有效氯的含量,原理为:
 +H++2H2O=C3H3N3O3+2HClO,HClO+2I-+H+=I2+Cl-+H2O,
+H++2H2O=C3H3N3O3+2HClO,HClO+2I-+H+=I2+Cl-+H2O, ,准确称取1.120g样品,配成250mL溶液;取25.00mL上述溶液于碘量瓶中,加入适量稀硫酸和过量KI溶液,密封在暗处静置5min;加入0.1000mol/LNa2S2O3溶液20.00mL恰好完全反应。
,准确称取1.120g样品,配成250mL溶液;取25.00mL上述溶液于碘量瓶中,加入适量稀硫酸和过量KI溶液,密封在暗处静置5min;加入0.1000mol/LNa2S2O3溶液20.00mL恰好完全反应。①配制样品溶液时,需要用到的玻璃仪器除烧杯、玻璃棒外,还需要
②二氯异氰尿酸钠优质品要求有效氯大于60%,通过计算判断该样品是否为优质品
 )(写出计算过程)
)(写出计算过程)③若在检测中加入稀硫酸的量过少,将导致样品的有效氯测定值
(5)高铁酸钾是一种重要的多功能绿色净水剂,暗紫色具有金属光泽的粉末,无臭无味,干燥品在室温下稳定,在强碱溶液中稳定。
①配平K2FeO4与水反应的化学方程式,并用单线桥标出电子转移方向和数目
②结合高铁酸钾的性质,说明它是一种多功能绿色净水剂的原因:
您最近一年使用:0次
2 . 标签能够提供很多信息。
(一)“84消毒液”能有效杀灭甲型H1N1病毒,某同学购买了一瓶84消毒液,该消毒液通常稀释到100倍(体积比)使用.查阅相关资料和消毒液标签说明得到如图信息:
(1)该84消毒液 物质的量浓度约为
物质的量浓度约为_____________ 。(保留3位有效数字)
(2)已知84消毒液吸收空气中的 转化为
转化为 后就能发挥消毒作用,反应原理为:
后就能发挥消毒作用,反应原理为: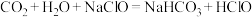 ,瓶上述84消毒液理论上能吸收空气中的
,瓶上述84消毒液理论上能吸收空气中的 的体积为
的体积为_____________ 。(折算到标准状况下,保留3位有效数字)
(3)84消毒液与稀硫酸混合使用可增强消毒能力,请用化学方程式解释其原因_____________ 。
(4))该同学参阅该84消毒液的配方,欲用 固体配制
固体配制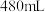 该种84消毒液,需称量
该种84消毒液,需称量 固体的质量为
固体的质量为_____________ 。(保留2位小数)
(5)某消毒小组人员用 的浓硫酸配制
的浓硫酸配制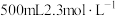 的稀硫酸用于增强84消毒液的消毒能力,需取用浓硫酸的体积为
的稀硫酸用于增强84消毒液的消毒能力,需取用浓硫酸的体积为_____________ 。(保留3位有效数字)
(6)在配制过程中,下列操作中能使所配溶液的浓度偏高的有_____________ (填编号)。
A.用量筒量取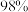 的硫酸时俯视
的硫酸时俯视
B.未等稀释后的 溶液冷却至室温就转移到容量瓶中
溶液冷却至室温就转移到容量瓶中
C.转移前,容量瓶中含有少量蒸馏水
D.定容时,加蒸馏水超过标线,又用胶头滴管吸出
E.定容时,俯视刻度线
F.定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
(7)将质量分数为 ,物质的量浓度为
,物质的量浓度为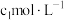 的稀
的稀 蒸发掉一定量的水,使之质量分数变为
蒸发掉一定量的水,使之质量分数变为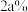 ,此时刻
,此时刻 的物质的量浓度为
的物质的量浓度为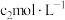 ,则
,则 和
和 的数值关系是
的数值关系是
(二)下图是某品牌饮用矿物质水的标签的部分内容.请认真阅读标签内容(一瓶矿泉水容积为350mL),计算:
(8)镁离子的物质的量浓度的最大值是_____________ 。
(9)一瓶合格的这种矿泉水中硫酸根离子的物质的量不能超过_____________  。
。
(10)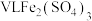 溶液中含
溶液中含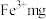 ,则溶液中
,则溶液中 的物质的量浓度为
的物质的量浓度为_____________  。
。
(一)“84消毒液”能有效杀灭甲型H1N1病毒,某同学购买了一瓶84消毒液,该消毒液通常稀释到100倍(体积比)使用.查阅相关资料和消毒液标签说明得到如图信息:
(1)该84消毒液
 物质的量浓度约为
物质的量浓度约为| 84消毒液 (有效成分)  (规格)  (质量分数)  (密度) 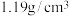 |
 转化为
转化为 后就能发挥消毒作用,反应原理为:
后就能发挥消毒作用,反应原理为: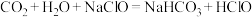 ,瓶上述84消毒液理论上能吸收空气中的
,瓶上述84消毒液理论上能吸收空气中的 的体积为
的体积为(3)84消毒液与稀硫酸混合使用可增强消毒能力,请用化学方程式解释其原因
(4))该同学参阅该84消毒液的配方,欲用
 固体配制
固体配制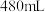 该种84消毒液,需称量
该种84消毒液,需称量 固体的质量为
固体的质量为(5)某消毒小组人员用
 的浓硫酸配制
的浓硫酸配制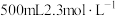 的稀硫酸用于增强84消毒液的消毒能力,需取用浓硫酸的体积为
的稀硫酸用于增强84消毒液的消毒能力,需取用浓硫酸的体积为(6)在配制过程中,下列操作中能使所配溶液的浓度偏高的有
A.用量筒量取
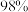 的硫酸时俯视
的硫酸时俯视B.未等稀释后的
 溶液冷却至室温就转移到容量瓶中
溶液冷却至室温就转移到容量瓶中C.转移前,容量瓶中含有少量蒸馏水
D.定容时,加蒸馏水超过标线,又用胶头滴管吸出
E.定容时,俯视刻度线
F.定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
(7)将质量分数为
 ,物质的量浓度为
,物质的量浓度为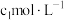 的稀
的稀 蒸发掉一定量的水,使之质量分数变为
蒸发掉一定量的水,使之质量分数变为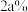 ,此时刻
,此时刻 的物质的量浓度为
的物质的量浓度为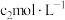 ,则
,则 和
和 的数值关系是
的数值关系是 A. | B. | C.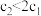 | D.无法确定 |
(二)下图是某品牌饮用矿物质水的标签的部分内容.请认真阅读标签内容(一瓶矿泉水容积为350mL),计算:
(8)镁离子的物质的量浓度的最大值是
| 配料表:纯净水、硫酸镁、氯化钾 保质期:12个月 主要成分: 钾离子  镁离子  氯离子  硫酸根离子 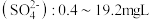 |
 。
。(10)
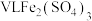 溶液中含
溶液中含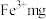 ,则溶液中
,则溶液中 的物质的量浓度为
的物质的量浓度为 。
。
您最近一年使用:0次
名校
解题方法
3 . 人类对物质微观结构的探索从未停歇,随着科学技术的发展,新的发现将继续揭开开原子更深层次结构的奥秘.
(1)原子结构模型的演变顺序正确的是
①道尔顿模型 ②有核模型 ③葡萄干面包模型 ④电子云模型 ⑤玻尔模型
(2)第一位通过实验证明原子可以再分的科学家是
(3)卢瑟福团队用 粒子
粒子 来轰击金箔,该化学符号中4代表的含义是①
来轰击金箔,该化学符号中4代表的含义是①_____________ ;在1~18号元素中,最外层电子数与氦原子相等的元素是②_____________ (填元素符号)。
(4)氦元素在自然界中仅有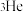 和
和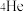 两种原子,它们具有相同的
两种原子,它们具有相同的
(5)当用 粒子轰击金箔时,如图所示的运动轨迹中不可能存在的是
粒子轰击金箔时,如图所示的运动轨迹中不可能存在的是
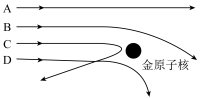
(6)关于 粒子散射实验现象的记载如下:①________的
粒子散射实验现象的记载如下:①________的 粒子都直接穿过金箔,②______的
粒子都直接穿过金箔,②______的 粒子发生偏转,③ 的
粒子发生偏转,③ 的 粒子甚至被直接反弹回去.①②③三处空格分别为
粒子甚至被直接反弹回去.①②③三处空格分别为
(7)通过该试验,卢瑟福得出了原子结构的_____________ 模型。
(8)2022年诺贝尔化学奖授予三位在“点击化学和生物正交化学”方面作出突出贡献的科学家.点击化学的核心理念是,通过小单元的简便拼接,快速可靠地完成各种各样分子的化学合成.在点击化学中,反应快速发生,而且不会产生副产物.下列有关点击化学说法错误的是
(1)原子结构模型的演变顺序正确的是
①道尔顿模型 ②有核模型 ③葡萄干面包模型 ④电子云模型 ⑤玻尔模型
| A.①③②⑤④ | B.①②③④⑤ | C.①⑤③②④ | D.①③⑤④② |
(2)第一位通过实验证明原子可以再分的科学家是
| A.德谟克利特 | B.道尔顿 | C.汤姆孙 | D.卢瑟福 |
(3)卢瑟福团队用
 粒子
粒子 来轰击金箔,该化学符号中4代表的含义是①
来轰击金箔,该化学符号中4代表的含义是①(4)氦元素在自然界中仅有
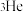 和
和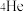 两种原子,它们具有相同的
两种原子,它们具有相同的 | A.质子数 | B.中子数 | C.物理性质 | D.化学性质 |
(5)当用
 粒子轰击金箔时,如图所示的运动轨迹中不可能存在的是
粒子轰击金箔时,如图所示的运动轨迹中不可能存在的是 
| A.A | B.B | C.C | D.D |
(6)关于
 粒子散射实验现象的记载如下:①________的
粒子散射实验现象的记载如下:①________的 粒子都直接穿过金箔,②______的
粒子都直接穿过金箔,②______的 粒子发生偏转,③ 的
粒子发生偏转,③ 的 粒子甚至被直接反弹回去.①②③三处空格分别为
粒子甚至被直接反弹回去.①②③三处空格分别为 | A.绝大多数,极少数,个别 | B.个别,极少数,绝大多数 |
| C.几乎半数,几乎半数,个别 | D.个别,几乎半数,几乎半数 |
(7)通过该试验,卢瑟福得出了原子结构的
(8)2022年诺贝尔化学奖授予三位在“点击化学和生物正交化学”方面作出突出贡献的科学家.点击化学的核心理念是,通过小单元的简便拼接,快速可靠地完成各种各样分子的化学合成.在点击化学中,反应快速发生,而且不会产生副产物.下列有关点击化学说法错误的是
| A.点击化学的反应中会出现新的分子 | B.点击化学的反应中会出现新的原子 |
| C.点击化学能提高反应的准确性 | D.点击化学在生物医疗领域有广泛的应用前景 |
您最近一年使用:0次
名校
解题方法
4 . 原子是化学反应中不可再分的基本微粒,自古以来人们对于原子的研究从未停止过。了解了原子的结构,能够帮助人们更好地从微观角度认识物质并推断它们的性质。
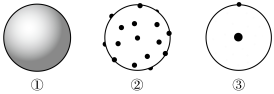
(1)下列图①②③原子结构模型中依次符合卢瑟福、道尔顿、汤姆孙的观点的是___________。
(2)一种元素有质量数分别为35,37的两种核素,该元素的近似相对原子质量为35.5,则两种核素的丰度之比为___________ 。
(3)下列微粒中,具有相同的电子层数与最外层电子数的是___________。
(1)下列图①②③原子结构模型中依次符合卢瑟福、道尔顿、汤姆孙的观点的是___________。

| A.①②③ | B.③①② | C.③②① | D.②①③ |
(2)一种元素有质量数分别为35,37的两种核素,该元素的近似相对原子质量为35.5,则两种核素的丰度之比为
(3)下列微粒中,具有相同的电子层数与最外层电子数的是___________。
| A.He与Li | B. 与 与 | C. 与 与 | D. 与Ar 与Ar |
您最近一年使用:0次
名校
解题方法
5 . 研究物质的微观结构和元素组成,并用恰当的化学用语进行表达,能帮助我们揭示物质变化的本质,发现物质变化的规律。
(1)下图是部分元素原子或离子的结构示意图.请你仔细观察、分析,用序号填空:
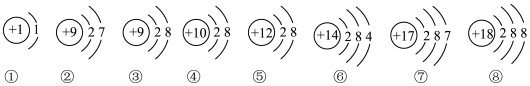
①上述粒子中,属于稀有气体元素的原子是_____________ ;
②在化学反应中容易得到电子的是_____________ ;
③属于正离子的是_____________ ;
④表示 的是
的是_____________ ;
⑤属于同一种元素的是_____________ ;
⑥属于非金属元素的是_____________ ;
⑦电子层数相同、最外层电子数也相同的粒子有_____________ .
(2)卤族元素F和 具有相似的化学性质,其原因是它们的原子具有相同的
具有相似的化学性质,其原因是它们的原子具有相同的
(3)写出铝离子的结构示意图①_____________ ,其核外能量最高的电子层符号为②___________ 。
(4)两种微粒的电子数相同,质子数不同,则它们可能是
①两种不同的原子;②两种不同的离子;③同一种元素的原子和离子;④不同元素的原子和离子
(5)在第n电子层中,当它作为原子的最外电子层时,最多容纳的电子数与 层相同,当它作为原子的次外层时,其电子数比
层相同,当它作为原子的次外层时,其电子数比 层最少能多10个,则此电子层是
层最少能多10个,则此电子层是
(6)一瓶气体经分析只含一种元素,则该气体
(7)下列物质变化过程不会破坏化学键的是
(8)下列关于化学键的说法正确的是
(9) 的电子式是
的电子式是_____________ 。
(10)请用电子式表示 的形成过程
的形成过程_____________ 。
(1)下图是部分元素原子或离子的结构示意图.请你仔细观察、分析,用序号填空:

①上述粒子中,属于稀有气体元素的原子是
②在化学反应中容易得到电子的是
③属于正离子的是
④表示
 的是
的是⑤属于同一种元素的是
⑥属于非金属元素的是
⑦电子层数相同、最外层电子数也相同的粒子有
(2)卤族元素F和
 具有相似的化学性质,其原因是它们的原子具有相同的
具有相似的化学性质,其原因是它们的原子具有相同的 | A.电子层数 | B.核外电子数 | C.最外层电子数 | D.原子半径 |
(3)写出铝离子的结构示意图①
(4)两种微粒的电子数相同,质子数不同,则它们可能是
①两种不同的原子;②两种不同的离子;③同一种元素的原子和离子;④不同元素的原子和离子
| A.①和④ | B.②和③ | C.①和③ | D.②和④ |
(5)在第n电子层中,当它作为原子的最外电子层时,最多容纳的电子数与
 层相同,当它作为原子的次外层时,其电子数比
层相同,当它作为原子的次外层时,其电子数比 层最少能多10个,则此电子层是
层最少能多10个,则此电子层是 | A.K层 | B.M层 | C.L层 | D.N层 |
(6)一瓶气体经分析只含一种元素,则该气体
| A.一定是单质 | B.可能是化合物 |
| C.可能是几种单质的混合物 | D.可能是化合物与单质的混合物 |
(7)下列物质变化过程不会破坏化学键的是
| A.水气化为水蒸气 | B.水蒸气在高温下分解为氢气和氧气 |
| C.氯化钠溶于水 | D.氯化钠熔化 |
(8)下列关于化学键的说法正确的是
| A.破坏化学键会放出能量 | B.所有物质中都存在化学键 |
| C.金属元素和非金属元素间一定形成离子键 | D.离子化合物中不一定含有金属元素 |
(9)
 的电子式是
的电子式是(10)请用电子式表示
 的形成过程
的形成过程
您最近一年使用:0次
名校
解题方法
6 . 室温下,某容积固定的密闭容器由可移动的活塞隔成A、B两室,分别向A、B两室充入 、
、 的混合气体和
的混合气体和 空气,此时活塞位置如图所AB所示,
空气,此时活塞位置如图所AB所示,

(1)A室混合气体的物质的量为__________ ,所含分子总数为__________ 。
(2)若将 、
、 的混合气体点燃引爆。活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央。则原来
的混合气体点燃引爆。活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央。则原来 、
、 的体积之比可能为
的体积之比可能为__________ 。若实验测得A室混合气体的质量为 ,则该混合气体的密度是同温同压下氧气密度的
,则该混合气体的密度是同温同压下氧气密度的__________ 倍。
 、
、 的混合气体和
的混合气体和 空气,此时活塞位置如图所AB所示,
空气,此时活塞位置如图所AB所示,
(1)A室混合气体的物质的量为
(2)若将
 、
、 的混合气体点燃引爆。活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央。则原来
的混合气体点燃引爆。活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央。则原来 、
、 的体积之比可能为
的体积之比可能为 ,则该混合气体的密度是同温同压下氧气密度的
,则该混合气体的密度是同温同压下氧气密度的
您最近一年使用:0次
名校
解题方法
7 . 在测量气体摩尔体积的实验中(利用稀硫酸和镁带反应产生氢气的原理),甲乙两位同学分别选用下列两套装置进行实验。
甲同学装置: 乙同学装置:
乙同学装置:
(1)甲中仪器a的名称__________ 。
(2)上述实验装置,从测量生成的氢气体积的精准度分析,实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积__________ (选填“偏大”或“偏小”)。
(3)气体摩尔体积实验,实验室用镁带和稀硫酸反应产生氢气,来测定氢气的气体摩尔体积,所涉及到的步骤有①读数;②冷却至室温;③调节使水准管和量气管液面相平。正确的顺序是__________ 。
为尽可能确保实验的准确性,同学设计了如图所示的实验装置。

按照相关的操作步骤完成实验后,测得数据如表(温度: ,压强:
,压强: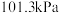 )。
)。
(4)该条件下, 氢气体积为:
氢气体积为:__________ L。(保留1位小数,下同)。
(5)该条件下, 氢气体积的理论值为
氢气体积的理论值为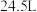 ,则实验相对偏差=
,则实验相对偏差=__________ %。
甲同学装置:
 乙同学装置:
乙同学装置:
(1)甲中仪器a的名称
(2)上述实验装置,从测量生成的氢气体积的精准度分析,实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积
(3)气体摩尔体积实验,实验室用镁带和稀硫酸反应产生氢气,来测定氢气的气体摩尔体积,所涉及到的步骤有①读数;②冷却至室温;③调节使水准管和量气管液面相平。正确的顺序是
实验次数 | 镁带质量(g) | 硫酸体积(mL) |
|
1 | 0.1215 | 10 | 121 |
2 | 0.1165 | 10 | 115 |

按照相关的操作步骤完成实验后,测得数据如表(温度:
 ,压强:
,压强: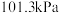 )。
)。(4)该条件下,
 氢气体积为:
氢气体积为:(5)该条件下,
 氢气体积的理论值为
氢气体积的理论值为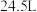 ,则实验相对偏差=
,则实验相对偏差=
您最近一年使用:0次
名校
解题方法
8 . 将标准状况下的 气体溶于
气体溶于 水中(水的密度为
水中(水的密度为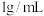 ),得到的盐酸密度为
),得到的盐酸密度为 (即
(即 ),则该盐酸的物质的量浓度是
),则该盐酸的物质的量浓度是__________ (请写出计算过程)。
 气体溶于
气体溶于 水中(水的密度为
水中(水的密度为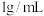 ),得到的盐酸密度为
),得到的盐酸密度为 (即
(即 ),则该盐酸的物质的量浓度是
),则该盐酸的物质的量浓度是
您最近一年使用:0次
名校
解题方法
9 . 如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签回答下列问题:
(1)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是______。
(2)某同学欲用上述浓盐酸和蒸馏水配制 物质的量浓度为
物质的量浓度为 的稀盐酸:需要量取
的稀盐酸:需要量取______ mL上述浓盐酸。
(3)在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?
(填A表示“偏大”、填B表示“偏小”、填C表示“无影响”)
用量筒量取浓盐酸时俯视观察凹液面最低处__________ 。
定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水__________ 。
(4)假设该同学用新配制的盐酸中和含 的氢氧化钠溶液,发现中和氢氧化钠消耗的盐酸比理论所求盐酸体积偏小,则可能的原因是__________。
的氢氧化钠溶液,发现中和氢氧化钠消耗的盐酸比理论所求盐酸体积偏小,则可能的原因是__________。
盐酸 分子式: 相对分子质量:36.5 密度: 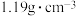  的质量分数:36.5% 的质量分数:36.5% |
| A.溶液中溶质的物质的量 | B.溶液的浓度 |
C.溶液中 的数目 的数目 | D.溶液的密度 |
 物质的量浓度为
物质的量浓度为 的稀盐酸:需要量取
的稀盐酸:需要量取(3)在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?
(填A表示“偏大”、填B表示“偏小”、填C表示“无影响”)
用量筒量取浓盐酸时俯视观察凹液面最低处
定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水
(4)假设该同学用新配制的盐酸中和含
 的氢氧化钠溶液,发现中和氢氧化钠消耗的盐酸比理论所求盐酸体积偏小,则可能的原因是__________。
的氢氧化钠溶液,发现中和氢氧化钠消耗的盐酸比理论所求盐酸体积偏小,则可能的原因是__________。| A.浓盐酸挥发,浓度不足 | B.配制溶液时,未洗涤烧杯 |
| C.配制溶液时,俯视容量瓶刻度线 | D.加水时超过刻度线,用胶头滴管吸出 |
您最近一年使用:0次
名校
解题方法
10 . 溶液X中含有下表离子中的某5种,且其浓度均为 (不考虑水的电离与离子水解)。向X溶液中加入足量稀盐酸,有无色气体生成,经分析,反应前后阴离子种类没有变化。下列叙述不正确的是
(不考虑水的电离与离子水解)。向X溶液中加入足量稀盐酸,有无色气体生成,经分析,反应前后阴离子种类没有变化。下列叙述不正确的是
 (不考虑水的电离与离子水解)。向X溶液中加入足量稀盐酸,有无色气体生成,经分析,反应前后阴离子种类没有变化。下列叙述不正确的是
(不考虑水的电离与离子水解)。向X溶液中加入足量稀盐酸,有无色气体生成,经分析,反应前后阴离子种类没有变化。下列叙述不正确的是阳离子 | 阴离子 |
|
|
| A.X溶液中可能含3种阳离子、2种阴离子 | B.X溶液中不可能含有 或 或 |
C.生成的无色气体是 | D.根据电荷守恒,原溶液中一定含 |
您最近一年使用:0次
2023-04-20更新
|
1291次组卷
|
9卷引用:上海市华东师范大学第二附属中学2021-2022学年高一下学期3月阶段反馈化学试题
(已下线)上海市华东师范大学第二附属中学2021-2022学年高一下学期3月阶段反馈化学试题上海市育才中学2022-2023学年高三上学期10月月考化学试题辽宁省沈阳市铁路实验中学2022-2023学年高一下学期第一次月考化学试题河北省石家庄市第二中学2023-2024高一上学期第一次诊断测评化学试题辽宁省大连市金普新区省示范性高中2022届高三上学期第一次联合考试化学试题黑龙江省鹤岗市绥滨县第一中学2021-2022学年高三上学期期中考试化学试题黑龙江省哈尔滨师范大学附属中学2022-2023学年高三下学期开学考试化学试题黑龙江省哈尔滨师范大学附属中学2024届高三上学期开学考试化学试题河北省秦皇岛市昌黎第一中学2023届高三第一次调研考试化学试题

 、
、 、
、 、
、 、
、 、
、

