1 . 研究物质性质及物质转化具有重要的价值,根据所学知识回答下列问题:
(1)火药是中国的四大发明之一,永远值得华夏儿女骄傲,黑火药在发生爆炸时,发生如下反应: ,其中作氧化剂的是
,其中作氧化剂的是______ (填化学式,下同),被还原的是______ 。
(2)中国古代著作中有“银针验毒”的记录,其原理为 ,则X的化学式是
,则X的化学式是______ ,其中 在该反应中
在该反应中______ (填标号)。
A.作氧化剂 B.作还原剂
C.既是氧化剂又是还原剂 D.既不是氧化剂又不是还原剂
(3)按如图所示操作,充分反应后:

①Ⅱ中发生反应的离子方程式为______ 。
②结合Ⅰ、Ⅱ实验现象可知 、
、 、
、 的氧化性由强到弱的顺序为
的氧化性由强到弱的顺序为______ 。
(1)火药是中国的四大发明之一,永远值得华夏儿女骄傲,黑火药在发生爆炸时,发生如下反应:
 ,其中作氧化剂的是
,其中作氧化剂的是(2)中国古代著作中有“银针验毒”的记录,其原理为
 ,则X的化学式是
,则X的化学式是 在该反应中
在该反应中A.作氧化剂 B.作还原剂
C.既是氧化剂又是还原剂 D.既不是氧化剂又不是还原剂
(3)按如图所示操作,充分反应后:

①Ⅱ中发生反应的离子方程式为
②结合Ⅰ、Ⅱ实验现象可知
 、
、 、
、 的氧化性由强到弱的顺序为
的氧化性由强到弱的顺序为
您最近一年使用:0次
2 . 如图为实验室某浓盐酸试剂瓶标签上的部分数据,试根据标签.上的相关数据回答下列问题:.
(1)该浓盐酸中HCl的物质的量浓度为______ mol/L。
(2)取用任意体积的该盐酸时,下列物理量中不随所取体积的多少而变化的是______(填字母)。
(3)某学生欲用上述浓盐酸和蒸馏水配制480mL物质的量浓度为0.400mol/L的稀盐酸。
①该学生需要量取______ mL上述浓盐酸进行配制。
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(填“偏大”“偏小”或“无影响”)
a.用量筒量取浓盐酸时俯视观察凹液面:______ ;
b.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水:______ 。
(4)①假设该同学成功配制了0.400mol/L的盐酸,他又用该盐酸中和含0.4g NaOH的NaOH溶液,则该同学需取______ mL盐酸。
②假设该同学用新配制的盐酸中和含0.4g NaOH的NaOH溶液,发现比①中所求体积偏小,则可能的原因是______ 。
A.浓盐酸挥发,浓度不足 B.配制溶液时,未洗涤烧杯
C.配制溶液时,俯视容量瓶刻度线 D.加水时超过刻度线,用胶头滴管吸出
| 盐酸 分子式:HCl 相对分子质量:36.5 密度:  HCl的质量分数:36.5% |
(2)取用任意体积的该盐酸时,下列物理量中不随所取体积的多少而变化的是______(填字母)。
| A.溶液中HCl的物质的量 | B.溶液的浓度 |
C.溶液中 的数目 的数目 | D.溶液的密度 |
①该学生需要量取
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(填“偏大”“偏小”或“无影响”)
a.用量筒量取浓盐酸时俯视观察凹液面:
b.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水:
(4)①假设该同学成功配制了0.400mol/L的盐酸,他又用该盐酸中和含0.4g NaOH的NaOH溶液,则该同学需取
②假设该同学用新配制的盐酸中和含0.4g NaOH的NaOH溶液,发现比①中所求体积偏小,则可能的原因是
A.浓盐酸挥发,浓度不足 B.配制溶液时,未洗涤烧杯
C.配制溶液时,俯视容量瓶刻度线 D.加水时超过刻度线,用胶头滴管吸出
您最近一年使用:0次
名校
解题方法
3 . 价类二维图是以元素化合价为纵坐标,以物质类别为横坐标的二维平面图像。如图为氯元素价类二维图,据此回答下列问题:

Ⅰ.根据化合价和物质类别可以写出有关物质的化学式:
①HCl、② 、③
、③ 、④HClO、⑤NaCl、⑥NaClO。
、④HClO、⑤NaCl、⑥NaClO。
(1)工业上用水吸收HCl气体来生产质量分数为36.5%、密度为1.19g/mL的盐酸,该盐酸的物质的量浓度为___________ 。若用该盐酸配制220mL的 稀盐酸,除玻璃棒、胶头滴管还需用到
稀盐酸,除玻璃棒、胶头滴管还需用到___________ 。
a.10mL量筒 b.20mL量筒 c.100mL容量瓶 d.250mL容量瓶
(2)若出现以下情况,对所配溶液的浓度将有何影响?(填“偏高”“偏低”或“无影响”)
a.加蒸馏水时不慎超过了容量瓶瓶颈上的刻度线:___________ 。
b.定容时俯视容量瓶瓶颈上的刻度线:___________ 。
Ⅱ.二氧化氯( )是一种高效气体消毒剂,易溶于水,沸点为11.0℃,
)是一种高效气体消毒剂,易溶于水,沸点为11.0℃, 气体浓度过高极易爆炸分解,制备过程中要严格控制其浓度。用干燥的氯气与固体亚氯酸钠制备纯净的二氧化氯,反应原理:
气体浓度过高极易爆炸分解,制备过程中要严格控制其浓度。用干燥的氯气与固体亚氯酸钠制备纯净的二氧化氯,反应原理: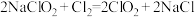 ,反应装置如图所示:
,反应装置如图所示:

(3)A中发生的离子反应方程式为:___________ 。
(4)装置D中通入干燥空气的作用是:___________ 。
(5)写出烧杯中氢氧化钠溶液发生的离子反应方程式___________ 。
(6)除了装置E没有采取防倒吸措施外,该装置仍存在一处明显缺陷,请写出改进措施___________ 。

Ⅰ.根据化合价和物质类别可以写出有关物质的化学式:
①HCl、②
 、③
、③ 、④HClO、⑤NaCl、⑥NaClO。
、④HClO、⑤NaCl、⑥NaClO。(1)工业上用水吸收HCl气体来生产质量分数为36.5%、密度为1.19g/mL的盐酸,该盐酸的物质的量浓度为
 稀盐酸,除玻璃棒、胶头滴管还需用到
稀盐酸,除玻璃棒、胶头滴管还需用到a.10mL量筒 b.20mL量筒 c.100mL容量瓶 d.250mL容量瓶
(2)若出现以下情况,对所配溶液的浓度将有何影响?(填“偏高”“偏低”或“无影响”)
a.加蒸馏水时不慎超过了容量瓶瓶颈上的刻度线:
b.定容时俯视容量瓶瓶颈上的刻度线:
Ⅱ.二氧化氯(
 )是一种高效气体消毒剂,易溶于水,沸点为11.0℃,
)是一种高效气体消毒剂,易溶于水,沸点为11.0℃, 气体浓度过高极易爆炸分解,制备过程中要严格控制其浓度。用干燥的氯气与固体亚氯酸钠制备纯净的二氧化氯,反应原理:
气体浓度过高极易爆炸分解,制备过程中要严格控制其浓度。用干燥的氯气与固体亚氯酸钠制备纯净的二氧化氯,反应原理: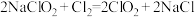 ,反应装置如图所示:
,反应装置如图所示:
(3)A中发生的离子反应方程式为:
(4)装置D中通入干燥空气的作用是:
(5)写出烧杯中氢氧化钠溶液发生的离子反应方程式
(6)除了装置E没有采取防倒吸措施外,该装置仍存在一处明显缺陷,请写出改进措施
您最近一年使用:0次
名校
解题方法
4 . 聚合硫酸铁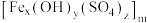 (铁元素化合价为+3)是一种高效的混凝剂,常用于净水,它的组成可以通过以下实验测定:
(铁元素化合价为+3)是一种高效的混凝剂,常用于净水,它的组成可以通过以下实验测定:
①称取一定质量的聚合硫酸铁,配成 溶液。
溶液。
②准确量取①中溶液 于烧杯中,加入足量的盐酸酸化的
于烧杯中,加入足量的盐酸酸化的 溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体
溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体 。
。
③准确量取①中溶液 于烧杯中,加入足量的
于烧杯中,加入足量的 溶液至沉淀完全,过滤、洗涤、干燥、灼烧,得到红棕色固体
溶液至沉淀完全,过滤、洗涤、干燥、灼烧,得到红棕色固体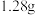 。
。
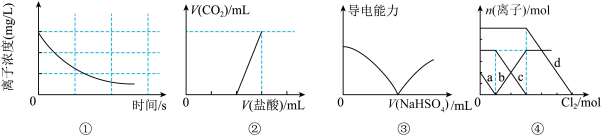
该聚合硫酸铁组成中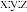 为
为
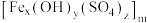 (铁元素化合价为+3)是一种高效的混凝剂,常用于净水,它的组成可以通过以下实验测定:
(铁元素化合价为+3)是一种高效的混凝剂,常用于净水,它的组成可以通过以下实验测定:①称取一定质量的聚合硫酸铁,配成
 溶液。
溶液。②准确量取①中溶液
 于烧杯中,加入足量的盐酸酸化的
于烧杯中,加入足量的盐酸酸化的 溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体
溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体 。
。③准确量取①中溶液
 于烧杯中,加入足量的
于烧杯中,加入足量的 溶液至沉淀完全,过滤、洗涤、干燥、灼烧,得到红棕色固体
溶液至沉淀完全,过滤、洗涤、干燥、灼烧,得到红棕色固体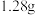 。
。该聚合硫酸铁组成中
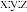 为
为A. | B. | C.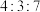 | D. |
您最近一年使用:0次
2023-12-30更新
|
178次组卷
|
3卷引用:河南省新未来2023-2024学年高一上学期12月质量检测化学试题
名校
解题方法
5 . 下列选项描述与对应图像相符的是

A.图①为新制氯水在阳光直射时,溶液中 浓度随着时间变化的曲线 浓度随着时间变化的曲线 |
B.图②为往 与 与 的物质的量之比为 的物质的量之比为 的混合液中滴加盐酸的体积与产生 的混合液中滴加盐酸的体积与产生 体积变化的图像 体积变化的图像 |
C.图③为往 溶液中滴加 溶液中滴加 溶液的体积与导电性变化的图像 溶液的体积与导电性变化的图像 |
D.图④为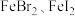 混合液中部分离子的物质的量随氯气通入的变化图像,其中a代表的是 混合液中部分离子的物质的量随氯气通入的变化图像,其中a代表的是 |
您最近一年使用:0次
2023-12-27更新
|
541次组卷
|
3卷引用:河南省许昌高级中学2023-2024学年高一下学期开学化学试题
名校
解题方法
6 . 据题目要求完成下列各题:
(1)写出氯气溶于水的离子反应方程式___________ 。
(2)将4.6g金属钠投入到足量水中,得ag溶液;将4.8g金属镁投入到足量盐酸中,得bg溶液,假设水的质量与盐酸的质量相等,则反应后两溶液的质量关系式为a___________ b(填>、<、=)。
(3) 在碱性溶液中可被NaClO氧化为
在碱性溶液中可被NaClO氧化为 ,而NaClO被还原为NaCl。若反应中
,而NaClO被还原为NaCl。若反应中 与NaClO的物质的量之比为1:13,则x的值为
与NaClO的物质的量之比为1:13,则x的值为___________ 。
(4) 离子在一定条件下可以把
离子在一定条件下可以把 离子氧化,若反应后
离子氧化,若反应后 离子变为
离子变为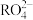 离子,又知反应中氧化剂和还原剂的物质的量之比为5:2,
离子,又知反应中氧化剂和还原剂的物质的量之比为5:2, 离子被氧化后的化合价为
离子被氧化后的化合价为___________ 。
(5)已知爆炸时硝酸铵按下式分解: 。则该反应中被氧化和被还原的N原子数之比为
。则该反应中被氧化和被还原的N原子数之比为___________ 。
(6)高铁酸钠( )是高效的饮用水处理剂,可在碱性溶液环境下由NaClO溶液氧化
)是高效的饮用水处理剂,可在碱性溶液环境下由NaClO溶液氧化 制得。
制得。
①请配平以下化学反应方程式,并用单线桥标出电子转移的方向和数目:________

②每转移3mol电子,生成 的物质的量为
的物质的量为___________ mol。
(1)写出氯气溶于水的离子反应方程式
(2)将4.6g金属钠投入到足量水中,得ag溶液;将4.8g金属镁投入到足量盐酸中,得bg溶液,假设水的质量与盐酸的质量相等,则反应后两溶液的质量关系式为a
(3)
 在碱性溶液中可被NaClO氧化为
在碱性溶液中可被NaClO氧化为 ,而NaClO被还原为NaCl。若反应中
,而NaClO被还原为NaCl。若反应中 与NaClO的物质的量之比为1:13,则x的值为
与NaClO的物质的量之比为1:13,则x的值为(4)
 离子在一定条件下可以把
离子在一定条件下可以把 离子氧化,若反应后
离子氧化,若反应后 离子变为
离子变为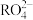 离子,又知反应中氧化剂和还原剂的物质的量之比为5:2,
离子,又知反应中氧化剂和还原剂的物质的量之比为5:2, 离子被氧化后的化合价为
离子被氧化后的化合价为(5)已知爆炸时硝酸铵按下式分解:
 。则该反应中被氧化和被还原的N原子数之比为
。则该反应中被氧化和被还原的N原子数之比为(6)高铁酸钠(
 )是高效的饮用水处理剂,可在碱性溶液环境下由NaClO溶液氧化
)是高效的饮用水处理剂,可在碱性溶液环境下由NaClO溶液氧化 制得。
制得。①请配平以下化学反应方程式,并用单线桥标出电子转移的方向和数目:

②每转移3mol电子,生成
 的物质的量为
的物质的量为
您最近一年使用:0次
2023-11-29更新
|
329次组卷
|
2卷引用:河南省开封市五县联考2023-2024学年高一上学期12月月考化学试题
名校
解题方法
7 . 宏观辨识、微观探析和符号表征是体现化学学科特征的思维方式。某化学兴趣小组设计实验,探究离子反应及氧化还原反应的本质。
Ⅰ.离子反应
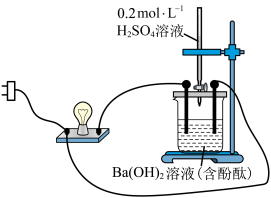
(1)向0.2mol·L-1Ba(OH)2溶液中滴入几滴酚酞溶液,装置如图。接通电源,向该溶液中滴入0.2molL-1H2SO4溶液。
①接通电源前,能说明Ba(OH)2在水中电离的实验现象为_______ 。
②随着H2SO4溶液的滴入,观察到烧杯中溶液红色逐渐褪去,产生白色沉淀,小灯泡亮度变暗,这些现象说明该反应的微观本质是Ba2+和OH-浓度降低,写出该反应的离子方程式_______ 。
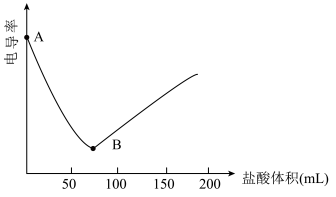
(2)向0.2mol·L-1Ba(OH)2溶液中滴入0.1mol·L-1的盐酸,测定电导率的变化如图所示。
回答下列问题:_______ 。
②下列化学反应的离子方程式与Ba(OH)2溶液和稀盐酸反应相同的是_______ 。
A.Ba(OH)2溶液和稀硫酸 B.澄清石灰水和稀硝酸
C.NaOH溶液和NaHCO3溶液 D.浓氨水和浓盐酸
Ⅱ.氧化还原反应
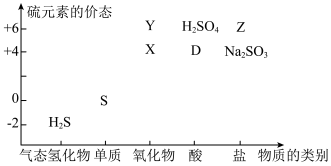
(3)部分含硫物质如图所示,其中H2S和X是大气污染物。这些物质之间的相互转化为工业生产和处理环境问题提供了理论支持。 ,其中反应①的离子方程式是
,其中反应①的离子方程式是______________ ,若欲将X转化成“安全物质”Z,使其对环境的影响最小,需加入_________ (填字母)。
a.氧化剂 b.还原剂 c.酸性物质 d.碱性物质
X转化为Z可以说明氧化还原的实质是_________ ,检验Z中阴离子的实验操作方法是_________ 。
Ⅰ.离子反应
(1)向0.2mol·L-1Ba(OH)2溶液中滴入几滴酚酞溶液,装置如图。接通电源,向该溶液中滴入0.2molL-1H2SO4溶液。
①接通电源前,能说明Ba(OH)2在水中电离的实验现象为
②随着H2SO4溶液的滴入,观察到烧杯中溶液红色逐渐褪去,产生白色沉淀,小灯泡亮度变暗,这些现象说明该反应的微观本质是Ba2+和OH-浓度降低,写出该反应的离子方程式
(2)向0.2mol·L-1Ba(OH)2溶液中滴入0.1mol·L-1的盐酸,测定电导率的变化如图所示。
回答下列问题:
②下列化学反应的离子方程式与Ba(OH)2溶液和稀盐酸反应相同的是
A.Ba(OH)2溶液和稀硫酸 B.澄清石灰水和稀硝酸
C.NaOH溶液和NaHCO3溶液 D.浓氨水和浓盐酸
Ⅱ.氧化还原反应
(3)部分含硫物质如图所示,其中H2S和X是大气污染物。这些物质之间的相互转化为工业生产和处理环境问题提供了理论支持。
 ,其中反应①的离子方程式是
,其中反应①的离子方程式是a.氧化剂 b.还原剂 c.酸性物质 d.碱性物质
X转化为Z可以说明氧化还原的实质是
您最近一年使用:0次
2023-04-23更新
|
172次组卷
|
3卷引用:河南省南阳市2022-2023学年高一上学期1月期末考试化学试题
河南省南阳市2022-2023学年高一上学期1月期末考试化学试题河南省南阳市唐河县第一高级中学2023-2024学年高一上学期12月月考化学试题(已下线)专项02 离子反应和氧化还原反应的应用-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(人教版2019必修第一册)
名校
解题方法
8 . 铁及其化合物与生产、生活息息相关。回答下列问题:
(1) 易被人体吸收,医生建议在服用该补铁剂时,同时服用维生素C.维生素C的作用是
易被人体吸收,医生建议在服用该补铁剂时,同时服用维生素C.维生素C的作用是_______ 。
(2)印刷电路板的制作原理是用足量的 溶液腐蚀覆铜板上不需要的铜箔。写出上述反应的化学方程式:
溶液腐蚀覆铜板上不需要的铜箔。写出上述反应的化学方程式:_______ 。
(3)生铁是通过高炉冶炼而得到的,以赤铁矿为例用 将其还原的化学方程式为
将其还原的化学方程式为_______ 。
(4)某废料铁泥的主要成分为 、
、 、
、 和杂质(杂质不与硫酸反应)。现取
和杂质(杂质不与硫酸反应)。现取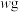 废料铁泥提取
废料铁泥提取 ,设计实验流程如下:
,设计实验流程如下:

①分离溶液A和沉淀C的操作中使用到的玻璃仪器有烧杯、_______ 、_______ 。
②能检验溶液A中含有 的试剂是
的试剂是_______ (填字母)。
A.铁粉 B.酸性 溶液 C.KSCN溶液
溶液 C.KSCN溶液
③步骤Ⅱ中发生反应的离子方程式为_______ 。
④若最终获得 ,则废料铁泥中铁元素的质量分数为
,则废料铁泥中铁元素的质量分数为_______ 。
(1)
 易被人体吸收,医生建议在服用该补铁剂时,同时服用维生素C.维生素C的作用是
易被人体吸收,医生建议在服用该补铁剂时,同时服用维生素C.维生素C的作用是(2)印刷电路板的制作原理是用足量的
 溶液腐蚀覆铜板上不需要的铜箔。写出上述反应的化学方程式:
溶液腐蚀覆铜板上不需要的铜箔。写出上述反应的化学方程式:(3)生铁是通过高炉冶炼而得到的,以赤铁矿为例用
 将其还原的化学方程式为
将其还原的化学方程式为(4)某废料铁泥的主要成分为
 、
、 、
、 和杂质(杂质不与硫酸反应)。现取
和杂质(杂质不与硫酸反应)。现取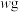 废料铁泥提取
废料铁泥提取 ,设计实验流程如下:
,设计实验流程如下:
①分离溶液A和沉淀C的操作中使用到的玻璃仪器有烧杯、
②能检验溶液A中含有
 的试剂是
的试剂是A.铁粉 B.酸性
 溶液 C.KSCN溶液
溶液 C.KSCN溶液③步骤Ⅱ中发生反应的离子方程式为
④若最终获得
 ,则废料铁泥中铁元素的质量分数为
,则废料铁泥中铁元素的质量分数为
您最近一年使用:0次
2023-01-20更新
|
519次组卷
|
7卷引用:河南省叶县高级中学2022-2023学年高一上学期1月期末考试化学试题
名校
解题方法
9 . 用如图所示装置制取氯酸钾并进行氯气性质探究实验。
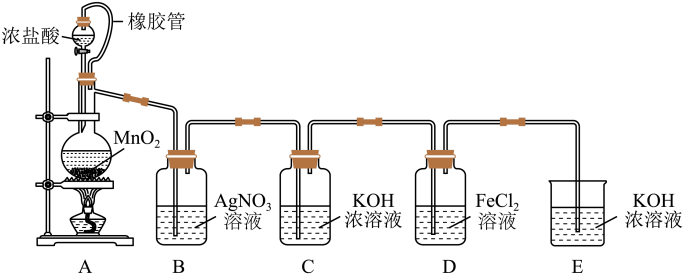
请回答下列问题:
(1)装置A中制取Cl2的化学反应方程式为___________ 。
(2)装置B中溶液出现浑浊,能否说明Cl2与AgNO3溶液发生反应?___________ (填“能”或“不能”)。请说明理由:___________ 。
(3)装置C中制取氯酸钾的化学方程式为: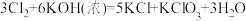 ,该反应中氧化剂为
,该反应中氧化剂为___________ ,氧化剂与还原剂个数比为___________ 。标准状况下若有67.2LCl2参与反应,则转移电子为___________ mol。
(4)装置D中导管接错,若导致FeCl2溶液进入装置E(不考虑Cl2氧化FeCl2的情况),则E中出现的现象为___________ ,涉及到的化学方程式为___________ 、___________ 。

请回答下列问题:
(1)装置A中制取Cl2的化学反应方程式为
(2)装置B中溶液出现浑浊,能否说明Cl2与AgNO3溶液发生反应?
(3)装置C中制取氯酸钾的化学方程式为:
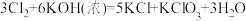 ,该反应中氧化剂为
,该反应中氧化剂为(4)装置D中导管接错,若导致FeCl2溶液进入装置E(不考虑Cl2氧化FeCl2的情况),则E中出现的现象为
您最近一年使用:0次
名校
10 . 回答下列问题:
(1)Mg在CO2中燃烧的反应可用于火星电站发电、人员取暖等,反应的化学方程式为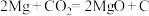 。
。
①做氧化剂的物质是___________ ,碳元素的化合价___________ (填“升高”或“降低”)。
②反应中每生成1molMgO,消耗Mg的物质的量是___________ mol,转移电子的物质的量是___________ mol。
(2)Al(OH)3可用作中和胃酸的药片,其中Al(OH)3中和胃酸(盐酸)的原理为___________ (用离子反应方程式表示)。
(3)写出漂粉精中的有效成分与空气中的CO2和水蒸气发生反应的化学方程式___________ 。
(4)以软锰矿(主要成分为MnO2)为原料生产高锰酸钾的工艺路线如下:
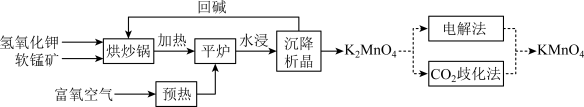
写出“平炉”中反应的化学方程式___________ 。
(5)考古学上常用于测定文物年代的核素的符号是___________ 。
(1)Mg在CO2中燃烧的反应可用于火星电站发电、人员取暖等,反应的化学方程式为
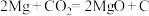 。
。①做氧化剂的物质是
②反应中每生成1molMgO,消耗Mg的物质的量是
(2)Al(OH)3可用作中和胃酸的药片,其中Al(OH)3中和胃酸(盐酸)的原理为
(3)写出漂粉精中的有效成分与空气中的CO2和水蒸气发生反应的化学方程式
(4)以软锰矿(主要成分为MnO2)为原料生产高锰酸钾的工艺路线如下:

写出“平炉”中反应的化学方程式
(5)考古学上常用于测定文物年代的核素的符号是
您最近一年使用:0次



