名校
1 . 已知:①F、 、
、 、I是同主族元素,且单质的氧化性
、I是同主族元素,且单质的氧化性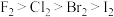 。②溴水浓度较低时呈黄色,浓度较高时呈红棕色;碘水呈棕黄色。用下图所示装置进行实验,验证卤素单质的氧化性
。②溴水浓度较低时呈黄色,浓度较高时呈红棕色;碘水呈棕黄色。用下图所示装置进行实验,验证卤素单质的氧化性 (夹持仪器已略去,气密性已检验)。
(夹持仪器已略去,气密性已检验)。

实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸;
Ⅱ.当N和P中的溶液都变为黄色时,夹紧弹簧夹;
Ⅲ.当N中溶液由黄色变为红棕色时,关闭活塞a;
Ⅳ.打开活塞b向Q中滴加P中溶液,溶液变为棕黄色,比P中溶液颜色深。
下列说法错误的是
 、
、 、I是同主族元素,且单质的氧化性
、I是同主族元素,且单质的氧化性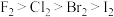 。②溴水浓度较低时呈黄色,浓度较高时呈红棕色;碘水呈棕黄色。用下图所示装置进行实验,验证卤素单质的氧化性
。②溴水浓度较低时呈黄色,浓度较高时呈红棕色;碘水呈棕黄色。用下图所示装置进行实验,验证卤素单质的氧化性 (夹持仪器已略去,气密性已检验)。
(夹持仪器已略去,气密性已检验)。
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸;
Ⅱ.当N和P中的溶液都变为黄色时,夹紧弹簧夹;
Ⅲ.当N中溶液由黄色变为红棕色时,关闭活塞a;
Ⅳ.打开活塞b向Q中滴加P中溶液,溶液变为棕黄色,比P中溶液颜色深。
下列说法错误的是
A.实验开始时,M中湿润的淀粉 试纸变蓝 试纸变蓝 |
B.N中两次颜色变化的反应均为 |
C.若省略Ⅱ、Ⅲ,则不能说明氧化性 |
D.挥发的 气体会干扰本实验的结果和结论的得出,应改进装置 气体会干扰本实验的结果和结论的得出,应改进装置 |
您最近一年使用:0次
名校
2 . 为进一步研究过氧化钠与水的反应,某活动小组进行了如下探究。
(1)把一定量水滴入盛有少量过氧化钠固体的试管中,反应的化学方程式为___________ 。
(2)向反应后的溶液中滴入酚酞,一段时间后,发现溶液颜色逐渐变浅,最后颜色消失。为探究原因,进行实验1(环境温度为30℃)结果如下:
结合表中数据,判断下列说法正确的是___________ 。(填字母)
a.其他条件相同时,NaOH溶液浓度越大褪色越快
b.溶液褪色可能是NaOH溶液浓度过大导致的
c.当NaOH溶液浓度大于或等于1.0mol/L时,对溶液颜色变化有明显影响
(3)为进一步探究溶液的褪色原因,活动小组接着做了以下实验:
Ⅰ.取1.56gNa2O2粉末加入到40mL水中,充分反应得溶液A(溶液体积几乎无变化),则所得NaOH溶液的物质的量浓度为___________ 。实验过程中,需待Na2O2固体完全溶解后再加入酚酞,原因是___________ 。
Ⅱ.实验2操作和现象如下:
下列说法不正确 的是___________ 。
A.由②中现象i可知,Na2O2与水反应有H2O2生成
B.由③、④可知,②中溶液红色褪去是因为c(OH-)大
C.由②、③、④可知,①中溶液红色褪去的主要原因不是c(OH-)大
D.向①中褪色后的溶液中滴加5滴6mol/L盐酸,溶液最终变成红色
综上所述,Na2O2与水反应过程复杂,滴入酚酞时溶液颜色变化受多因素影响。
(1)把一定量水滴入盛有少量过氧化钠固体的试管中,反应的化学方程式为
(2)向反应后的溶液中滴入酚酞,一段时间后,发现溶液颜色逐渐变浅,最后颜色消失。为探究原因,进行实验1(环境温度为30℃)结果如下:
| NaOH溶液浓度(mol/L) | 10.0 | 2.0 | 1.0 | 0.10 | 0.01 |
| 滴入酚酞时现象 | 深紫红色 | 深红色 | 深红色 | 深红色 | 深红色 |
| 溶液变为浅红色时间 | 2~3s | 26~30s | 54~60s | 6~7min | 45min内稳定不变 |
| 溶液完全褪色时间 | 7~8s | 50~54s 几乎无色 | 100~110s 几乎无色 | 20min后仍为浅红色 | 2h后略变浅 |
| 最终溶液是否褪色 | 褪色 | 褪色 | 褪色 | 不褪色 | 不褪色 |
a.其他条件相同时,NaOH溶液浓度越大褪色越快
b.溶液褪色可能是NaOH溶液浓度过大导致的
c.当NaOH溶液浓度大于或等于1.0mol/L时,对溶液颜色变化有明显影响
(3)为进一步探究溶液的褪色原因,活动小组接着做了以下实验:
Ⅰ.取1.56gNa2O2粉末加入到40mL水中,充分反应得溶液A(溶液体积几乎无变化),则所得NaOH溶液的物质的量浓度为
Ⅱ.实验2操作和现象如下:
| 编号 | ① | ② | ③ | ④ |
| 操作 | 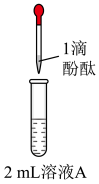 | 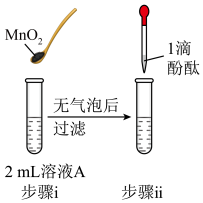 | 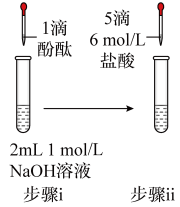 | 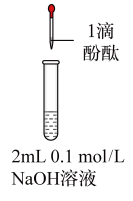 |
| 现象 | 溶液变红色,20s后褪色。 | i.产生大量能使带火星木条复燃的气体; ii.溶液变红色,10min后褪色。 | i.溶液变红色,10min后溶液褪色; ii.变红色。 | 溶液变红色,2h后无明显变化。 |
A.由②中现象i可知,Na2O2与水反应有H2O2生成
B.由③、④可知,②中溶液红色褪去是因为c(OH-)大
C.由②、③、④可知,①中溶液红色褪去的主要原因不是c(OH-)大
D.向①中褪色后的溶液中滴加5滴6mol/L盐酸,溶液最终变成红色
综上所述,Na2O2与水反应过程复杂,滴入酚酞时溶液颜色变化受多因素影响。
您最近一年使用:0次
名校
3 . 我国化学家侯德榜发明了联合制碱法,对世界制碱工业做出了巨大贡献。联合制碱法的主要流程如下(部分物质已略去):
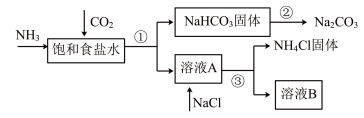
(1)①~③所涉及的操作方法中,包含过滤的是___________ (填序号)。
(2)根据上述流程图,将化学方程式补充完整:________
NH3+CO2+___________+___________=NaHCO3↓+NH4Cl
(3)煅烧NaHCO3固体的化学方程式是___________ 。
(4)下列联合制碱法流程说法正确的是___________ (填字母)。
a.CO2可以循环使用
b.副产物NH4Cl可用作肥料
c.溶液B中一定含有Na+、NH 、Cl-
、Cl-
d.①中NaHCO3析出是因为一定条件下NaHCO3的溶解度最小
(5)某纯碱样品中含杂质NaCl,取质量为ag的样品,加入足量的稀盐酸,充分反应后,加热、蒸干、灼烧,得到bg固体物质,则此样品中Na2CO3的质量分数为___________ 。(列出表达式即可)

(1)①~③所涉及的操作方法中,包含过滤的是
(2)根据上述流程图,将化学方程式补充完整:
NH3+CO2+___________+___________=NaHCO3↓+NH4Cl
(3)煅烧NaHCO3固体的化学方程式是
(4)下列联合制碱法流程说法正确的是
a.CO2可以循环使用
b.副产物NH4Cl可用作肥料
c.溶液B中一定含有Na+、NH
 、Cl-
、Cl-d.①中NaHCO3析出是因为一定条件下NaHCO3的溶解度最小
(5)某纯碱样品中含杂质NaCl,取质量为ag的样品,加入足量的稀盐酸,充分反应后,加热、蒸干、灼烧,得到bg固体物质,则此样品中Na2CO3的质量分数为
您最近一年使用:0次
名校
4 . 某小组同学在实验室制备、收集氯气,并进行氯水中相关物质的性质探究,回答下列问题。

(1)制备Cl2。装置Ⅰ中反应的离子 方程式是___________ 。
(2)除去Cl2中混有的HCl。装置Ⅱ中溶液a为饱和___________ 溶液。
(3)收集Cl2。装置Ⅲ中气体应该从集气瓶的___________ (选“m”或“n”)口进入。
(4)蘸有NaOH溶液的棉花上发生反应的离子 方程式是___________ 。
(5)氯水中相关物质的性质探究。
①若装置Ⅳ中试剂b为H2O,制得氯水。氯水呈黄绿色是由于其中含有___________ ;Cl2与H2O反应的化学方程式为___________ 。
②若装置Ⅳ中试剂b为CCl4,可制得Cl2的CCl4溶液(Cl2可溶于CCl4,且不与CCl4反应)。取稀盐酸、新制氯水、Cl2的CCl4溶液,分别滴在三张红色纸条上,可观察到___________ 现象,证明氯水中HClO具有漂白性作用。
③验证氯水中HClO光照分解的产物。将装置Ⅳ广口瓶中的氯水转移至三颈瓶内,将pH传感器、氯离子传感器、氧气传感器分别插入三颈瓶中(如图),用强光照射氯水,进行实验并采集数据,获得相关变化曲线。


若能够证明氯水中HClO在光照下发生了分解反应,则图中纵坐标可以表示的物理量是___________ (填字母)。(注:酸性溶液中,c(H+)越大,pH越小,溶液酸性越强。)
a.氯水的pH b.氢离子的浓度 c.氯离子的浓度 d.氧气的体积分数

(1)制备Cl2。装置Ⅰ中反应的
(2)除去Cl2中混有的HCl。装置Ⅱ中溶液a为饱和
(3)收集Cl2。装置Ⅲ中气体应该从集气瓶的
(4)蘸有NaOH溶液的棉花上发生反应的
(5)氯水中相关物质的性质探究。
①若装置Ⅳ中试剂b为H2O,制得氯水。氯水呈黄绿色是由于其中含有
②若装置Ⅳ中试剂b为CCl4,可制得Cl2的CCl4溶液(Cl2可溶于CCl4,且不与CCl4反应)。取稀盐酸、新制氯水、Cl2的CCl4溶液,分别滴在三张红色纸条上,可观察到
③验证氯水中HClO光照分解的产物。将装置Ⅳ广口瓶中的氯水转移至三颈瓶内,将pH传感器、氯离子传感器、氧气传感器分别插入三颈瓶中(如图),用强光照射氯水,进行实验并采集数据,获得相关变化曲线。


若能够证明氯水中HClO在光照下发生了分解反应,则图中纵坐标可以表示的物理量是
a.氯水的pH b.氢离子的浓度 c.氯离子的浓度 d.氧气的体积分数
您最近一年使用:0次
5 . 下列电离方程式书写不正确 的是
A.HNO3=H++ | B.Ba(OH)2=Ba2++2OH- |
C.NaHCO3=Na++H++ | D.NH4NO3= + + |
您最近一年使用:0次
2024-01-02更新
|
104次组卷
|
3卷引用:北京市第三中学2023-2024学年高一上学期期中考试化学试题
名校
解题方法
6 . 某小组同学欧探究 的性质,经历如下探究过程:
的性质,经历如下探究过程:
预测: 中的O作为核心元素,化合价为-1价,因此预测
中的O作为核心元素,化合价为-1价,因此预测 既具有氧化性,也具有还原性。
既具有氧化性,也具有还原性。
(1)预测其具有氧化性的依据是___________ 。
实验和观察:小组同学分别选用酸性溶液、酸化的KI溶液与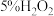 溶液反应以验证预测。
溶液反应以验证预测。
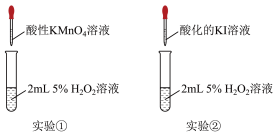
(2)实验①利用了酸性高锰酸钾的___________ 性质,该实验中,证明 溶液与
溶液与 反应的现象除了溶液颜色变浅或褪色外,还有
反应的现象除了溶液颜色变浅或褪色外,还有___________ 。
(3)实验②是为了验证 的氧化性,在反应后的溶液中加入淀粉溶液,可观察到溶液变蓝,写出该反应的离子方程式
的氧化性,在反应后的溶液中加入淀粉溶液,可观察到溶液变蓝,写出该反应的离子方程式___________ 。
(4)以上实验可得出的结论是___________ 。
(5)过氧化氢 俗称双氧水,根据下列A~D涉及
俗称双氧水,根据下列A~D涉及 的反应,填空。
的反应,填空。
A.
B.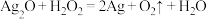
C.
D.
① 仅体现氧化性的反应是
仅体现氧化性的反应是___________ (填字母,下同)。
② 既体现氧化性又体现还原性的反应是
既体现氧化性又体现还原性的反应是___________ 。
 的性质,经历如下探究过程:
的性质,经历如下探究过程:预测:
 中的O作为核心元素,化合价为-1价,因此预测
中的O作为核心元素,化合价为-1价,因此预测 既具有氧化性,也具有还原性。
既具有氧化性,也具有还原性。(1)预测其具有氧化性的依据是
实验和观察:小组同学分别选用酸性溶液、酸化的KI溶液与
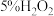 溶液反应以验证预测。
溶液反应以验证预测。
(2)实验①利用了酸性高锰酸钾的
 溶液与
溶液与 反应的现象除了溶液颜色变浅或褪色外,还有
反应的现象除了溶液颜色变浅或褪色外,还有(3)实验②是为了验证
 的氧化性,在反应后的溶液中加入淀粉溶液,可观察到溶液变蓝,写出该反应的离子方程式
的氧化性,在反应后的溶液中加入淀粉溶液,可观察到溶液变蓝,写出该反应的离子方程式(4)以上实验可得出的结论是
(5)过氧化氢
 俗称双氧水,根据下列A~D涉及
俗称双氧水,根据下列A~D涉及 的反应,填空。
的反应,填空。A.

B.
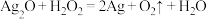
C.

D.

①
 仅体现氧化性的反应是
仅体现氧化性的反应是②
 既体现氧化性又体现还原性的反应是
既体现氧化性又体现还原性的反应是
您最近一年使用:0次
名校
解题方法
7 . 为检验某加碘食盐中是否含有 ,取相同食盐样品进行下表所示实验:
,取相同食盐样品进行下表所示实验:
已知:
下列说法中正确的是
 ,取相同食盐样品进行下表所示实验:
,取相同食盐样品进行下表所示实验:已知:

| 实验① | 实验② | 实验③ |
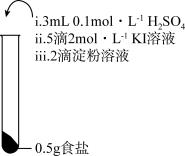 | 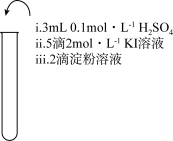 | 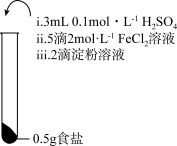 |
| 振荡,溶液迅速变为蓝色 | 振荡,一段时间后溶液变为浅蓝色 | 振荡,溶液变为浅黄色 |
A.仅由实验①就能证明食盐样品中存在 |
B.以上实验说明离子的还原性: |
C.实验③能证明食盐样品中不存在 |
D.实验②中发生反应的离子方程式为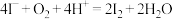 |
您最近一年使用:0次
2023-11-04更新
|
299次组卷
|
2卷引用:北京交通大学附属中学2023-2024学年高一上学期期中考试化学试题
名校
解题方法
8 . Br nsted-Lowry认为,凡是能给出质子(质子即
nsted-Lowry认为,凡是能给出质子(质子即 )的分子或离子都是质子的给体,称为酸;凡是能与质子结合的分子或离子都是质子的受体,称为碱,即:酸
)的分子或离子都是质子的给体,称为酸;凡是能与质子结合的分子或离子都是质子的受体,称为碱,即:酸 碱,其中左边的酸是右边碱的共轭酸,而右边的碱则是左边酸的共轭碱,彼此联系在一起叫做共轭酸碱对。共轭酸的酸性越强,其共轭碱就越弱。相同条件下,已知碱性由强到弱:
碱,其中左边的酸是右边碱的共轭酸,而右边的碱则是左边酸的共轭碱,彼此联系在一起叫做共轭酸碱对。共轭酸的酸性越强,其共轭碱就越弱。相同条件下,已知碱性由强到弱: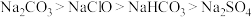 ,以下说法
,以下说法不正 确的是
 nsted-Lowry认为,凡是能给出质子(质子即
nsted-Lowry认为,凡是能给出质子(质子即 )的分子或离子都是质子的给体,称为酸;凡是能与质子结合的分子或离子都是质子的受体,称为碱,即:酸
)的分子或离子都是质子的给体,称为酸;凡是能与质子结合的分子或离子都是质子的受体,称为碱,即:酸 碱,其中左边的酸是右边碱的共轭酸,而右边的碱则是左边酸的共轭碱,彼此联系在一起叫做共轭酸碱对。共轭酸的酸性越强,其共轭碱就越弱。相同条件下,已知碱性由强到弱:
碱,其中左边的酸是右边碱的共轭酸,而右边的碱则是左边酸的共轭碱,彼此联系在一起叫做共轭酸碱对。共轭酸的酸性越强,其共轭碱就越弱。相同条件下,已知碱性由强到弱: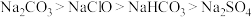 ,以下说法
,以下说法A.根据该理论, 既属于酸,也属于碱 既属于酸,也属于碱 |
B.物质酸性由强到弱: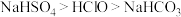 |
C.物质酸性由强到弱: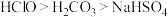 |
D.向 中通入少量 中通入少量 : :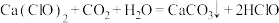 |
您最近一年使用:0次
名校
9 . A、D、E、W是中学常见的四种元素,原子序数依次增大,A的原子最外层电子数是次外层的2倍,D的氧化物属于两性氧化物,D、E位于同周期,A、D、E的原子最外层电子数之和为14,W是人体必需的微量元素,缺乏W会导致贫血症状。
(1)A在元素周期表中的位置是_______ 。
(2)下列事实能用元素周期律解释的是_______ (填字母序号)。
a.D的最高价氧化物对应水化物的碱性弱于
b.E的气态氢化物的稳定性小于HF
c. 的溶液可用于刻蚀铜制的印刷电路板
的溶液可用于刻蚀铜制的印刷电路板
(3)A和D按照原子个数比3∶4构成的固体化合物,易与水反应生成可燃性气体和白色沉淀。在相同条件下,此气体密度是 密度的8倍。化合物与水反应的化学方程式为
密度的8倍。化合物与水反应的化学方程式为_______ 。
(4)W的单质可用于处理酸性废水中的 ,使其转换为
,使其转换为 ,同时生成有磁性的W的氧化物X,再进行后续处理。
,同时生成有磁性的W的氧化物X,再进行后续处理。
①上述反应的离子方程式为_______ 。
②D的单质与X在高温下反应的化学方程式为_______ 。
(1)A在元素周期表中的位置是
(2)下列事实能用元素周期律解释的是
a.D的最高价氧化物对应水化物的碱性弱于

b.E的气态氢化物的稳定性小于HF
c.
 的溶液可用于刻蚀铜制的印刷电路板
的溶液可用于刻蚀铜制的印刷电路板(3)A和D按照原子个数比3∶4构成的固体化合物,易与水反应生成可燃性气体和白色沉淀。在相同条件下,此气体密度是
 密度的8倍。化合物与水反应的化学方程式为
密度的8倍。化合物与水反应的化学方程式为(4)W的单质可用于处理酸性废水中的
 ,使其转换为
,使其转换为 ,同时生成有磁性的W的氧化物X,再进行后续处理。
,同时生成有磁性的W的氧化物X,再进行后续处理。①上述反应的离子方程式为
②D的单质与X在高温下反应的化学方程式为
您最近一年使用:0次
名校
解题方法
10 . 某小组探究S单质与 溶液加热后得到的产物。向5
溶液加热后得到的产物。向5
 溶液中加入少量硫粉,加热至固体全部溶解,冷却后,得到淡黄色溶液A(
溶液中加入少量硫粉,加热至固体全部溶解,冷却后,得到淡黄色溶液A( )。
)。
【资料】1. 溶液无色,
溶液无色, 能与
能与 反应生成
反应生成 (臭鸡蛋气味气体),能与
(臭鸡蛋气味气体),能与 反应生成
反应生成 (黑色固体)。
(黑色固体)。
2. 溶液呈黄色,
溶液呈黄色, 能与
能与 反应生成S和
反应生成S和 ,能与
,能与 反应生成S和
反应生成S和 。
。
3. 和
和 均不能使品红褪色,
均不能使品红褪色, 或高浓度
或高浓度 能使品红褪色。
能使品红褪色。
(1)如图所示,进行实验I和Ⅱ,证实了产物中含 。
。

①补全实验Ⅱ的方案_______ (在横线上填写试剂)。
②证实产物中含 的现象是
的现象是_______ 。
(2)依据产物中含 ,甲同学认为产物还应该有
,甲同学认为产物还应该有 ,请依据氧化还原反应的规律进行解释:
,请依据氧化还原反应的规律进行解释:_______ 。
(3)甲同学推测溶液A中可能还含有 ,因为
,因为 在加热过程中可能与空气中氧气反应。
在加热过程中可能与空气中氧气反应。
针对此观点继续实验Ⅲ:取溶液A于试管中,加入足量稀盐酸,立即出现淡黄色浑浊,同时产生臭鸡蛋气味的气体,离心沉淀(固液分离),得到无色溶液B和淡黄色固体。取无色溶液B,_______ (填操作和现象),证实溶液A中存在 。
。
(4)甲同学根据溶液A呈淡黄色猜想其中还存在 ,并认为实验Ⅲ中的现象可做为证据。但乙同学认为实验Ⅲ中的现象不能说明,理由是
,并认为实验Ⅲ中的现象可做为证据。但乙同学认为实验Ⅲ中的现象不能说明,理由是_______ 。
(5)继续进行实验Ⅳ,验证了溶液A中存在 。
。
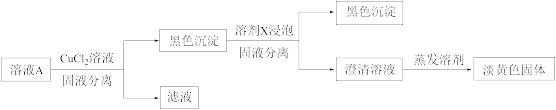
①溶剂X是_______ (填化学式)。
②证明溶液中含 的实验证据是
的实验证据是_______ 。
进一步实验,得到结论:硫单质在碱性条件下歧化反应的产物主要为 和
和 ,溶液中还会生成少量的
,溶液中还会生成少量的 、
、 和
和 。
。
 溶液加热后得到的产物。向5
溶液加热后得到的产物。向5
 溶液中加入少量硫粉,加热至固体全部溶解,冷却后,得到淡黄色溶液A(
溶液中加入少量硫粉,加热至固体全部溶解,冷却后,得到淡黄色溶液A( )。
)。【资料】1.
 溶液无色,
溶液无色, 能与
能与 反应生成
反应生成 (臭鸡蛋气味气体),能与
(臭鸡蛋气味气体),能与 反应生成
反应生成 (黑色固体)。
(黑色固体)。2.
 溶液呈黄色,
溶液呈黄色, 能与
能与 反应生成S和
反应生成S和 ,能与
,能与 反应生成S和
反应生成S和 。
。3.
 和
和 均不能使品红褪色,
均不能使品红褪色, 或高浓度
或高浓度 能使品红褪色。
能使品红褪色。(1)如图所示,进行实验I和Ⅱ,证实了产物中含
 。
。
①补全实验Ⅱ的方案
②证实产物中含
 的现象是
的现象是(2)依据产物中含
 ,甲同学认为产物还应该有
,甲同学认为产物还应该有 ,请依据氧化还原反应的规律进行解释:
,请依据氧化还原反应的规律进行解释:(3)甲同学推测溶液A中可能还含有
 ,因为
,因为 在加热过程中可能与空气中氧气反应。
在加热过程中可能与空气中氧气反应。针对此观点继续实验Ⅲ:取溶液A于试管中,加入足量稀盐酸,立即出现淡黄色浑浊,同时产生臭鸡蛋气味的气体,离心沉淀(固液分离),得到无色溶液B和淡黄色固体。取无色溶液B,
 。
。(4)甲同学根据溶液A呈淡黄色猜想其中还存在
 ,并认为实验Ⅲ中的现象可做为证据。但乙同学认为实验Ⅲ中的现象不能说明,理由是
,并认为实验Ⅲ中的现象可做为证据。但乙同学认为实验Ⅲ中的现象不能说明,理由是(5)继续进行实验Ⅳ,验证了溶液A中存在
 。
。
①溶剂X是
②证明溶液中含
 的实验证据是
的实验证据是进一步实验,得到结论:硫单质在碱性条件下歧化反应的产物主要为
 和
和 ,溶液中还会生成少量的
,溶液中还会生成少量的 、
、 和
和 。
。
您最近一年使用:0次
2023-01-06更新
|
673次组卷
|
3卷引用:北京市北京师范大学附属实验中学2022-2023学年高一上学期期末考试化学试题



