名校
解题方法
1 . 某小组为探究 (三草酸合铁酸钾晶体)的热分解产物,按如图所示装置进行实验(部分夹持装置省略)。
(三草酸合铁酸钾晶体)的热分解产物,按如图所示装置进行实验(部分夹持装置省略)。

(1)在实验进行的过程中,应该持续通入氮气的目的是___________ 。
(2)若实验中观察装置F中澄清石灰水变浑浊,装置E中固体变为红色,则说明 的热分解产物中一定含有
的热分解产物中一定含有___________ 。
(3)该样品完全热分解后,欲检测固体生成物中的组成,某同学待装置冷却后取少量固体加入稀硫酸溶解,再加入 溶液变红,说明
溶液变红,说明___________ 。
(4)已知: 是一种光敏化合物,见光分解。该实验小组在探究
是一种光敏化合物,见光分解。该实验小组在探究 热分解后,用该装置再次探究它光解的产物,现取
热分解后,用该装置再次探究它光解的产物,现取 固体20.00g,使充分反应后,称得B、C装置共增重1.76g,D装置增重2.16g,E、F装置均无明显现象。
固体20.00g,使充分反应后,称得B、C装置共增重1.76g,D装置增重2.16g,E、F装置均无明显现象。
完成下列小题:
①若反应后 元素的化合价降为
元素的化合价降为 价,K元素的化合价未改变,且两者仍为草酸
价,K元素的化合价未改变,且两者仍为草酸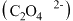 盐,写出三草酸合铁酸钾完全光解的化学方程式
盐,写出三草酸合铁酸钾完全光解的化学方程式___________ 。
②据此计算出该 固体的纯度为
固体的纯度为___________ (保留一位有效数字) 。
③样品完全分解后,实验小组停止通氮气,一段时间后,某同学取少许装置A中的残留物于试管中,加入稀硫酸溶解,滴入1~2滴 溶液,发现溶液变红,这与上述
溶液,发现溶液变红,这与上述 分解产物为
分解产物为 价
价 的结论不符可能的原因是
的结论不符可能的原因是___________ 。
 (三草酸合铁酸钾晶体)的热分解产物,按如图所示装置进行实验(部分夹持装置省略)。
(三草酸合铁酸钾晶体)的热分解产物,按如图所示装置进行实验(部分夹持装置省略)。
(1)在实验进行的过程中,应该持续通入氮气的目的是
(2)若实验中观察装置F中澄清石灰水变浑浊,装置E中固体变为红色,则说明
 的热分解产物中一定含有
的热分解产物中一定含有(3)该样品完全热分解后,欲检测固体生成物中的组成,某同学待装置冷却后取少量固体加入稀硫酸溶解,再加入
 溶液变红,说明
溶液变红,说明(4)已知:
 是一种光敏化合物,见光分解。该实验小组在探究
是一种光敏化合物,见光分解。该实验小组在探究 热分解后,用该装置再次探究它光解的产物,现取
热分解后,用该装置再次探究它光解的产物,现取 固体20.00g,使充分反应后,称得B、C装置共增重1.76g,D装置增重2.16g,E、F装置均无明显现象。
固体20.00g,使充分反应后,称得B、C装置共增重1.76g,D装置增重2.16g,E、F装置均无明显现象。完成下列小题:
①若反应后
 元素的化合价降为
元素的化合价降为 价,K元素的化合价未改变,且两者仍为草酸
价,K元素的化合价未改变,且两者仍为草酸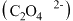 盐,写出三草酸合铁酸钾完全光解的化学方程式
盐,写出三草酸合铁酸钾完全光解的化学方程式②据此计算出该
 固体的纯度为
固体的纯度为③样品完全分解后,实验小组停止通氮气,一段时间后,某同学取少许装置A中的残留物于试管中,加入稀硫酸溶解,滴入1~2滴
 溶液,发现溶液变红,这与上述
溶液,发现溶液变红,这与上述 分解产物为
分解产物为 价
价 的结论不符可能的原因是
的结论不符可能的原因是
您最近一年使用:0次
名校
解题方法
2 . 金属铋在工业上常用于制造低熔点合金,用于消防装置、自动喷水器、锅炉等的安全塞,一旦发生火灾,·些水管的活塞会“自动”熔化,喷出水来。由一种铋矿[主要成分为 (不溶于水),含强氧化性杂质
(不溶于水),含强氧化性杂质 等]制备金属铋的简单工艺如图:
等]制备金属铋的简单工艺如图:
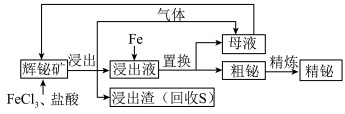
已知:酸性条件下的氧化性: 。
。
(1)“浸出”过程中,溶液中放出的气体是_________ ;放出该气体的离子方程式是________ 。
(2)加入 溶液的目的是
溶液的目的是___________ ,该反应的离子方程式是___________ 。
(3)检验母液中所含有的主要金属阳离子的方法是___________ 。
(4)铋的+5价盐类( 盐)具有强氧化性。欲探究
盐)具有强氧化性。欲探究 盐类的氧化性强弱,某实验小组进行了以下实验,取一定量的
盐类的氧化性强弱,某实验小组进行了以下实验,取一定量的 溶液,向其中依次加入下列试剂,对应的现象如下表所示:
溶液,向其中依次加入下列试剂,对应的现象如下表所示:
据图回答下面的问题:
①上述试剂的氧化性强弱顺序为:___________ 。
②写出 和
和 反应的离子方程式,并用双线桥法标注电子转移方向
反应的离子方程式,并用双线桥法标注电子转移方向_________ ,已知 不溶于水。)
不溶于水。)
 (不溶于水),含强氧化性杂质
(不溶于水),含强氧化性杂质 等]制备金属铋的简单工艺如图:
等]制备金属铋的简单工艺如图:
已知:酸性条件下的氧化性:
 。
。(1)“浸出”过程中,溶液中放出的气体是
(2)加入
 溶液的目的是
溶液的目的是(3)检验母液中所含有的主要金属阳离子的方法是
(4)铋的+5价盐类(
 盐)具有强氧化性。欲探究
盐)具有强氧化性。欲探究 盐类的氧化性强弱,某实验小组进行了以下实验,取一定量的
盐类的氧化性强弱,某实验小组进行了以下实验,取一定量的 溶液,向其中依次加入下列试剂,对应的现象如下表所示:
溶液,向其中依次加入下列试剂,对应的现象如下表所示:| 加入溶液 | ①适量铋酸钠固体 | ②过量的双氧水 | ③加入淀粉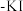 溶液 溶液 |
| 实验现象 | 溶液呈现紫红色 | 紫红色消失,产生气泡 | 溶液变为蓝色 |
①上述试剂的氧化性强弱顺序为:
②写出
 和
和 反应的离子方程式,并用双线桥法标注电子转移方向
反应的离子方程式,并用双线桥法标注电子转移方向 不溶于水。)
不溶于水。)
您最近一年使用:0次
3 . 某化学学习小组在实验室制备无水三氯化铁,其实验装置如下。三氯化铁是棕黄色、易潮解、100℃能升华的物质。
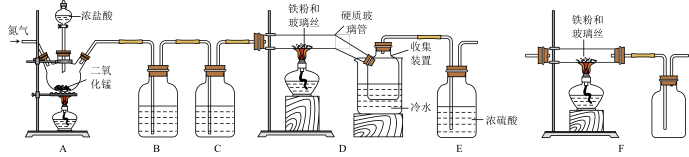
回答下列问题:
(1)装置A中三颈烧瓶里反应的离子方程式是__________________ ;装置C中的试剂为________________________ 。
(2)实验开始前先通氮气的目的是_______________________ 。
(3)装置D_______ (填“能”或“不能”)用装置F替代,原因是______________ 。
(4)请你评价该装置的主要缺点是_________________________ 。
(5)设计实验证明D中硬质玻璃管内还有 :
:_______________ (要求有试剂、现象和操作)。

回答下列问题:
(1)装置A中三颈烧瓶里反应的离子方程式是
(2)实验开始前先通氮气的目的是
(3)装置D
(4)请你评价该装置的主要缺点是
(5)设计实验证明D中硬质玻璃管内还有
 :
:
您最近一年使用:0次
解题方法
4 . 某工厂酸性废液中含有 、
、 、
、 、
、 、
、 ,以该废液为原料制备
,以该废液为原料制备 的工艺流程如下(部分操作和反应条件略):
的工艺流程如下(部分操作和反应条件略):
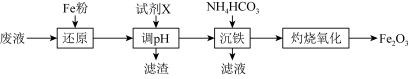
已知:加入试剂X调节pH使 生成沉淀。
生成沉淀。
回答下列问题:
(1)写出“还原”步骤中反应的离子方程式:_____________ 、_________________ 。
(2)若加入Fe粉过量,取少量调节pH过滤后得到的滤液,加入NaOH溶液的现象为_____________ ,请写出沉淀颜色发生变化的化学方程式:_________________________ 。
(3)“沉铁”过程中有 沉淀和气体生成,写出该反应的离子方程式:
沉淀和气体生成,写出该反应的离子方程式:_________________ ; 在空气中经“灼烧氧化”生成
在空气中经“灼烧氧化”生成 ,试写出“灼烧氧化”的化学方程式:
,试写出“灼烧氧化”的化学方程式:____________________ 。
 、
、 、
、 、
、 、
、 ,以该废液为原料制备
,以该废液为原料制备 的工艺流程如下(部分操作和反应条件略):
的工艺流程如下(部分操作和反应条件略):
已知:加入试剂X调节pH使
 生成沉淀。
生成沉淀。回答下列问题:
(1)写出“还原”步骤中反应的离子方程式:
(2)若加入Fe粉过量,取少量调节pH过滤后得到的滤液,加入NaOH溶液的现象为
(3)“沉铁”过程中有
 沉淀和气体生成,写出该反应的离子方程式:
沉淀和气体生成,写出该反应的离子方程式: 在空气中经“灼烧氧化”生成
在空气中经“灼烧氧化”生成 ,试写出“灼烧氧化”的化学方程式:
,试写出“灼烧氧化”的化学方程式:
您最近一年使用:0次
名校
解题方法
5 . 以工业碳酸钙(含少量Na+、Al3+、Fe3+等杂质)生产医用二水合氯化钙晶体(CaCl2·2H2O)的质量分数为97.3%-99.3%,工艺流程为:

(1)加入氢氧化钙溶液调节溶液的pH为8.0 - 8.5,此时Al3+、Fe3+沉淀完全,则滤渣主要成分的化学式为___________ 。
(2)酸化时加盐酸将溶液的pH调节到4.0左右,其目的为: ①___________ ,②防止Ca2+在蒸发时发生水解。
(3)操作Ⅰ中应包括___________ 、 ___________ 、过滤等实验步骤。
(4)为测定样品中CaCl2·2H2O的含量,称取0.735g样品配成250mL溶液,量取该溶液25.00mL于锥形瓶中,用0.05mol/L AgNO3溶液进行滴定,消耗AgNO3溶液的体积为20.40mL。
①通过计算,样品含CaCl2·2H2O的质量百分数为___________ (只写计算式不计算结果)。
②若所测样品CaCl2·2H2O的质量百分数偏高(忽略其它实验操作误差),可能的原因之一为___________ 。

(1)加入氢氧化钙溶液调节溶液的pH为8.0 - 8.5,此时Al3+、Fe3+沉淀完全,则滤渣主要成分的化学式为
(2)酸化时加盐酸将溶液的pH调节到4.0左右,其目的为: ①
(3)操作Ⅰ中应包括
(4)为测定样品中CaCl2·2H2O的含量,称取0.735g样品配成250mL溶液,量取该溶液25.00mL于锥形瓶中,用0.05mol/L AgNO3溶液进行滴定,消耗AgNO3溶液的体积为20.40mL。
①通过计算,样品含CaCl2·2H2O的质量百分数为
②若所测样品CaCl2·2H2O的质量百分数偏高(忽略其它实验操作误差),可能的原因之一为
您最近一年使用:0次
名校
解题方法
6 . Ⅰ.某固体混合物可能由NaCl,K2SO4、FeCl2、CaCl2、K2CO3中的一中或几种混合而成,为鉴定其组成,依次进行如下实验:
①混合物中加入足量水得到无色透明溶液;
②上述溶液中滴加BaCl2有白色沉淀产生;
③过滤,然后向上述白色沉淀中加盐酸时,沉淀全部溶解;
④往滤液中加AgNO3溶液时有白色沉淀产生且白色沉淀不溶于稀硝酸。
试判断:
(1)肯定存在的物质有___________ 。
(2)肯定不存在的物质有___________ 。
Ⅱ.某无色透明溶液中可能大量存在Ag+、Mg2+、Fe3+、Cu2+中的一种或几种。请回答下列问题:
(3)不用做任何实验就可以肯定溶液中不存在的离子是___________ 。
(4)取少量原溶液,加入过量稀盐酸,有白色沉淀生成,再加入过量稀硝酸,沉淀不消失,有关反应的离子方程式为___________ 。
(5)取(4)的滤液加入过量的NaOH溶液,出现白色沉淀,生成沉淀的离子方程式为___________ 。
(6)原溶液中可能大量存在的阴离子是___________ (填序号)。
A.SO B.Cl- C.NO
B.Cl- C.NO D.CO
D.CO E.OH-
E.OH-
①混合物中加入足量水得到无色透明溶液;
②上述溶液中滴加BaCl2有白色沉淀产生;
③过滤,然后向上述白色沉淀中加盐酸时,沉淀全部溶解;
④往滤液中加AgNO3溶液时有白色沉淀产生且白色沉淀不溶于稀硝酸。
试判断:
(1)肯定存在的物质有
(2)肯定不存在的物质有
Ⅱ.某无色透明溶液中可能大量存在Ag+、Mg2+、Fe3+、Cu2+中的一种或几种。请回答下列问题:
(3)不用做任何实验就可以肯定溶液中不存在的离子是
(4)取少量原溶液,加入过量稀盐酸,有白色沉淀生成,再加入过量稀硝酸,沉淀不消失,有关反应的离子方程式为
(5)取(4)的滤液加入过量的NaOH溶液,出现白色沉淀,生成沉淀的离子方程式为
(6)原溶液中可能大量存在的阴离子是
A.SO
 B.Cl- C.NO
B.Cl- C.NO D.CO
D.CO E.OH-
E.OH-
您最近一年使用:0次
名校
解题方法
7 . 已知某纯碱试样中含有NaCl杂质,为测定试样中纯碱的质量分数,可用下图中的装置进行实验。

主要实验步骤如下:
①按图组装仪器,并检验装置的气密性
②将 a g试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液
③称量盛有碱石灰的U形管的质量,得到 b g
④从分液漏斗滴入6 mol/L的硫酸,直到不再产生气体时为止
⑤从导管A处缓缓鼓入一定量的空气
⑥再次称量盛有碱石灰的U形管的质量,得到 c g
⑦重复步骤⑤和⑥的操作,直到U形管的质量基本不变,为 d g
请填空和完成问题:
(1)装置中干燥管B的作用是___________ 。
(2)如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果___________ (填“偏高”“偏低”或“不变”)。
(3)步骤⑤的目的是___________ 。
(4)步骤⑦的目的是___________ 。
(5)试样中纯碱的质量分数的计算式为___________ 。
(6)还可以用其他实验方法测定试样中纯碱的质量分数。请简述一种不同的实验方法:___________ 。

主要实验步骤如下:
①按图组装仪器,并检验装置的气密性
②将 a g试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液
③称量盛有碱石灰的U形管的质量,得到 b g
④从分液漏斗滴入6 mol/L的硫酸,直到不再产生气体时为止
⑤从导管A处缓缓鼓入一定量的空气
⑥再次称量盛有碱石灰的U形管的质量,得到 c g
⑦重复步骤⑤和⑥的操作,直到U形管的质量基本不变,为 d g
请填空和完成问题:
(1)装置中干燥管B的作用是
(2)如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果
(3)步骤⑤的目的是
(4)步骤⑦的目的是
(5)试样中纯碱的质量分数的计算式为
(6)还可以用其他实验方法测定试样中纯碱的质量分数。请简述一种不同的实验方法:
您最近一年使用:0次
名校
解题方法
8 . Ⅰ.现代工业常以氯化钠为原料制备纯碱,部分工艺流程如图:

已知NaHCO3在低温下溶解度较小。
(1)反应Ⅰ的化学方程式为_______ 。
Ⅱ.工业纯碱中常含有少量NaCl,某校化学课外活动小组设计如图所示装置,测定工业纯碱中 Na2CO3的含量。
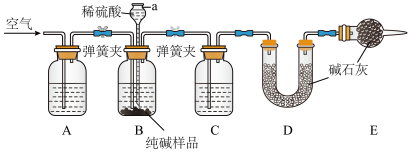
(2)检验装置B气密性的方法是:塞紧带长颈漏斗的三孔橡胶塞,夹紧两侧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于瓶内的水面,停止加水后,若_______ ,说明装置不漏气。
(3)装置A中的试剂为_______ ,装置C中的试剂为_______ 。装置E的作用是_______ 。
(4)实验前称取28.80 g样品,实验后测得D装置增重8.80 g,则样品中Na2CO3的质量分数为_______ (保留一位小数);若缺少E装置,会使测定结果_______ (填“偏高”或“偏低”)。

已知NaHCO3在低温下溶解度较小。
(1)反应Ⅰ的化学方程式为
Ⅱ.工业纯碱中常含有少量NaCl,某校化学课外活动小组设计如图所示装置,测定工业纯碱中 Na2CO3的含量。

(2)检验装置B气密性的方法是:塞紧带长颈漏斗的三孔橡胶塞,夹紧两侧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于瓶内的水面,停止加水后,若
(3)装置A中的试剂为
(4)实验前称取28.80 g样品,实验后测得D装置增重8.80 g,则样品中Na2CO3的质量分数为
您最近一年使用:0次
2023-11-26更新
|
222次组卷
|
3卷引用:安徽省合肥市六校联盟2023-2024学年高一上学期1月期末化学试题
名校
9 . W、X、Y、Z为原子序数依次减小的短周期主族元素,且只有X、Y位于同一周期。这四种元素形成的某种化合物的结构如图所示。下列叙述错误的是
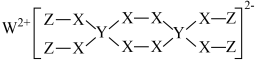
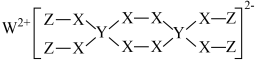
| A.简单气态氢化物的稳定性:X>Y |
| B.Y的氯化物所有原子最外层均达到8电子稳定结构 |
| C.该物质具有强氧化性,可能用于漂白 |
| D.W的最高价氧化物的水化物中既有共价键也有离子键 |
您最近一年使用:0次
2023-02-25更新
|
880次组卷
|
2卷引用:安徽省合肥市第一中学2022-2023 学年高一下学期第三次素质拓展训练化学试题
名校
解题方法
10 . 元素的“价—类”二维图是我们学习元素及其化合物相关知识的重要模型和工具,它指的是以元素的化合价为纵坐标,以物质的类别为横坐标所绘制的二维平面图像。下图为铁元素的“价—类”二维图,图中甲~己均含铁元素。回答下列问题:

(1)下列说法正确的是____
(2)高铁酸盐( )是一种高效净水剂,请结合图像推测其净水原理
)是一种高效净水剂,请结合图像推测其净水原理_______ 。
(3)在戊的溶液中滴加烧碱溶液并放置一段时间的现象是_______ ,在放置过程时的反应化学方程式为_______ 。
(4)已知甲与稀硝酸反应的化学方程式为: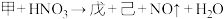 (未配平)。若产物中戊和己的物质的量之比为3:1,还原剂与氧化剂分别为
(未配平)。若产物中戊和己的物质的量之比为3:1,还原剂与氧化剂分别为_______ 和_______ ,二者的物质的量之比为_______ ,该反应的化学方程式_______ 。

(1)下列说法正确的是____
| A.铁与高温水蒸气的反应可实现上述甲到乙的转化 |
B. 是一种黑色粉末,不稳定,在空气中受热时迅速转化为红棕色粉末 是一种黑色粉末,不稳定,在空气中受热时迅速转化为红棕色粉末 |
| C.向戊的水溶液中滴加硫氰化钾溶液后溶液会变成血红色 |
| D.在空气中加热丙会生成红棕色固体 |
 )是一种高效净水剂,请结合图像推测其净水原理
)是一种高效净水剂,请结合图像推测其净水原理(3)在戊的溶液中滴加烧碱溶液并放置一段时间的现象是
(4)已知甲与稀硝酸反应的化学方程式为:
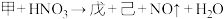 (未配平)。若产物中戊和己的物质的量之比为3:1,还原剂与氧化剂分别为
(未配平)。若产物中戊和己的物质的量之比为3:1,还原剂与氧化剂分别为
您最近一年使用:0次
2023-01-10更新
|
178次组卷
|
3卷引用:安徽省皖北地区2022-2023学年高一上学期期末联考化学试题



