解题方法
1 . 铁是人类较早使用的金属之一、运用铁及其化合物的知识,完成下列问题。
(1)现有铁和铜的混合物,可以通过___________ 把他们分开。
A.盐酸 B.NaOH C.FeCl3
(2)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板。
请写出FeCl3溶液与铜反应的离子方程式:___________ 。
反应后的废液中含有Fe3+,可以用___________ 检验。
(3)现将反应后的废液采用以下流程进行回收再生,根据流程图完成下列填空。___________ ,黄绿色气体C可以把滤液转化成FeCl3腐蚀液,写出反应过程中的离子方程式___________ 。
(4)取“滤液”少许于试管中,然后滴加氢氧化钠溶液,产生白色沉淀,___________ (补全实验现象),此过程涉及氧化还原反应的化学方程式是___________ 。
(5)把一定量铁粉放入氯化铁溶液中,完全反应后,所得溶液中Fe2+和Fe3+的物质的量浓度恰好相等。则已反应的Fe3+和未反应的Fe3+的物质的量之比为___________ 。
(1)现有铁和铜的混合物,可以通过
A.盐酸 B.NaOH C.FeCl3
(2)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板。
请写出FeCl3溶液与铜反应的离子方程式:
反应后的废液中含有Fe3+,可以用
(3)现将反应后的废液采用以下流程进行回收再生,根据流程图完成下列填空。

(4)取“滤液”少许于试管中,然后滴加氢氧化钠溶液,产生白色沉淀,
(5)把一定量铁粉放入氯化铁溶液中,完全反应后,所得溶液中Fe2+和Fe3+的物质的量浓度恰好相等。则已反应的Fe3+和未反应的Fe3+的物质的量之比为
您最近一年使用:0次
解题方法
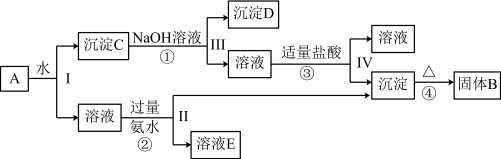
2 . 某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现如图所示的物质之间的变化:
(1)Ⅰ、Ⅱ、Ⅲ、Ⅳ四步中对于溶液和沉淀的分离采取的方法是___________ 。
(2)写出KAl(SO4)2在水中的电离方程式___________ 。
(3)已知H+ +[Al(OH)4]- = Al(OH)3↓+ H2O,根据上述框图反应关系,写出下列B、D、E所含物质的化学式:固体B___________ ;沉淀D___________ ;溶液E是K2SO4和___________ 。
(4)写出①②反应的离子方程式。
①___________ 。
②___________ 。
(1)Ⅰ、Ⅱ、Ⅲ、Ⅳ四步中对于溶液和沉淀的分离采取的方法是
(2)写出KAl(SO4)2在水中的电离方程式
(3)已知H+ +[Al(OH)4]- = Al(OH)3↓+ H2O,根据上述框图反应关系,写出下列B、D、E所含物质的化学式:固体B
(4)写出①②反应的离子方程式。
①
②
您最近一年使用:0次
名校
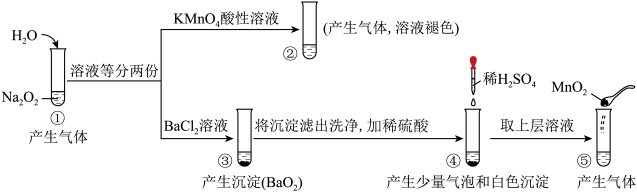
3 . 探究 与水的反应,实验如下(实验中加入的溶液均过量):
与水的反应,实验如下(实验中加入的溶液均过量):
已知:i. 是二元弱酸,能电离出
是二元弱酸,能电离出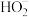 和
和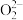
ii.②中发生反应: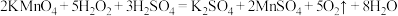
iii. 可以溶解在稀
可以溶解在稀 中
中
下列说法中不正确的是
 与水的反应,实验如下(实验中加入的溶液均过量):
与水的反应,实验如下(实验中加入的溶液均过量):
已知:i.
 是二元弱酸,能电离出
是二元弱酸,能电离出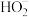 和
和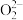
ii.②中发生反应:
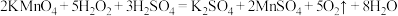
iii.
 可以溶解在稀
可以溶解在稀 中
中下列说法中不正确的是
A.③中生成 的离子反应方程式为 的离子反应方程式为 |
| B.①、⑤中产生的气体能使带火星的木条复燃 |
| C.①、④中均只发生了氧化还原反应 |
D.②、⑤中 与 与 的作用不相同,产生气体的量也不同 的作用不相同,产生气体的量也不同 |
您最近一年使用:0次
名校
4 .  是实验室中一种常见的化学试剂,也是生产生活中常用的净水剂。
是实验室中一种常见的化学试剂,也是生产生活中常用的净水剂。 熔点为306℃,沸点为315℃,易吸收空气中的水分而潮解。巴中中学某化学兴趣设计以下装置,制备
熔点为306℃,沸点为315℃,易吸收空气中的水分而潮解。巴中中学某化学兴趣设计以下装置,制备 。
。
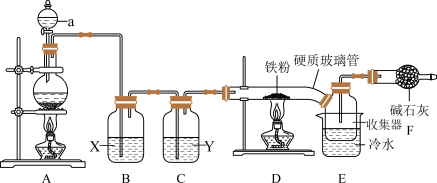
回答下列问题:
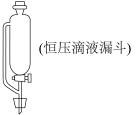
(1)A中发生的化学反应方程式是___________ 。为使实验顺利进行,可将仪器a更换为恒压滴液漏斗(如上图),更换后优点是___________ 。
(2)试剂“X”是___________ ,其作用是___________ 。
(3)硬质玻璃管直接连接收集器的优点___________ 。
(4)实验开始时,应先点燃A处酒精灯,当___________ 时,再点燃D处酒精灯。
(5)装置F作用是吸收多余氯气和___________ ,氯气和碱石灰反应时,若有0.71g氯气被氧化成次氯酸盐,1.42g氯气被氧化成氯酸盐,则被还原的氯原子的物质的量为___________ 。
 是实验室中一种常见的化学试剂,也是生产生活中常用的净水剂。
是实验室中一种常见的化学试剂,也是生产生活中常用的净水剂。 熔点为306℃,沸点为315℃,易吸收空气中的水分而潮解。巴中中学某化学兴趣设计以下装置,制备
熔点为306℃,沸点为315℃,易吸收空气中的水分而潮解。巴中中学某化学兴趣设计以下装置,制备 。
。

回答下列问题:
(1)A中发生的化学反应方程式是
(2)试剂“X”是
(3)硬质玻璃管直接连接收集器的优点
(4)实验开始时,应先点燃A处酒精灯,当
(5)装置F作用是吸收多余氯气和
您最近一年使用:0次
名校
5 . 化学教材上提出:当火灾现场存放有大量活泼金属时,不能用水而需要用干燥的沙土来灭火。王老师上课讲到, 能在
能在 中剧烈燃烧。某化学小组对
中剧烈燃烧。某化学小组对 在
在 气体中燃烧的产物进行了实验探究。
气体中燃烧的产物进行了实验探究。
【提出猜想】 与
与 反应可能生成4种物质:
反应可能生成4种物质: 、
、 、
、 和
和
【查阅资料】①向 溶液中通入
溶液中通入 ,能产生黑色沉淀
,能产生黑色沉淀 ;
;
②将酚酞溶液分别滴入 、
、 、
、 、
、 四种溶液中的现象如下:
四种溶液中的现象如下:
【设计实验、验证猜想】某化学小组设计了如图所示装置(部分夹持仪器已略去);
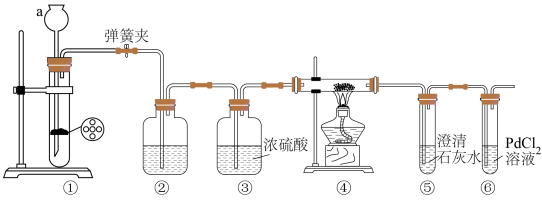
实验步骤及实验记录:
(1)检查装置气密性。装置①气密性检查的方法是___________ ,则装置气密性良好。
(2)装入药品。②中应装入___________ 。
(3)打开弹簧夹,由长颈漏斗注入稀盐酸,①中产生大量气泡,①中反应的离子方程式是___________ 。
(4)当⑤中出现浑浊时,点燃酒精灯。④中 剧烈燃烧,产生白烟,内壁附着黑色和白色固体,⑥中产生黑色沉淀。则反应产物中一定有
剧烈燃烧,产生白烟,内壁附着黑色和白色固体,⑥中产生黑色沉淀。则反应产物中一定有___________ 。⑥中产生黑色沉淀的化学方程式是___________ 。
(5)关闭弹簧夹,待玻璃管冷却后,拆卸装置。取④中白色固体于试管中,加水完全溶解,再加入过量 溶液,产生白色沉淀,则产物中还有
溶液,产生白色沉淀,则产物中还有___________ 。过滤,向滤液中滴加几滴酚酞溶液,溶液未变红,则产物中不含 。加入过量
。加入过量 溶液的目的是
溶液的目的是___________ 。
【实验讨论】能在 气体中剧烈燃烧。
气体中剧烈燃烧。
(6)若 在
在 气体中燃烧时,生成的两种还原产物的物质的量之比为1:1,试写出
气体中燃烧时,生成的两种还原产物的物质的量之比为1:1,试写出 在
在 气体中燃烧的化学反应方程式
气体中燃烧的化学反应方程式___________ 。
 能在
能在 中剧烈燃烧。某化学小组对
中剧烈燃烧。某化学小组对 在
在 气体中燃烧的产物进行了实验探究。
气体中燃烧的产物进行了实验探究。【提出猜想】
 与
与 反应可能生成4种物质:
反应可能生成4种物质: 、
、 、
、 和
和
【查阅资料】①向
 溶液中通入
溶液中通入 ,能产生黑色沉淀
,能产生黑色沉淀 ;
;②将酚酞溶液分别滴入
 、
、 、
、 、
、 四种溶液中的现象如下:
四种溶液中的现象如下:| 溶液 |  |  |  |  |
| 现象 | 无变化 | 无变化 | 溶液变为红色 | 溶液变为红色 |

实验步骤及实验记录:
(1)检查装置气密性。装置①气密性检查的方法是
(2)装入药品。②中应装入
(3)打开弹簧夹,由长颈漏斗注入稀盐酸,①中产生大量气泡,①中反应的离子方程式是
(4)当⑤中出现浑浊时,点燃酒精灯。④中
 剧烈燃烧,产生白烟,内壁附着黑色和白色固体,⑥中产生黑色沉淀。则反应产物中一定有
剧烈燃烧,产生白烟,内壁附着黑色和白色固体,⑥中产生黑色沉淀。则反应产物中一定有(5)关闭弹簧夹,待玻璃管冷却后,拆卸装置。取④中白色固体于试管中,加水完全溶解,再加入过量
 溶液,产生白色沉淀,则产物中还有
溶液,产生白色沉淀,则产物中还有 。加入过量
。加入过量 溶液的目的是
溶液的目的是【实验讨论】能在
 气体中剧烈燃烧。
气体中剧烈燃烧。(6)若
 在
在 气体中燃烧时,生成的两种还原产物的物质的量之比为1:1,试写出
气体中燃烧时,生成的两种还原产物的物质的量之比为1:1,试写出 在
在 气体中燃烧的化学反应方程式
气体中燃烧的化学反应方程式
您最近一年使用:0次
名校
6 . Ⅰ.阅读下面一段材料并回答问题。
(1) 中铁元素的化合价为
中铁元素的化合价为___________ 。
(2)制备 需要在
需要在________ (填“酸性”、“碱性”或“中性”)环境中进行。
(3)下列关于 的说法中,不正确的是
的说法中,不正确的是________
a.是强氧化性的盐 b.固体保存需要防潮
c.其消毒和净化水的原理相同 d.其净水优点有:作用快、安全性好、无异味
Ⅱ.如图是以铁屑为原料制备 的工艺流程图:
的工艺流程图:

请回答下列问题:
(4)流程图中的吸收剂X为________(填字母)。
(5)氧化剂Y为漂白液的有效成分;反应④的化学方程式中氧化剂与还原剂的物质的量之比为______ 。
(6)写出反应⑤的化学方程式________ 。
| 高铁酸钾使用说明书 【化学式】  【性状】暗紫色具有金属光泽的粉末,无臭无味 【产品特点】干燥品在室温下稳定,在强碱溶液中稳定,随着  减小,稳定性下降,与水反应放出氧气, 减小,稳定性下降,与水反应放出氧气, 通过强烈的氧化作用可迅速杀灭细菌有消毒作用,同时不会产生有害物质。 通过强烈的氧化作用可迅速杀灭细菌有消毒作用,同时不会产生有害物质。 与水反应还能产生具有强吸附性的 与水反应还能产生具有强吸附性的 胶体,可除去水中细微的悬浮物,有净水作用 胶体,可除去水中细微的悬浮物,有净水作用【用途】主要用于饮用水消毒净化、城市生活污水和工业污水处理 【用量】消毒净化  水投放: 水投放: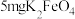 ,即可达到卫生标准 ,即可达到卫生标准 |
(1)
 中铁元素的化合价为
中铁元素的化合价为(2)制备
 需要在
需要在(3)下列关于
 的说法中,不正确的是
的说法中,不正确的是a.是强氧化性的盐 b.固体保存需要防潮
c.其消毒和净化水的原理相同 d.其净水优点有:作用快、安全性好、无异味
Ⅱ.如图是以铁屑为原料制备
 的工艺流程图:
的工艺流程图:
请回答下列问题:
(4)流程图中的吸收剂X为________(填字母)。
A. 溶液 溶液 | B. 粉 粉 | C. 溶液 溶液 | D. 溶液 溶液 |
(5)氧化剂Y为漂白液的有效成分;反应④的化学方程式中氧化剂与还原剂的物质的量之比为
(6)写出反应⑤的化学方程式
您最近一年使用:0次
7 . 我国科学家侯德榜发明了联合制碱法。以氯化钠、氨及二氧化碳为原料,同时生产纯碱和氯化铵两种产品,又称“侯氏制碱法”,对世界制碱工业做出了卓越贡献。
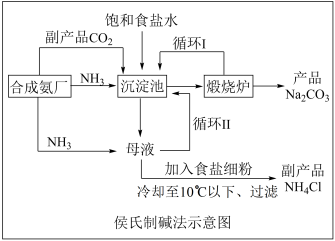
Ⅰ.工厂制备纯碱的工艺流程如图所示:
(1)煅烧炉中发生的反应方程式是___________ 。
(2)关于该工艺流程下列说法正确的是___________(填序号)。
(3)检验产品纯碱中是否含有 的实验操作是:取少量试样于试管中,加水溶解并加入适量
的实验操作是:取少量试样于试管中,加水溶解并加入适量___________ ,若无白色沉淀生成,则产品中不含 。
。
Ⅱ.实验室模拟制备纯碱(下图所示,浓氨水受热分解生成氨气)
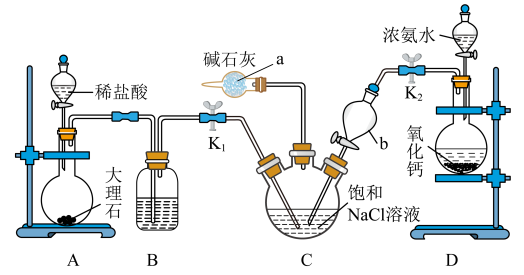
(4)仪器a的名称是___________ 。
(5)装置C中反应的离子方程式为___________ 。
(6)由装置 中产生的
中产生的 制取
制取 时,需要进行的实验操作有过滤、灼烧 。灼烧操作在
时,需要进行的实验操作有过滤、灼烧 。灼烧操作在___________ (填实验仪器)中进行。
(7)为了确定加热后固体的组成,某化学兴趣小组准确称取 产品,配制成
产品,配制成 溶液,向所得溶液中加入
溶液,向所得溶液中加入 溶液,所得气体体积(已折算为标准状况)与加入盐酸体积的关系如图所示。
溶液,所得气体体积(已折算为标准状况)与加入盐酸体积的关系如图所示。
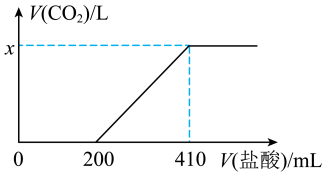
①由图像分析, 产品中的杂质有
产品中的杂质有___________ (填化学式)。
②图中
___________ 。

Ⅰ.工厂制备纯碱的工艺流程如图所示:
(1)煅烧炉中发生的反应方程式是
(2)关于该工艺流程下列说法正确的是___________(填序号)。
A.用 制取纯碱的过程中,利用了物质溶解度的差异 制取纯碱的过程中,利用了物质溶解度的差异 |
B.沉淀池中应先通入 ,再通入 ,再通入 |
C.循环Ⅰ和循环Ⅱ回收利用的物质分别是 和 和 |
D.在母液中加入食盐细粉目的是提高 的浓度,促进碳酸氢钠结晶析出 的浓度,促进碳酸氢钠结晶析出 |
(3)检验产品纯碱中是否含有
 的实验操作是:取少量试样于试管中,加水溶解并加入适量
的实验操作是:取少量试样于试管中,加水溶解并加入适量 。
。Ⅱ.实验室模拟制备纯碱(下图所示,浓氨水受热分解生成氨气)

(4)仪器a的名称是
(5)装置C中反应的离子方程式为
(6)由装置
 中产生的
中产生的 制取
制取 时,需要进行的实验操作有过滤、灼烧 。灼烧操作在
时,需要进行的实验操作有过滤、灼烧 。灼烧操作在(7)为了确定加热后固体的组成,某化学兴趣小组准确称取
 产品,配制成
产品,配制成 溶液,向所得溶液中加入
溶液,向所得溶液中加入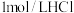 溶液,所得气体体积(已折算为标准状况)与加入盐酸体积的关系如图所示。
溶液,所得气体体积(已折算为标准状况)与加入盐酸体积的关系如图所示。
①由图像分析,
 产品中的杂质有
产品中的杂质有②图中

您最近一年使用:0次
名校
8 . 铁有两种氯化物,都是重要的化工试剂。查阅有关资料如下:
氯化铁:熔点为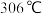 ,沸点为
,沸点为 ;易吸收空气中的水分而潮解。工业上采用向
;易吸收空气中的水分而潮解。工业上采用向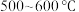 的铁粉中通入氯气来生产无水氯化铁。
的铁粉中通入氯气来生产无水氯化铁。
氯化亚铁:熔点为 ,可升华。工业上采用向炽热铁粉中通入氯化氢来生产无水氯化亚铁。
,可升华。工业上采用向炽热铁粉中通入氯化氢来生产无水氯化亚铁。
某化学活动小组用如图所示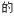 装置(夹持装置略去)模拟工业生产制备无水氯化铁。请回答下列问题:
装置(夹持装置略去)模拟工业生产制备无水氯化铁。请回答下列问题:

(1)在装置A中,用MnO2与浓盐酸反应制取氯气(加热装置略去),写出反应的化学方程式___________ ,当生成35.5g氯气,做还原剂的HCl的物质的量为___________ mol。
(2)C放置在盛冷水的水槽中,水浴的作用是___________ 。
(3)仪器D的名称是___________ ,D中装的药品可以是___________ (填序号)
A. B.碱石灰 C.
B.碱石灰 C. D.
D.
(4)定性分析。取装置C中的少量产物溶于稀硫酸中配成稀溶液待用。若产物中混有 ,可用下列试剂中的___________进行检测。(填序号,试剂不组合使用)
,可用下列试剂中的___________进行检测。(填序号,试剂不组合使用)
氯化铁:熔点为
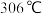 ,沸点为
,沸点为 ;易吸收空气中的水分而潮解。工业上采用向
;易吸收空气中的水分而潮解。工业上采用向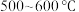 的铁粉中通入氯气来生产无水氯化铁。
的铁粉中通入氯气来生产无水氯化铁。氯化亚铁:熔点为
 ,可升华。工业上采用向炽热铁粉中通入氯化氢来生产无水氯化亚铁。
,可升华。工业上采用向炽热铁粉中通入氯化氢来生产无水氯化亚铁。某化学活动小组用如图所示
 装置(夹持装置略去)模拟工业生产制备无水氯化铁。请回答下列问题:
装置(夹持装置略去)模拟工业生产制备无水氯化铁。请回答下列问题:
(1)在装置A中,用MnO2与浓盐酸反应制取氯气(加热装置略去),写出反应的化学方程式
(2)C放置在盛冷水的水槽中,水浴的作用是
(3)仪器D的名称是
A.
 B.碱石灰 C.
B.碱石灰 C. D.
D.
(4)定性分析。取装置C中的少量产物溶于稀硫酸中配成稀溶液待用。若产物中混有
 ,可用下列试剂中的___________进行检测。(填序号,试剂不组合使用)
,可用下列试剂中的___________进行检测。(填序号,试剂不组合使用)A. 溶液 溶液 | B.酸性 溶液 溶液 | C. 溶液 溶液 | D.KI-淀粉溶液 |
您最近一年使用:0次
9 . 为了探究氯水中次氯酸的漂白性,某同学设计并完成以下实验。

请回答下列问题:
(1)仪器a的名称是___________ 。
(2)写出 和水反应的离子方程式:
和水反应的离子方程式:___________ 。
(3)利用上图所示装置(部分夹持装置已省略)进行实验,关闭阀门A时,试管中的有色布条___________ (填“会”或“不会”)褪色;打开阀门A后,有色布条褪色,说明___________ 。
(4)该同学依据氯水中的成分,对此实验结论的严谨性提出质疑,并提出进一步探究盐酸是否具有漂白性。___________ (填“有”或“没有”)必要进行该探究,请说明理由:___________ 。
(5)若将装置中的蒸馏水改为石灰乳来制备漂白粉,写出氯气与石灰乳反应的化学方程式:________ ;漂白粉长时间暴露在空气中容易发生变质的原因为________ (结合化学方程式说明)。

请回答下列问题:
(1)仪器a的名称是
(2)写出
 和水反应的离子方程式:
和水反应的离子方程式:(3)利用上图所示装置(部分夹持装置已省略)进行实验,关闭阀门A时,试管中的有色布条
(4)该同学依据氯水中的成分,对此实验结论的严谨性提出质疑,并提出进一步探究盐酸是否具有漂白性。
(5)若将装置中的蒸馏水改为石灰乳来制备漂白粉,写出氯气与石灰乳反应的化学方程式:
您最近一年使用:0次
2023-12-04更新
|
337次组卷
|
5卷引用:四川省雅安市2023-2024学年高一上学期期中考试化学试题
名校
解题方法
10 . 通过海水晾晒可得粗盐,粗盐中除含有NaCl外,还含有 、
、 、
、 以及泥沙等杂质。制备精盐的各步操作流程如下:
以及泥沙等杂质。制备精盐的各步操作流程如下:

(1)为除去 、
、 、
、 ,步骤②~④需加入以下三种溶液(用于沉淀的试剂稍过量)加入的顺序为
,步骤②~④需加入以下三种溶液(用于沉淀的试剂稍过量)加入的顺序为___________ (填字母)。
A. B.
B. C.NaOH
C.NaOH
请用离子方程式表示 在此流程中起的2个作用
在此流程中起的2个作用___________ 。
(2)在第③步操作中,选择的除杂试剂不能是KOH溶液,理由是___________ 。
(3)第⑤步操作中,需要的玻璃仪器有___________ 、___________ 、___________ 。
(4)第⑥步操作中发生反应的离子方程式为___________ 。
 、
、 、
、 以及泥沙等杂质。制备精盐的各步操作流程如下:
以及泥沙等杂质。制备精盐的各步操作流程如下:
(1)为除去
 、
、 、
、 ,步骤②~④需加入以下三种溶液(用于沉淀的试剂稍过量)加入的顺序为
,步骤②~④需加入以下三种溶液(用于沉淀的试剂稍过量)加入的顺序为A.
 B.
B. C.NaOH
C.NaOH请用离子方程式表示
 在此流程中起的2个作用
在此流程中起的2个作用(2)在第③步操作中,选择的除杂试剂不能是KOH溶液,理由是
(3)第⑤步操作中,需要的玻璃仪器有
(4)第⑥步操作中发生反应的离子方程式为
您最近一年使用:0次
2023-11-14更新
|
122次组卷
|
2卷引用:四川省宜宾市兴文第二中学校2023-2024学年高一上学期1月期末化学试题



