名校
解题方法
1 . 铁及其化合物与生产、生活息息相关。回答下列问题:
(1) 易被人体吸收,医生建议在服用该补铁剂时,同时服用维生素C.维生素C的作用是
易被人体吸收,医生建议在服用该补铁剂时,同时服用维生素C.维生素C的作用是_______ 。
(2)印刷电路板的制作原理是用足量的 溶液腐蚀覆铜板上不需要的铜箔。写出上述反应的化学方程式:
溶液腐蚀覆铜板上不需要的铜箔。写出上述反应的化学方程式:_______ 。
(3)生铁是通过高炉冶炼而得到的,以赤铁矿为例用 将其还原的化学方程式为
将其还原的化学方程式为_______ 。
(4)某废料铁泥的主要成分为 、
、 、
、 和杂质(杂质不与硫酸反应)。现取
和杂质(杂质不与硫酸反应)。现取 废料铁泥提取
废料铁泥提取 ,设计实验流程如下:
,设计实验流程如下:

①分离溶液A和沉淀C的操作中使用到的玻璃仪器有烧杯、_______ 、_______ 。
②能检验溶液A中含有 的试剂是
的试剂是_______ (填字母)。
A.铁粉 B.酸性 溶液 C.KSCN溶液
溶液 C.KSCN溶液
③步骤Ⅱ中发生反应的离子方程式为_______ 。
④若最终获得 ,则废料铁泥中铁元素的质量分数为
,则废料铁泥中铁元素的质量分数为_______ 。
(1)
 易被人体吸收,医生建议在服用该补铁剂时,同时服用维生素C.维生素C的作用是
易被人体吸收,医生建议在服用该补铁剂时,同时服用维生素C.维生素C的作用是(2)印刷电路板的制作原理是用足量的
 溶液腐蚀覆铜板上不需要的铜箔。写出上述反应的化学方程式:
溶液腐蚀覆铜板上不需要的铜箔。写出上述反应的化学方程式:(3)生铁是通过高炉冶炼而得到的,以赤铁矿为例用
 将其还原的化学方程式为
将其还原的化学方程式为(4)某废料铁泥的主要成分为
 、
、 、
、 和杂质(杂质不与硫酸反应)。现取
和杂质(杂质不与硫酸反应)。现取 废料铁泥提取
废料铁泥提取 ,设计实验流程如下:
,设计实验流程如下:
①分离溶液A和沉淀C的操作中使用到的玻璃仪器有烧杯、
②能检验溶液A中含有
 的试剂是
的试剂是A.铁粉 B.酸性
 溶液 C.KSCN溶液
溶液 C.KSCN溶液③步骤Ⅱ中发生反应的离子方程式为
④若最终获得
 ,则废料铁泥中铁元素的质量分数为
,则废料铁泥中铁元素的质量分数为
您最近一年使用:0次
2023-01-20更新
|
519次组卷
|
7卷引用:甘肃省金昌市永昌县第一高级中学2022-2023学年高一上学期期末考试化学试题
名校
解题方法
2 . 某品牌糖衣片补血剂,除去糖衣后显淡蓝绿色,主要成分是硫酸亚铁,不含其它铁的化合物。某研究性学习小组为测定该补血剂中硫酸亚铁的含量进行了以下探究:
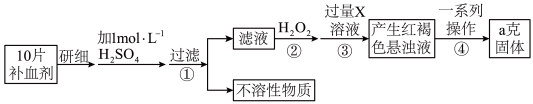
请回答下列问题:
Ⅰ、
(1)实验时用 的浓硫酸,配制100mL
的浓硫酸,配制100mL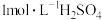 溶液,所需浓硫酸的体积为
溶液,所需浓硫酸的体积为___________ mL(计算结果精确到小数点后一位)。
(2)下列操作中,容量瓶所具备的功能有___________(填序号)。
(3)在下列配制过程示意图中,有错误的是(填写序号)___________ 。
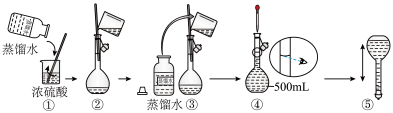
(4)下列说法正确的___________。
Ⅱ、
(5)步骤②加入过量 的目的:
的目的:___________ 。发生反应的离子方程式为:___________ 。
(6)从红褐色的悬浊液到最后的称量,其过程中所需的基本操作为:
a、___________ ,b、洗涤,c、灼烧,d、冷却
(7)若称得固体的质量为ag,则每片补血剂中含硫酸亚铁的质量为___________ g。

请回答下列问题:
Ⅰ、
(1)实验时用
 的浓硫酸,配制100mL
的浓硫酸,配制100mL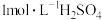 溶液,所需浓硫酸的体积为
溶液,所需浓硫酸的体积为(2)下列操作中,容量瓶所具备的功能有___________(填序号)。
| A.配制一定体积准确浓度的标准溶液 | B.长期贮存溶液 |
| C.用来溶解固体溶质 | D.常用来代替量筒量取一定体积的液体 |

(4)下列说法正确的___________。
| A.洗涤烧杯2~3次,并将洗涤液移入容量瓶以减少误差 |
| B.某同学将浓硫酸稀释后未冷却至室温便将溶液转移至容量瓶,所配溶液浓度会偏低 |
| C.定容时仰视观察,所配溶液浓度会偏低 |
| D.容量瓶使用前先要检查是否漏液,具体操作是向容量瓶中加蒸馏水,倒置不漏液即可 |
Ⅱ、
(5)步骤②加入过量
 的目的:
的目的:(6)从红褐色的悬浊液到最后的称量,其过程中所需的基本操作为:
a、
(7)若称得固体的质量为ag,则每片补血剂中含硫酸亚铁的质量为
您最近一年使用:0次
2023-01-10更新
|
195次组卷
|
3卷引用:甘肃省张掖市高台县第一中学2022-2023学年高一下学期开学检测化学试题
10-11高三·江西·阶段练习
名校
解题方法
3 . 两种硫酸盐按一定比例混合后共熔,可制得化合物X,且X溶于水能电离出K+、Cr3+、SO ,若将2.83gX中的Cr3+全部氧化为Cr2O
,若将2.83gX中的Cr3+全部氧化为Cr2O 后,溶液中的Cr2O
后,溶液中的Cr2O 可和过量KI溶液反应,得到3.81gI2,反应的离子方程式为Cr2O
可和过量KI溶液反应,得到3.81gI2,反应的离子方程式为Cr2O +6I-+14H+=2Cr3++3I2+7H2O。若向溶有2.83gX的溶液中,加入过量的BaCl2溶液,可得到4.66g白色沉淀。由此可推断出X的化学式为
+6I-+14H+=2Cr3++3I2+7H2O。若向溶有2.83gX的溶液中,加入过量的BaCl2溶液,可得到4.66g白色沉淀。由此可推断出X的化学式为
 ,若将2.83gX中的Cr3+全部氧化为Cr2O
,若将2.83gX中的Cr3+全部氧化为Cr2O 后,溶液中的Cr2O
后,溶液中的Cr2O 可和过量KI溶液反应,得到3.81gI2,反应的离子方程式为Cr2O
可和过量KI溶液反应,得到3.81gI2,反应的离子方程式为Cr2O +6I-+14H+=2Cr3++3I2+7H2O。若向溶有2.83gX的溶液中,加入过量的BaCl2溶液,可得到4.66g白色沉淀。由此可推断出X的化学式为
+6I-+14H+=2Cr3++3I2+7H2O。若向溶有2.83gX的溶液中,加入过量的BaCl2溶液,可得到4.66g白色沉淀。由此可推断出X的化学式为| A.K2SO4•2Cr2(SO4)3 | B.K2SO4•Cr2(SO4)3 |
| C.2K2SO4•Cr2(SO4)3 | D.K2SO4• Cr2(SO4)3 Cr2(SO4)3 |
您最近一年使用:0次
2022-11-21更新
|
286次组卷
|
11卷引用:甘肃省天水一中2017-2018学年高一下学期入学考试化学试题
甘肃省天水一中2017-2018学年高一下学期入学考试化学试题豫中名校2022-2023学年高一上学期期中考试化学试题重庆市南开中学2022-2023学年高一上期期末考试化学试题(已下线)2012届江西省白鹭洲中学高三第一次月考化学试卷(已下线)2012届安徽省宿州市高三第一次教学质量检测化学试卷(已下线)2015届江西省奉新县第一中学高三上学期第一次月考化学试卷辽宁省六校2021届高三上学期期中联考化学试题广东省中山纪念中学2021届高三上学期第一次月考化学试题(已下线)考点05 氧化还原反应-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点05 氧化还原反应-备战2022年高考化学一轮复习考点帮(浙江专用)宁夏石嘴山市第三中学2021-2022学年高三上学期期中考试化学(理)试题
名校
解题方法
4 . 已知:将Cl2通入适量NaOH溶液中,反应会放热,当温度升高后会发生如下反应:3Cl2+6NaOH=5NaCl+NaClO3+3H2O。则Cl2通入NaOH溶液的产物中可能有NaCl、NaClO、NaClO3中的两种或三种,且 的值与温度高低有关。当参与反应的n(NaOH)= a mol时,下列说法错误的是
的值与温度高低有关。当参与反应的n(NaOH)= a mol时,下列说法错误的是
 的值与温度高低有关。当参与反应的n(NaOH)= a mol时,下列说法错误的是
的值与温度高低有关。当参与反应的n(NaOH)= a mol时,下列说法错误的是| A.与碱的反应中,Cl2既是氧化剂又是还原剂 |
| B.参加反应的Cl2物质的量为0.5a mol |
C.若某温度下,反应后 =6,则溶液中 =6,则溶液中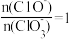 |
D.改变温度,反应中转移电子的物质的量可能为 mol mol |
您最近一年使用:0次
2022-10-24更新
|
2092次组卷
|
12卷引用:甘肃省酒泉市玉门油田第一中学2022-2023学年高一上学期期中考试化学(A卷)试题
甘肃省酒泉市玉门油田第一中学2022-2023学年高一上学期期中考试化学(A卷)试题江苏省无锡市锡山高级中学2021-2022学年高一上学期期中考试化学试题山东省实验中学2022-2023学年高一上学期11月期中考试化学试题北京市第八中学2022-2023学年高一上学期12月月考化学试题陕西省榆林中学2022-2023学年高一上学期期末考试化学试题浙江省宁波市北仑中学2022-2023学年高一下学期期初返校考试(选考)化学试题江苏省苏州中学2022-2023学年高一下学期开学考试化学试题陕西省安康市2022-2023学年高一下学期开学摸底考试化学试题辽宁省沈阳市五校协作体2022-2023学年高一上学期期末考试化学试题 山东省淄博市部分学校联考2022-2023学年高一下学期4月期中考试化学试题新疆塔城地区第一高级中学2022-2023学年高一下学期开学考试化学试题(已下线)专题03 氧化还原反应-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(人教版2019必修第一册)
名校
5 . Z、Y、X、W、Q为五种原子序数依次增大的短周期主族元素。其中Z、Y、W分别位于三个不同周期,Y、Q位于同一主族,Y原子的最外层电子数是W原子的最外层电子数的2倍,Y、X、W三种简单离子的核外电子排布相同。由Z、Y、X、W形成的某种化合物的结构如图所示。下列说法不正确 的是
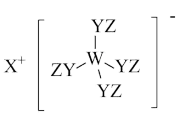
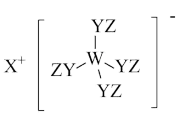
A.简单氢化物的稳定性: |
B.该物质中所有原子均满足最外层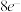 的稳定结构 的稳定结构 |
| C.X与Y、Y与Z均可形成含非极性共价键的化合物 |
| D.W与X两者的最高价氧化物对应的水化物之间可发生反应 |
您最近一年使用:0次
2022-01-25更新
|
911次组卷
|
8卷引用:甘肃省武威市民勤县第一中学2023-2024学年高一下学期开学考试化学试题
名校
6 . 某工厂的工业废水中含有大量的 和较多的
和较多的 。为了减少污染并变废为宝,工厂计划从该废水中回收
。为了减少污染并变废为宝,工厂计划从该废水中回收 和金属铜。请根据以下流程图,回答下列问题。
和金属铜。请根据以下流程图,回答下列问题。

(1)操作方法①是_______ 。
(2)加入试剂b是_______ (填写试剂化学式)。
(3)溶液③中所含的离子有_______ (填写离子符号)。
(4)若取 溶液②加入试管中,然后滴加氢氧化钠溶液,产生的现象
溶液②加入试管中,然后滴加氢氧化钠溶液,产生的现象_______ 。
(5)若取少量溶液②加入试管中,滴加一定量新制氯水,写出反应离子方程式_______ 。
(6)产品取样研究:取 产品加水溶解,滴加
产品加水溶解,滴加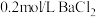 溶液至不再产生沉淀,共消耗
溶液至不再产生沉淀,共消耗 溶液
溶液 ,计算取样产品的纯度
,计算取样产品的纯度_______ 。
 和较多的
和较多的 。为了减少污染并变废为宝,工厂计划从该废水中回收
。为了减少污染并变废为宝,工厂计划从该废水中回收 和金属铜。请根据以下流程图,回答下列问题。
和金属铜。请根据以下流程图,回答下列问题。
(1)操作方法①是
(2)加入试剂b是
(3)溶液③中所含的离子有
(4)若取
 溶液②加入试管中,然后滴加氢氧化钠溶液,产生的现象
溶液②加入试管中,然后滴加氢氧化钠溶液,产生的现象(5)若取少量溶液②加入试管中,滴加一定量新制氯水,写出反应离子方程式
(6)产品取样研究:取
 产品加水溶解,滴加
产品加水溶解,滴加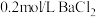 溶液至不再产生沉淀,共消耗
溶液至不再产生沉淀,共消耗 溶液
溶液 ,计算取样产品的纯度
,计算取样产品的纯度
您最近一年使用:0次
2022-01-22更新
|
247次组卷
|
2卷引用:甘肃省武威第一中学2021-2022学年高一下学期开学考试化学试题
11-12高二上·浙江嘉兴·期中
7 . 已知在酸性溶液中,下列物质氧化 时,自身发生如下变化:
时,自身发生如下变化: ,
, ,
, ,
,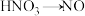 ,如果分别用相同数目的这些微粒氧化足量的
,如果分别用相同数目的这些微粒氧化足量的 ,得到
,得到 最多的是
最多的是
 时,自身发生如下变化:
时,自身发生如下变化: ,
, ,
, ,
,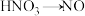 ,如果分别用相同数目的这些微粒氧化足量的
,如果分别用相同数目的这些微粒氧化足量的 ,得到
,得到 最多的是
最多的是A. | B. | C. | D. |
您最近一年使用:0次
2022-01-21更新
|
317次组卷
|
24卷引用:2014—2015学年甘肃兰州一中高一上学期期中考试化学卷
(已下线)2014—2015学年甘肃兰州一中高一上学期期中考试化学卷(已下线)2011-2012学年北京市师大附中高一上学期期中考试化学试卷(已下线)2012-2013学年河北枣强县中学高一上学期期末考试化学试卷上海交通大学附属中学2016-2017学年高一下学期质量检测一(3月)化学试题山东省曲阜师范大学附属中学2017-2018学年高一上学期期中考试化学试题北京师范大学附属中学2017-2018学年高一上学期期中考试化学试题【全国百强校】内蒙古鄂尔多斯市第一中学2018-2019学年高一上学期期中考试化学试题【全国百强校】新疆维吾尔自治区生产建设兵团第二中学2018-2019学年高一上学期期中检测化学试题【全国百强校】黑龙江省哈尔滨市第三中学校2018-2019学年高一上学期第二次月考化学试题安徽省阜阳市第三中学2019-2020学年高一上学期第二次调研考试化学试题山西省祁县第二中学校2019-2020学年高一上学期期中考试化学试题四川省三台中学2019-2020学年高一上学期第三次月考化学试题新疆昌吉教育共同体2020-2021学年高一下学期期末质量检测化学试题河北省辛集市第一中学2021-2022学年高一上学期第一次月考化学试题河北省石家庄市第一中学2021-2022学年高一上学期期中考试化学试卷吉林省洮南市第一中学2021-2022学年高一上学期期中考试化学试题内蒙古呼和浩特市2021-2022学年高一上学期期末考试化学试题内蒙古赤峰二中2021-2022学年高一上学期第二次月考化学试题北京市北京师范大学附属中学2022-2023学年高一上学期期中考试化学试题北京市清华大学附属中学2023-2024学年高一上学期12月统练二化学试题 河北省石家庄市第二中学西校区2023-2024学年高一上学期12月月考化学试题北京师范大学附属中学2023-2024学年高一上学期期中考试化学试题北京市陈经纶中学2023-2024学年高一上学期12月月考化学试卷 (已下线)2011-2012学年浙江省嘉兴一中高二上学期期中考试化学试卷
解题方法
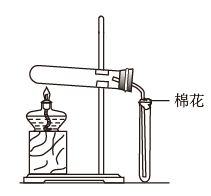
8 . 某研究性学习小组请你参与“研究铁与水蒸气反应所得固体物质的成分、性质及再利用”实验探究,并回答下列问题:
【查阅资料】含有Fe3+的盐溶液遇到KSCN溶液时变成红色,含有Fe2+的盐溶液遇到KSCN溶液时不变色。
探究一:设计如图所示装置进行“铁与水蒸气反应”的实验(夹持仪器略)。

(1)硬质玻璃管B中发生反应的化学方程式为____ 。
(2)装置D的作用是____ 。
探究二:设计如图实验方案确定反应后硬质玻璃管B中黑色固体的成分(已知酸性KMnO4溶液能与盐酸发生反应)。
(3)待硬质玻璃管B冷却后,取少许其中的固体继续进行如图实验:
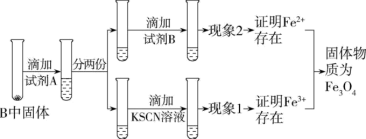
①试剂B是____ ,现象2为____ 。
②若现象1为溶液未变红色,请从硬质玻璃管B中固体物质的成分分析可能的原因:____ 。
探究三:某学习小组设计用硬质玻璃管B中固体制备Fe3O4纳米材料的流程示意图如图:

已知:①浊液B中铁元素以FeOOH形式存在;
②在操作Ⅰ中,相同条件下测得Fe3O4的产率与R[R=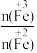 ]的关系如图所示。
]的关系如图所示。

(4)在滤液A转化为浊液B反应完成后需再加热一段时间除去剩余H2O2,目的是____ 。
(5)设浊液B中FeOOH的物质的量为amol,滤液A中的n(Fe)=bmol。为使Fe3O4的产率最高,则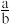 =
=____ 。(填数值,保留3位有效数字)
【查阅资料】含有Fe3+的盐溶液遇到KSCN溶液时变成红色,含有Fe2+的盐溶液遇到KSCN溶液时不变色。
探究一:设计如图所示装置进行“铁与水蒸气反应”的实验(夹持仪器略)。

(1)硬质玻璃管B中发生反应的化学方程式为
(2)装置D的作用是
探究二:设计如图实验方案确定反应后硬质玻璃管B中黑色固体的成分(已知酸性KMnO4溶液能与盐酸发生反应)。
(3)待硬质玻璃管B冷却后,取少许其中的固体继续进行如图实验:

①试剂B是
②若现象1为溶液未变红色,请从硬质玻璃管B中固体物质的成分分析可能的原因:
探究三:某学习小组设计用硬质玻璃管B中固体制备Fe3O4纳米材料的流程示意图如图:

已知:①浊液B中铁元素以FeOOH形式存在;
②在操作Ⅰ中,相同条件下测得Fe3O4的产率与R[R=
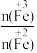 ]的关系如图所示。
]的关系如图所示。
(4)在滤液A转化为浊液B反应完成后需再加热一段时间除去剩余H2O2,目的是
(5)设浊液B中FeOOH的物质的量为amol,滤液A中的n(Fe)=bmol。为使Fe3O4的产率最高,则
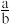 =
=
您最近一年使用:0次
9 . 在实验室采用如图装置制备气体,合理的是
| 化学试剂 | 制备的气体 | |
| A | 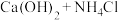 |  |
| B | 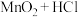 (浓) (浓) |  |
| C | 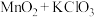 |  |
| D | 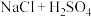 (浓) (浓) |  |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-06-09更新
|
21810次组卷
|
50卷引用:甘肃省张掖市高台县第一中学2022-2023学年高一上学期期中考试化学试题
甘肃省张掖市高台县第一中学2022-2023学年高一上学期期中考试化学试题陕西省西北农林科技大学附属中学2021-2022学年高一上学期期末考试化学试题湖南省郴州市汝城县第一中学2022-2023学年高一上学期期中考试化学试题(已下线)专题04 常见气体的实验室制取(专题过关)-2022-2023学年高一化学下学期期中期末考点大串讲(人教版2019必修第二册)云南省开远市第一中学校2023-2024学年高一上学期9月半月考试化学试题章末知识整合吉林省通化市辉南县第六中学2023-2024学年高一下学期3月半月考化学试卷 2021年高考全国乙卷化学真题河南省三门峡市实验高中2020-2021学年高二下学期6月月考化学试题河北省辛集中学 2020-2021学年高二下学期期末考试化学试题(已下线)第29讲 化学综合实验(精练)-2022年高考化学一轮复习讲练测(已下线)考点31 物质的制备 定量分析-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点34 物质的制备与合成-备战2022年高考化学一轮复习考点帮(浙江专用)山西省实验中学2021-2022学年高二下学期开学分班素质测试化学试题(已下线)课时53 简单实验方案的设计与评价-2022年高考化学一轮复习小题多维练(全国通用)四川省眉山市彭山区第一中学2021-2022学年高二上学期入学考试化学试题宁夏中卫市中宁县第一中学2021-2022学年高三上学期第一次月考化学试题四川省邻水实验学校2021-2022学年高二上学期第一次月考化学试题内蒙古北京八中乌兰察布分校2021-2022学年高三上学期学科素养评估一化学试题(已下线)专题13 化学实验-备战2022年高考化学学霸纠错(全国通用)(已下线)第29讲 常见气体的制备与性质实验(讲) — 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)2021年高考全国乙卷化学试题变式题(已下线)专题07 非金属及其化合物-2022年高考化学二轮复习重点专题常考点突破练(已下线)解密11 化学实验基础(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密11 化学实验(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)专题05 化学基础实验—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)秘籍04 实验仪器使用与基本操作-备战2022年高考化学抢分秘籍(全国通用)(已下线)卷01 小题仿真卷-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)(已下线)押全国卷理综第9题 化学实验基础-备战2022年高考化学临考题号押题(课标全国卷)(已下线)查补易混易错点08 化学实验基础-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)(已下线)专题11 基本实验专练(已下线)专题11化学实验基础-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题11化学实验基础-五年(2018~2022)高考真题汇编(全国卷)(已下线)微专题24 氯气、氨气、二氧化硫的实验室制备与应用-备战2023年高考化学一轮复习考点微专题(已下线)考点51 物质的制备-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)专题讲座(四) 常见气体的实验室制备、净化和收集(练)-2023年高考化学一轮复习讲练测(全国通用)安徽省砀山县第四中学2022-2023学年高三上学期第一次月考化学试题(已下线)第27讲 物质的制备与性质实验(讲)-2023年高考化学一轮复习讲练测(新教材新高考)安徽省亳州市第五完全中学2021-2022学年高三上学期期中考试化学试题山西省实验中学2021-2022学年高二上学期开学考试化学试题安徽省六安市裕安区新安中学2022-2023学年高三上学期第三次月考化学试题(已下线)专题23 化学实验基础性选择题-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)第一部分 二轮专题突破 专题18 物质检验、鉴别简单实验方案的设计及评价第四章 非金属及其化合物 第24讲 常见气体的实验室制备、净化和收集(已下线)素养卷07 微型物质制备方案设计-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)(已下线)专题07 无机物的转化 微型工艺流程-2023年高考化学真题题源解密(全国通用)(已下线)微专题 常见气体的实验室制备、净化和收集(已下线)考点44 化学实验基础(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第3讲 物质制备实验的设计与评价黑龙江省大庆市肇州县第二中学2023-2024学年高三上学期11月月考化学试题
10 . 设 NA 表示阿伏加德罗常数的值,下列说法正确的是
| A.标准状况下,22.4L CCl4中含有的分子数为NA |
| B.1L 0.5 mol/LNa2SO4溶液中,含有的氧原子总数为2NA |
C.0.5 mol/LFe2(SO4)3 溶液中, 的数目为 1.5 NA 的数目为 1.5 NA |
| D.NO2和N2O4的混合物 ag,所含原子总数为3aNA/46 |
您最近一年使用:0次
2020-12-28更新
|
107次组卷
|
2卷引用:甘肃省天水市第三中学2020-2021学年高一上学期期中考试化学试题



