19-20高一·浙江·期中
名校
1 . 下列说法不正确的是
| A.某硝酸密度为1.42g·cm-3,质量分数为63%,此硝酸物质的量浓度为14.2 mol·L-1 |
| B.100 g浓度为c mol·L-1 的硫酸中加入一定的水稀释成0.5c mol·L-1, 则加入水的体积大于100 mL(已知硫酸的浓度越大,其密度越大) |
| C.将a%的氨水和(100-a)%的氨水等体积混合后,所得溶液的质量分数可能为小于或等于50%(已知氨水的浓度越大,其密度越小) |
D.VLAl2(SO4)3溶液中含Al3+mg,则溶液中 的物质的量浓度为 的物质的量浓度为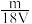 mol·L-1 mol·L-1 |
您最近一年使用:0次
2020-12-16更新
|
2356次组卷
|
4卷引用:湖南省邵阳市第二中学2023-2024学年高一上学期基础知识竞赛化学试题
12-13高一上·黑龙江大庆·期末
名校
解题方法
2 . 将2molNaHCO3和一定量(不为0)的Na2O2固体混合,在加热条件下让其充分反应,150℃下所得气体仅含2种组分,则反应后固体的物质的量n(mol)的取值范围是
| A.n=1 | B.1<n<2 | C.2≤n<4 | D.n≥4 |
您最近一年使用:0次
2022-09-22更新
|
1085次组卷
|
6卷引用:湖南省邵阳市第二中学2023-2024学年高一上学期基础知识竞赛化学试题
名校
3 . 现有 的
的 ,将其加热并发生反应,并检测放出的气体1的质量,后向剩余固体a中加入足量的浓盐酸,并检测放出的气体2的质量。(已知,+4价的
,将其加热并发生反应,并检测放出的气体1的质量,后向剩余固体a中加入足量的浓盐酸,并检测放出的气体2的质量。(已知,+4价的 能和浓盐酸反应放出
能和浓盐酸反应放出 。
。 受热可分解为
受热可分解为 的+4、+2价的混合氧化物并放出
的+4、+2价的混合氧化物并放出 )。则下列说法中正确的是
)。则下列说法中正确的是
 的
的 ,将其加热并发生反应,并检测放出的气体1的质量,后向剩余固体a中加入足量的浓盐酸,并检测放出的气体2的质量。(已知,+4价的
,将其加热并发生反应,并检测放出的气体1的质量,后向剩余固体a中加入足量的浓盐酸,并检测放出的气体2的质量。(已知,+4价的 能和浓盐酸反应放出
能和浓盐酸反应放出 。
。 受热可分解为
受热可分解为 的+4、+2价的混合氧化物并放出
的+4、+2价的混合氧化物并放出 )。则下列说法中正确的是
)。则下列说法中正确的是A.气体1的物质的量最多为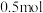 |
B.若物质的量,气体 气体 气体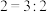 ,则固体的成分为物质的量之比可能为 ,则固体的成分为物质的量之比可能为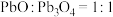 |
C.若物质的量,气体 气体 气体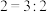 ,则固体a的成分为物质的量之比可能为 ,则固体a的成分为物质的量之比可能为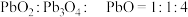 |
D.气体总物质的量可能为 |
您最近一年使用:0次
2022-08-17更新
|
479次组卷
|
2卷引用:湖南省邵阳市第二中学2022-2023学年高三上学期第三次月考化学试题
名校
4 . 向59.2 g Fe2O3和FeO的混合物中加入某浓度的稀硝酸1.0 L,固体物质完全反应,生成NO和Fe(NO3)3。在所得溶液中加入1.0 mol/L的NaOH溶液2.8 L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为85.6 g。下列有关说法错误的是
| A.Fe2O3与FeO的物质的量之比为1∶6 |
| B.硝酸的物质的量浓度为3.0 mol/L |
| C.产生的NO在标准状况下的体积为4.48 L |
| D.Fe2O3,FeO与硝酸反应后剩余HNO3为0.2 mol |
您最近一年使用:0次
2016-11-17更新
|
3612次组卷
|
21卷引用:湖南省邵阳市第二中学2021-2022学年高一下学期期中考试化学试题
湖南省邵阳市第二中学2021-2022学年高一下学期期中考试化学试题湖南省邵东市第一中学2021-2022学年高一下学期第三次月考化学试题2016届辽宁省沈阳市第二中学高三10月月考化学试卷2016届湖南省衡阳市第八中学高三上学期第三次月考化学试卷2017届湖南省衡阳八中高三上学期9月月考化学试卷2017届辽宁省瓦房店市高级中学高三上10月月考化学试卷四川省眉山中学2018届高三10月月考理科综合化学试题甘肃省天水市第一中学2017-2018学年度上学期高三第三阶段考试化学试题甘肃省天水市一中2018届高三上学期第三学段考试化学试题云南省玉溪第一中学2017-2018学年高一下学期4月月考化学试题云南省玉溪市玉溪一中2017-2018学年高一下学期4月月考化学试题(已下线)《2018,我的高考我的教师君》-【临考技能篇】速解高考题——高考化学题型分类技巧指导(已下线)解密03 氧化还原反应——备战2018年高考化学之高频考点解密四川省广安市第二中学2019届高三上学期第一次月考化学试题(已下线)考点05 氧化还原反应——备战2019年浙江新高考化学考点(已下线)2019年1月16日 《每日一题》高考二轮复习-铁及其化合物湖南省长沙市雅礼中学2020-2021学年高一下学期期中考试化学试题浙江省台州市书生中学2021-2022学年高一下学期阶段性测试(3月)化学试题辽宁省实验中学2022-2023学年高三上学期期中考试化学试题江西省宜春市丰城拖船中学2023-2024学年高三上学期11月期中化学试题河南省周口市太康县第一高级中学2023-2024学年高一下学期4月第三次月考化学试题
名校
解题方法
5 . 固体盐X由四种常见元素组成,其中仅含一种金属元素,有如图转化关系:
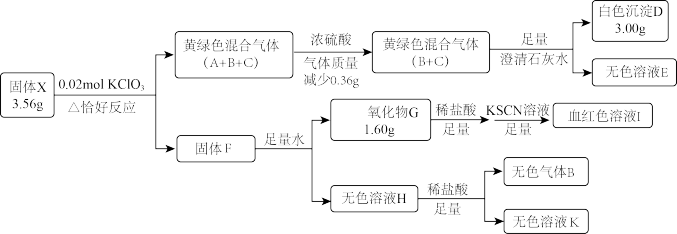
已知:H中溶质仅为一种常见正盐。黄绿色气体C密度为相同条件下H2的33.75倍。
请回答:
(1)X的组成元素为_______ ,固体F成分为_______ 。
(2)固体X在水中也可反应生成气体B,同时生成一种的相对较稳定的白色沉淀,请写出该反应化学方程式_______ 。
(3)气体C的化学式为_______ 。将气体C通入KOH溶液,微热,恰好完全反应,生成两种物质的量之比1∶5的盐,写出这两种盐的化学式_______ ,设计定量实验方案验证上述比例关系_______ 。(已知AgClO3溶于水,NaNO2能将ClO3-还原为Cl-)

已知:H中溶质仅为一种常见正盐。黄绿色气体C密度为相同条件下H2的33.75倍。
请回答:
(1)X的组成元素为
(2)固体X在水中也可反应生成气体B,同时生成一种的相对较稳定的白色沉淀,请写出该反应化学方程式
(3)气体C的化学式为
您最近一年使用:0次
解题方法
6 . 工业上用某矿渣(含有 )提取铜的操作流程如下:
)提取铜的操作流程如下:

已知: 。
。
回答下列问题:
(1)操作I的名称为___________ ;灼烧操作中常用的实验仪器有酒精灯、三脚架,还有___________ (夹持仪器不写)。
(2)固体混合物B的主要成分为___________ (写化学式);滤液A中铁元素的存在形式只能为 ,理由是
,理由是___________ (用离子方程式解释)。检验滤液A中 的试剂为
的试剂为___________ (填试剂名称)。
(3)滤液C中铝元素的主要存在形式为___________ (填离子符号),写出生成该离子的离子方程式:___________ 。
(4)某同学认为滤液 的水解程度是微弱的,
的水解程度是微弱的,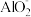 的水解不超过总量的10%,请设计实验验证该同学的观点是否正确:
的水解不超过总量的10%,请设计实验验证该同学的观点是否正确:___________ (所用材料: 试纸、
试纸、 的
的 溶液)。
溶液)。
(5)从浓硫酸、浓硝酸、蒸馏水中选用合适的试剂,测定粗铜样品中金属铜的质量分数,主要步骤:称取一定质量的样品→___________ (填缺少的操作步骤,不必描述操作过程的细节)→过滤、洗涤、干燥→称量剩余固体铜的质量。
 )提取铜的操作流程如下:
)提取铜的操作流程如下:
已知:
 。
。回答下列问题:
(1)操作I的名称为
(2)固体混合物B的主要成分为
 ,理由是
,理由是 的试剂为
的试剂为(3)滤液C中铝元素的主要存在形式为
(4)某同学认为滤液
 的水解程度是微弱的,
的水解程度是微弱的,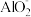 的水解不超过总量的10%,请设计实验验证该同学的观点是否正确:
的水解不超过总量的10%,请设计实验验证该同学的观点是否正确: 试纸、
试纸、 的
的 溶液)。
溶液)。(5)从浓硫酸、浓硝酸、蒸馏水中选用合适的试剂,测定粗铜样品中金属铜的质量分数,主要步骤:称取一定质量的样品→
您最近一年使用:0次
2022-10-13更新
|
281次组卷
|
2卷引用:湖南省邵阳市部分校2022-2023学年高三上学期第一次联考化学试题
名校
7 . 从某含有FeCl2、FeCl3、CuCl2的工业废液中回收铜并制备氯化铁晶体的流程如下:
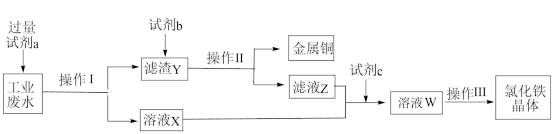
则下列说法正确的是

则下列说法正确的是
| A.试剂a是铁、试剂b是稀盐酸 |
| B.操作Ⅰ、操作Ⅱ、操作Ⅲ所用仪器相同 |
| C.用KMnO4酸性溶液可检验溶液W中是否含有Fe2+ |
| D.试剂c是氯气,相应的反应为2Fe2++Cl2=2Fe3++2Cl- |
您最近一年使用:0次
2022-01-20更新
|
215次组卷
|
2卷引用:湖南省邵阳市新邵县2021-2022学年高一上学期期末质量检测化学试题
8 . SO2气体与足量Fe2(SO4)3溶液完全反应后,再加入K2Cr2O7溶液,发生如下化学反应:①SO2+2Fe3++2H2O=SO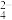 +2Fe2++4H+;②Cr2O
+2Fe2++4H+;②Cr2O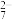 +6Fe2++14H+=2Cr3++6Fe3++7H2O。则下列有关说法不正确的是
+6Fe2++14H+=2Cr3++6Fe3++7H2O。则下列有关说法不正确的是
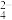 +2Fe2++4H+;②Cr2O
+2Fe2++4H+;②Cr2O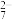 +6Fe2++14H+=2Cr3++6Fe3++7H2O。则下列有关说法不正确的是
+6Fe2++14H+=2Cr3++6Fe3++7H2O。则下列有关说法不正确的是A.氧化性:Cr2O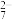 >Fe3+ >Fe3+ |
| B.标准状况下,若有6.72LSO2参加反应,则最终消耗0.2molK2Cr2O7 |
| C.反应②中,每有1molK2Cr2O7参加反应,转移电子的数目为6NA |
D.由上述反应原理推断:K2Cr2O7溶液也可以将SO2氧化成SO |
您最近一年使用:0次
2021-01-27更新
|
500次组卷
|
7卷引用:湖南省邵阳市隆回县2021-2022学年高一下学期期末考试化学试题
名校
解题方法
9 . 某品牌糖衣片补血剂,除去糖衣后显淡蓝绿色,主要成分是硫酸亚铁,不含其它铁的化合物。某研究性学习小组为测定该补血剂中硫酸亚铁的含量进行了以下探究:
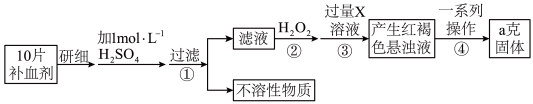
请回答下列问题:
Ⅰ、
(1)实验时用 的浓硫酸,配制100mL
的浓硫酸,配制100mL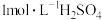 溶液,所需浓硫酸的体积为
溶液,所需浓硫酸的体积为___________ mL(计算结果精确到小数点后一位)。
(2)下列操作中,容量瓶所具备的功能有___________(填序号)。
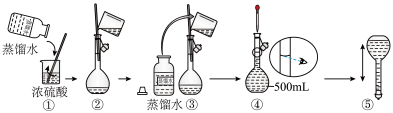
(3)在下列配制过程示意图中,有错误的是(填写序号)___________ 。
(4)下列说法正确的___________。
Ⅱ、
(5)步骤②加入过量 的目的:
的目的:___________ 。发生反应的离子方程式为:___________ 。
(6)从红褐色的悬浊液到最后的称量,其过程中所需的基本操作为:
a、___________ ,b、洗涤,c、灼烧,d、冷却
(7)若称得固体的质量为ag,则每片补血剂中含硫酸亚铁的质量为___________ g。

请回答下列问题:
Ⅰ、
(1)实验时用
 的浓硫酸,配制100mL
的浓硫酸,配制100mL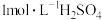 溶液,所需浓硫酸的体积为
溶液,所需浓硫酸的体积为(2)下列操作中,容量瓶所具备的功能有___________(填序号)。
| A.配制一定体积准确浓度的标准溶液 | B.长期贮存溶液 |
| C.用来溶解固体溶质 | D.常用来代替量筒量取一定体积的液体 |

(4)下列说法正确的___________。
| A.洗涤烧杯2~3次,并将洗涤液移入容量瓶以减少误差 |
| B.某同学将浓硫酸稀释后未冷却至室温便将溶液转移至容量瓶,所配溶液浓度会偏低 |
| C.定容时仰视观察,所配溶液浓度会偏低 |
| D.容量瓶使用前先要检查是否漏液,具体操作是向容量瓶中加蒸馏水,倒置不漏液即可 |
Ⅱ、
(5)步骤②加入过量
 的目的:
的目的:(6)从红褐色的悬浊液到最后的称量,其过程中所需的基本操作为:
a、
(7)若称得固体的质量为ag,则每片补血剂中含硫酸亚铁的质量为
您最近一年使用:0次
2023-01-10更新
|
195次组卷
|
3卷引用:湖南省邵阳市第二中学2023-2024学年高一上学期第二次月考化学试题
10 . 下图所涉及的物质均为中学化学中的常见物质,其中C、D为非金属单质,E为人类使用量最大的一种金属单质,其余为化合物,它们存在如下转化关系,反应中生成的水及次要产物均已略去。
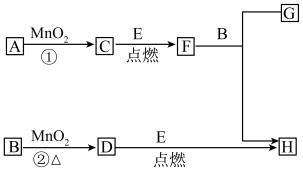
(1)写出有关物质的化学式:F___________ 、H___________ 、B___________ 。
(2)若反应①是在加热条件下进行,则A是___________ ;A在反应①中是___________ 剂。
(3)写出B与MnO2共热获得D的化学方程式___________ 。
(4)新配置的G溶液应加入___________ ,以防止其转化为H,检验G溶液中阳离子的常用试剂是___________ ,实验现象为___________ 。

(1)写出有关物质的化学式:F
(2)若反应①是在加热条件下进行,则A是
(3)写出B与MnO2共热获得D的化学方程式
(4)新配置的G溶液应加入
您最近一年使用:0次



