1 . 如图是利用“手持”技术测定阳光照射不同气体温度变化曲线,其中四个容器均密闭、体积相等且初始压强均为101 kPa。
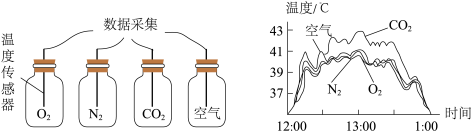
| A.实验开始时,四种气体密度相同 |
| B.若容器的容积为22.4 L,13:00时N2原子个数少于2NA |
| C.12:30-13:30时间范围内CO2压强最大 |
| D.CO2是四种气体中温室效应最显著的 |
您最近一年使用:0次
2023-07-25更新
|
436次组卷
|
15卷引用:上海市七宝中学2023-2024学年高一上学期10月月考化学试题
上海市七宝中学2023-2024学年高一上学期10月月考化学试题辽宁省五校联考2022-2023学年高一上学期期末考试化学试题(已下线)第10讲 气体摩尔体积-【暑假自学课】2023年新高一化学暑假精品课(人教版2019必修第一册)(已下线)【知识图鉴】单元讲练测必修第一册第二单元01讲核心湖南省株洲市炎陵县2022-2023学年高一下学期3月月考化学试题福建省福州第三中学2023-2024学年高一上学期10月月考化学试题辽宁省东北育才学校科学高中部2023-2024学年高一上学期第一次月考化学试题 四川省成都市树德中学2023-2024学年高一上学期11月期中考试化学试题(已下线)【定心卷】2.3.2 气体摩尔体积随堂练习-人教版2023-2024学年必修第一册福建省莆田第一中学2023-2024学年高一上学期期中考试化学试题福建省莆田第二中学2023-2024学年高一上学期12月阶段测试化学试题四川省绵阳南山中学实验学校2023-2024学年高一上学期12月月考化学试题福建省泉州科技中学2023-2024学年高一上学期期中考试化学试题四川省德阳市什邡中学2023-2024学年高一上学期1月期末化学试题(已下线)综合突破01 期末压轴80题之选择题-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(辽宁专用)
名校
解题方法
2 . Q、R、X、Y、Z是原子序数依次增大的五种短周期元素,在短周期的所有元素中Q的原子半径与Z的原子半径之比最小(不包括稀有气体),R、X、Y三种元素的原子核外电子层数相同,同一周期中R的一种共价晶体单质的熔点最高,Y与Q、R、X、Z均能形成多种常见化合物。
(1)X在周期表中的位置:_____ ,这五种元素中,最外层有两对孤对电子的元素是_____ (用名称表示)。
(2)RQ2Y的电子式是_____ ,其空间构型为_____ ;
(3)Q与R两元素原子1:1组成的两种常见分子,常温下,其化学性质差异甚大,请解释其化学性质差异甚大的原因_____ 。
(4)常温下液态化合物甲只含上述元素中的两种,分子中原子个数比1:1,新冠疫情发生后,购买的消毒液中的一种就是用这种物质与乙酸反应的产物,它具有很好的杀菌消毒功效,请写出产物的结构简式_____ 。甲是一种绿色氧化剂,在稀酸条件下,甲可将 氧化,写出甲发生还原反应的半反应式
氧化,写出甲发生还原反应的半反应式_____ 。
(1)X在周期表中的位置:
(2)RQ2Y的电子式是
(3)Q与R两元素原子1:1组成的两种常见分子,常温下,其化学性质差异甚大,请解释其化学性质差异甚大的原因
(4)常温下液态化合物甲只含上述元素中的两种,分子中原子个数比1:1,新冠疫情发生后,购买的消毒液中的一种就是用这种物质与乙酸反应的产物,它具有很好的杀菌消毒功效,请写出产物的结构简式
 氧化,写出甲发生还原反应的半反应式
氧化,写出甲发生还原反应的半反应式
您最近一年使用:0次
名校
解题方法
3 . 利用 制备氧钒碱式碳酸铵晶体{[(NH4)5(CO3)4(OH)9]·10H2O}的工艺流程如下:
制备氧钒碱式碳酸铵晶体{[(NH4)5(CO3)4(OH)9]·10H2O}的工艺流程如下:
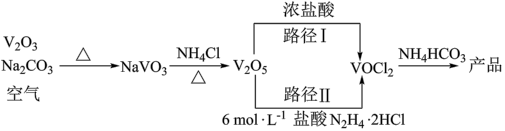
已知:+4价钒在弱酸性环境中具有还原性。下列说法正确的是
 制备氧钒碱式碳酸铵晶体{[(NH4)5(CO3)4(OH)9]·10H2O}的工艺流程如下:
制备氧钒碱式碳酸铵晶体{[(NH4)5(CO3)4(OH)9]·10H2O}的工艺流程如下:
已知:+4价钒在弱酸性环境中具有还原性。下列说法正确的是
A. 制备 制备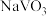 过程中,氧化剂与还原剂物质的量之比为1:2 过程中,氧化剂与还原剂物质的量之比为1:2 |
B.生成 的反应为2NaVO3+2NH4Cl 的反应为2NaVO3+2NH4Cl 2NaCl+V2O5+2NH3·H2O 2NaCl+V2O5+2NH3·H2O |
C.由 制备VOCl2的两种路径,路径I更符合绿色化学思想 制备VOCl2的两种路径,路径I更符合绿色化学思想 |
| D.路径Ⅱ中若盐酸浓度过低,可能生成副产物VO2Cl |
您最近一年使用:0次
名校
解题方法
4 . 下列反应的离子方程式正确的是
A.把金属铁放入稀硫酸中: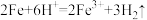 |
B.向 溶液中加入足量的氢氧化钠溶液: 溶液中加入足量的氢氧化钠溶液: |
C.向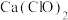 溶液中通入少量二氧化硫: 溶液中通入少量二氧化硫: |
D.向Ba(OH)2溶液中滴加足量的 稀溶液: 稀溶液: |
您最近一年使用:0次
解题方法
5 . 某兴趣小组同学制定如下三个方案对含有NaCl杂质的碳酸氢钠的含量进行测定:
方案一:用图装置测定样品与足量稀硫酸反应生成 的体积。
的体积。

(1)为了减小实验误差,量气管中液体M的选择原则是___________ 。
(2)若实验测得样品中小苏打含量低于样品实际含量,可能的原因是___________。
方案二:测定上述样品中碳酸氢钠的质量分数还可通过图装置进行测定。

(3)实验需使用的定量仪器是___________ ;写出涉及的化学方程式___________ 。
方案三:通过以下流程测定样品的含量。

(4)操作Ⅰ的名称为___________ ,根据以上实验过程,含有氯化钠的碳酸氢钠样品中碳酸氢钠的质量分数可表示为:___________ 。(样品为m1g,恒重后固体质量为m2g)
方案一:用图装置测定样品与足量稀硫酸反应生成
 的体积。
的体积。
(1)为了减小实验误差,量气管中液体M的选择原则是
(2)若实验测得样品中小苏打含量低于样品实际含量,可能的原因是___________。
A. 气体中含有水蒸气 气体中含有水蒸气 |
| B.测定气体体积时来冷却至室温 |
| C.Y型管中留有反应生成的气体 |
| D.测定气体体积时水准管的液面高于量气管的液面 |
方案二:测定上述样品中碳酸氢钠的质量分数还可通过图装置进行测定。

(3)实验需使用的定量仪器是
方案三:通过以下流程测定样品的含量。

(4)操作Ⅰ的名称为
您最近一年使用:0次
6 . 为了使宇航员在飞船中得到一个稳定的、良好的生存环境,一般在飞船内安装盛有 颗粒的装置,它的用途是产生氧气。
颗粒的装置,它的用途是产生氧气。
(1)下列各组物质相互作用,生成物不随反应条件或反应物的用量变化而变化的是___________。
(2)写出 的电子式
的电子式___________ ,其晶体中存在的化学键类型是___________ 。
(3)下列关于 的叙述正确的是___________。
的叙述正确的是___________。
(4) 可用氢氧化钠溶液吸收,若将0.01mol的
可用氢氧化钠溶液吸收,若将0.01mol的 通入0.03mol的氢氧化钠溶液中,充分反应后,溶液中的溶质为
通入0.03mol的氢氧化钠溶液中,充分反应后,溶液中的溶质为___________ (写化学式)
(5)向(4)中反应后的溶液中逐滴加入0.1mol/L的盐酸,并及时振荡,以下哪张图符合产生的气体体积 与加入盐酸的体积
与加入盐酸的体积 的关系(其中B、C、D图中分别有
的关系(其中B、C、D图中分别有 、
、 、
、 )___________
)___________
 颗粒的装置,它的用途是产生氧气。
颗粒的装置,它的用途是产生氧气。(1)下列各组物质相互作用,生成物不随反应条件或反应物的用量变化而变化的是___________。
A.Na和 | B.NaOH和 | C. 和NaOH 和NaOH | D. 和HCl 和HCl |
 的电子式
的电子式(3)下列关于
 的叙述正确的是___________。
的叙述正确的是___________。A. 中正、负离子的个数比为1∶1 中正、负离子的个数比为1∶1 |
B. 分别与水及 分别与水及 反应产生相同量的 反应产生相同量的 时,需要水和 时,需要水和 的质量相等 的质量相等 |
C. 分别与水及 分别与水及 反应产生相同量的 反应产生相同量的 时,转移电子的物质的量相等 时,转移电子的物质的量相等 |
D. 的漂白原理与 的漂白原理与 的漂白原理相同 的漂白原理相同 |
 可用氢氧化钠溶液吸收,若将0.01mol的
可用氢氧化钠溶液吸收,若将0.01mol的 通入0.03mol的氢氧化钠溶液中,充分反应后,溶液中的溶质为
通入0.03mol的氢氧化钠溶液中,充分反应后,溶液中的溶质为(5)向(4)中反应后的溶液中逐滴加入0.1mol/L的盐酸,并及时振荡,以下哪张图符合产生的气体体积
 与加入盐酸的体积
与加入盐酸的体积 的关系(其中B、C、D图中分别有
的关系(其中B、C、D图中分别有 、
、 、
、 )___________
)___________A. | B. |
C. | D. |
您最近一年使用:0次
解题方法
7 . 从宏观和微观两个角度认识元素的单质及其化合物是学好中学化学的重要基础。
(1)组成 的三种元素,其对应的简单离子半径由小到大的顺序为
的三种元素,其对应的简单离子半径由小到大的顺序为___________ 。
(2) 、
、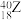 、
、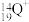 、
、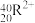 、
、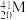 5种微粒,所属元素的种类有
5种微粒,所属元素的种类有___________ 种
(3)下列各组物质中,含有化学键类型都相同的是___________。
(4)将HCl和NaCl分别溶于水。下列说法正确的是___________。
(5)能用于比较Cl与S非金属性强弱的依据是___________。
(1)组成
 的三种元素,其对应的简单离子半径由小到大的顺序为
的三种元素,其对应的简单离子半径由小到大的顺序为(2)
 、
、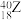 、
、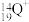 、
、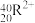 、
、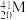 5种微粒,所属元素的种类有
5种微粒,所属元素的种类有(3)下列各组物质中,含有化学键类型都相同的是___________。
| A.HI和NaCl | B.NaF和KOH | C.CO和HCl | D. 和NaBr 和NaBr |
| A.HCl的离子键被破坏 | B.NaCl的共价键被破坏 |
| C.HCl和NaCl的化学键均遭破坏 | D.HCl和NaCl的化学键均未遭破坏 |
| A.熔沸点:硫单质>氯单质 | B.酸性: |
C.热稳定性: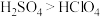 | D.氧化性: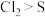 |
您最近一年使用:0次
8 . 元素周期表对化学的发展有很大影响,在材料、能源、环境和生命科学研究上发挥着越来越重要的作用。下表是元素周期表的一部分。

(1)元素g在周期表中的位置可表示为___________。
(2)a-h元素的最高价氧化物X应的水化物中,酸性最强的酸是___________ (填化学式)。
(3)b元素有三种稳定核素,其式量分别为16、17、18,则三种核素的中子数之比为______ 。
(4)c、g、h三种元素形成的气态氢化物中,稳定性最小的物质的结构式是___________ 。
(5)d元素的简单离子的结构示意图为___________ 。
(6)工业上冶炼f单质的化学方程式为___________ 。
(7)若d单质着火,可用于灭火的物质是___________。
(8)下列关于元素周期表的叙述正确的是___________。

(1)元素g在周期表中的位置可表示为___________。
| A.第三周期第6族 | B.第一周期VI主族 |
| C.第三周期第6A族 | D.第三周期VIA族 |
(3)b元素有三种稳定核素,其式量分别为16、17、18,则三种核素的中子数之比为
(4)c、g、h三种元素形成的气态氢化物中,稳定性最小的物质的结构式是
(5)d元素的简单离子的结构示意图为
(6)工业上冶炼f单质的化学方程式为
(7)若d单质着火,可用于灭火的物质是___________。
| A.自来水 | B. | C.干沙子 | D.湿抹布 |
| A.元素周期表中所含元素最多的族是ⅦB族 |
| B.ⅠA族的元素全部是金属元素 |
| C.在元素周期表中金属与非金属的分界处可以找到半导体材料 |
| D.只有ⅡA族元素的原子最外层有2个电子 |
您最近一年使用:0次
解题方法
9 . 以下是测定 中结晶水含量的实验流程:
中结晶水含量的实验流程:
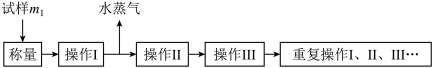
(1) 应放在
应放在___________ (填仪器名称)中加热。
(2)重复操作Ⅰ、Ⅱ、Ⅲ这叫___________ 操作,目的是___________ 。
(3)操作Ⅱ必须要在___________ (填仪器名称)中进行,原因是___________ 。
(4)完成下列表格中数据处理:(保留两位有效数字)
第一次实验: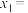
___________ ,第二次实验: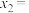
___________ 。两次所测x的平均值为___________ 。
 中结晶水含量的实验流程:
中结晶水含量的实验流程:
(1)
 应放在
应放在(2)重复操作Ⅰ、Ⅱ、Ⅲ这叫
(3)操作Ⅱ必须要在
(4)完成下列表格中数据处理:(保留两位有效数字)
| 第一次实验 | 第二次实验 | |
| 坩埚的质量(g) | 14.520 | 14.670 |
| 坩埚+试样的质量(g) | 17.020 | 18.350 |
| 恒重后,坩埚+硫酸铜的质量(g) | 16.070 | 17.004 |
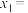
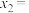
您最近一年使用:0次
解题方法
10 . 实验是学习化学的一种重要方法,某学习小组研究碳酸钠的性质进行以下实验:
(1)欲检验Na2CO3中存在钠元素,可使用的方法_______。(选填编号)
(2)若用无水碳酸钠来配制100mL 0.400mol/L的Na2CO3溶液,需在_______ (填仪器名称)上称取_______ g无水碳酸钠。
(3)配制上述溶液用到的“容量瓶”是_______ 。(选填编号)
(4)定容操作时:沿着玻璃棒向容量瓶中加水至_______ 处,改用胶头滴管继续滴加水至凹液面最低处与刻度线相平,盖好瓶塞,颠倒摇匀。
(5)在溶液配制过程中,下列情况会使所配溶液浓度偏高的是_______。(选填编号)
为研究Na2CO3溶液和盐酸的反应过程,某学生使用传感器进行如下实验(装置如图1):
实验(1):向反应器中加入20mL0.4mol/L的Na2CO3溶液,逐滴滴加40mL 0.4mol/L的盐酸溶液。
实验(2):向反应器中加入XmLYmol/L NaHCO3溶液,逐滴滴加一定体积的0.4mol/L的盐酸溶液。实验数据如图2:

实验分析与解释:
(6)仪器a的名称是_______ 。
(7)实验(1)中,当碳酸钠溶液与盐酸开始发生反应,压力传感器前60s采集的数据如图所示,结合离子方程式表述其原因是_______ 。
(8)实验(2)为实验(1)的对照实验,根据图2信息,反应器中加入XmLYmol/L NaHCO3溶液,其体积和浓度对应数值最合适的是_______。
(1)欲检验Na2CO3中存在钠元素,可使用的方法_______。(选填编号)
| A.沉淀法 | B.显色法 | C.焰色反应 | D.气体法 |
(3)配制上述溶液用到的“容量瓶”是
 | 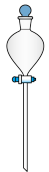 | 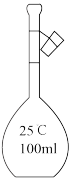 | 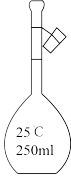 |
| A | B | C | D |
(5)在溶液配制过程中,下列情况会使所配溶液浓度偏高的是_______。(选填编号)
| A.容量瓶在使用前未干燥,里面有少量蒸馏水 |
| B.溶解固体后的溶液未冷却至室温就移入容量瓶中定容 |
| C.转移时不小心有溶液溅出瓶外 |
| D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理 |
为研究Na2CO3溶液和盐酸的反应过程,某学生使用传感器进行如下实验(装置如图1):
实验(1):向反应器中加入20mL0.4mol/L的Na2CO3溶液,逐滴滴加40mL 0.4mol/L的盐酸溶液。
实验(2):向反应器中加入XmLYmol/L NaHCO3溶液,逐滴滴加一定体积的0.4mol/L的盐酸溶液。实验数据如图2:

实验分析与解释:
(6)仪器a的名称是
(7)实验(1)中,当碳酸钠溶液与盐酸开始发生反应,压力传感器前60s采集的数据如图所示,结合离子方程式表述其原因是
(8)实验(2)为实验(1)的对照实验,根据图2信息,反应器中加入XmLYmol/L NaHCO3溶液,其体积和浓度对应数值最合适的是_______。
| A.40、0.2 | B.20、0.4 | C.20、0.2 | D.40、0.4 |
您最近一年使用:0次



