名校
解题方法
1 . 实验小组探究溶液酸碱性对锰化合物和 ,氧化还原反应的影响。
,氧化还原反应的影响。
资料:i. 呈绿色,
呈绿色, 为棕黑色沉淀,
为棕黑色沉淀, 几乎无色。
几乎无色。
ii. 在强碱性溶液中能稳定存在,在酸性、中性或弱碱性溶液中易转化为
在强碱性溶液中能稳定存在,在酸性、中性或弱碱性溶液中易转化为 和
和 。
。
iii. 为微溶物。
为微溶物。
(1)用离子方程式解释实验I中出现乳白色浑浊的原因________________________ 。
(2)已知,实验I、II、III中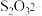 均被氧化为
均被氧化为 ,针对实验I、II、III进行分析:
,针对实验I、II、III进行分析:
①对于 氧化性的认识是
氧化性的认识是____________ 。
②实验Ⅱ所得溶液中 的检验方法为
的检验方法为________________________ 。
(3)针对实验Ⅲ、Ⅳ进行分析:
①实验Ⅲ中“溶液变为绿色”相应反应的离子方程式为____________ 。
②实验IV中“静置5min,有棕黑色沉淀生成”的可能原因:____________ (写出2点)。
(4)针对实验Ⅲ、Ⅳ继续探究:
①实验V:向实验III的试管中继续滴加足量 ,振荡,溶液立即变为紫红色,产生棕黑色沉淀。
,振荡,溶液立即变为紫红色,产生棕黑色沉淀。
②实验VI:向实验IV的试管中继续滴加足量 ,振荡,绿色溶液迅速变为无色,棕黑色沉淀逐渐减少直至消失,静置一段时间后,出现乳白色浑浊。
,振荡,绿色溶液迅速变为无色,棕黑色沉淀逐渐减少直至消失,静置一段时间后,出现乳白色浑浊。
对比实验V、VI,结合方程式分析实验VI滴加 后溶液未见紫红色的可能原因
后溶液未见紫红色的可能原因____________ 。
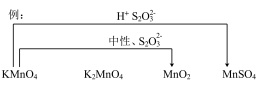
(5)综合上述实验,在下图中用连线的方式补充完善实验I~VI已证实的锰化合物转化关系_____________ 。
 ,氧化还原反应的影响。
,氧化还原反应的影响。资料:i.
 呈绿色,
呈绿色, 为棕黑色沉淀,
为棕黑色沉淀, 几乎无色。
几乎无色。ii.
 在强碱性溶液中能稳定存在,在酸性、中性或弱碱性溶液中易转化为
在强碱性溶液中能稳定存在,在酸性、中性或弱碱性溶液中易转化为 和
和 。
。iii.
 为微溶物。
为微溶物。实验 | 序号 | 试剂 | 现象 |
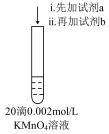
| I | a:10滴 溶液 溶液b:20滴 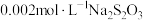 溶液 溶液 | 溶液紫色变浅至接近无色,静置一段时间后出现乳白色浑浊 |
II | a:10滴蒸馏水 b:20滴 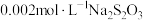 溶液 溶液 | 紫色溶液逐渐褪色,产生棕黑色沉淀 | |
III | a:10滴 溶液 溶液b:2滴 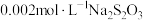 溶液和18滴蒸馏水 溶液和18滴蒸馏水 | 溶液变为绿色,无沉淀生成;静置5min,未见明显变化 | |
IV | a:10滴 溶液 溶液b:20滴 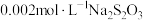 溶液 溶液 | 溶液变为绿色,无沉淀生成;静置5min,绿色变浅,有棕黑色沉淀生成 |
(1)用离子方程式解释实验I中出现乳白色浑浊的原因
(2)已知,实验I、II、III中
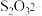 均被氧化为
均被氧化为 ,针对实验I、II、III进行分析:
,针对实验I、II、III进行分析:①对于
 氧化性的认识是
氧化性的认识是②实验Ⅱ所得溶液中
 的检验方法为
的检验方法为(3)针对实验Ⅲ、Ⅳ进行分析:
①实验Ⅲ中“溶液变为绿色”相应反应的离子方程式为
②实验IV中“静置5min,有棕黑色沉淀生成”的可能原因:
(4)针对实验Ⅲ、Ⅳ继续探究:
①实验V:向实验III的试管中继续滴加足量
 ,振荡,溶液立即变为紫红色,产生棕黑色沉淀。
,振荡,溶液立即变为紫红色,产生棕黑色沉淀。②实验VI:向实验IV的试管中继续滴加足量
 ,振荡,绿色溶液迅速变为无色,棕黑色沉淀逐渐减少直至消失,静置一段时间后,出现乳白色浑浊。
,振荡,绿色溶液迅速变为无色,棕黑色沉淀逐渐减少直至消失,静置一段时间后,出现乳白色浑浊。对比实验V、VI,结合方程式分析实验VI滴加
 后溶液未见紫红色的可能原因
后溶液未见紫红色的可能原因(5)综合上述实验,在下图中用连线的方式补充完善实验I~VI已证实的锰化合物转化关系
您最近一年使用:0次
2024-02-29更新
|
269次组卷
|
2卷引用:北京市第一七一中学2023-2024学年高三下学期开学考试化学试题
名校
解题方法
2 . 氮及其化合物在工农业生产和生活中有着重要作用。有资料显示过量的氨气和氯气在常温下可合成 (岩脑砂的主要成分),某实验小组对该反应进行探究,并对岩脑砂进行元素测定,回答下列问题:
(岩脑砂的主要成分),某实验小组对该反应进行探究,并对岩脑砂进行元素测定,回答下列问题:
(1) 的制备:
的制备:

①利用装置B制取实验所需的氯气,写出该反应的化学方程式___________ 。
②装置C的名称为___________ 。
③为了使氨气和氯气在D中充分混合,请确定上述装置的合理连接顺序:___________ →fe←h←g←___________ (用小写字母和箭头表示,箭头方向与气流方向一致)。
④该实验装置除了D处导管易堵塞外,还存在的不足之处是___________ 。
⑤验证岩脑砂中所含 的操作为
的操作为___________ 。
(2)岩脑砂中元素的定量测定:准确称取 岩脑砂,与足量的氧化铜混合加热,发生的反应为
岩脑砂,与足量的氧化铜混合加热,发生的反应为 ,利用下列装置测定岩脑砂中氮元素和氯元素的质量之比(夹持装置省略)。
,利用下列装置测定岩脑砂中氮元素和氯元素的质量之比(夹持装置省略)。

①装置H中盛装的试剂是___________ (填试剂名称)。
②已知装置J中也装有碱石灰,其目的是___________ 。
③若装置I增重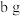 ,利用装置K测得气体体积为VL(已知常温常压下气体摩尔体积为
,利用装置K测得气体体积为VL(已知常温常压下气体摩尔体积为 ),则岩脑砂中
),则岩脑砂中
___________ (用含b、V的代数式表示,不必化简)。
 (岩脑砂的主要成分),某实验小组对该反应进行探究,并对岩脑砂进行元素测定,回答下列问题:
(岩脑砂的主要成分),某实验小组对该反应进行探究,并对岩脑砂进行元素测定,回答下列问题:(1)
 的制备:
的制备:
①利用装置B制取实验所需的氯气,写出该反应的化学方程式
②装置C的名称为
③为了使氨气和氯气在D中充分混合,请确定上述装置的合理连接顺序:
④该实验装置除了D处导管易堵塞外,还存在的不足之处是
⑤验证岩脑砂中所含
 的操作为
的操作为(2)岩脑砂中元素的定量测定:准确称取
 岩脑砂,与足量的氧化铜混合加热,发生的反应为
岩脑砂,与足量的氧化铜混合加热,发生的反应为 ,利用下列装置测定岩脑砂中氮元素和氯元素的质量之比(夹持装置省略)。
,利用下列装置测定岩脑砂中氮元素和氯元素的质量之比(夹持装置省略)。
①装置H中盛装的试剂是
②已知装置J中也装有碱石灰,其目的是
③若装置I增重
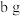 ,利用装置K测得气体体积为VL(已知常温常压下气体摩尔体积为
,利用装置K测得气体体积为VL(已知常温常压下气体摩尔体积为 ),则岩脑砂中
),则岩脑砂中
您最近一年使用:0次
名校
3 . “液态阳光”是利用太阳能等可再生能源将二氧化碳还原为可储存的甲醇( )等液态燃料,原理如图所示:
)等液态燃料,原理如图所示:

下列说法正确的是
 )等液态燃料,原理如图所示:
)等液态燃料,原理如图所示:
下列说法正确的是
| A.图中能量转化方式只有两种 |
| B.甲醇燃烧时化学能完全转化为热能 |
| C.甲醇燃烧不会产生CO,属于清洁能源 |
D.加快发展“液态阳光”可实现 资源化利用 资源化利用 |
您最近一年使用:0次
2023-09-06更新
|
53次组卷
|
2卷引用: 山西省孝义中学校2023-2024学年高二上学期开学考试化学试题
解题方法
4 . 海水中蕴藏着丰富的化学资源,经加工处理可制取钠、氯气和溴等化学物质。
(1)将金属钠放入液氨中,钠沉入液氨底部。其中一部分钠与液氨反应:2Na+2NH3=2NaNH2+H2↑,并缓慢放出气泡;另一部分钠与液氨溶剂化,生成氨合钠离子[Na+(NH3)6]和氨合电子[e-(NH3)6],钠的溶剂化过程如图所示。

①密度:ρ(Na)___________ ρ(液氨)(填“>”“=”或“<”)。
②将2.3g钠投入液氨中,得到0.224L(标准状况下)H2.与液氨反应产生H2的钠和发生溶剂化作用的钠,两者物质的量之比为___________ 。
(2)工业上可用Cl2和NaOH溶液反应生产“84”消毒液,“84”消毒液中含有ClO-和Cl-。
①Cl2和NaOH溶液反应生成ClO-和Cl-的化学方程式为___________ 。
②“84”消毒液使用时不能与洁厕剂(成分为盐酸)混用,原因是这两种溶液混合时,___________ (填离子符号)在酸性条件下会反应产生Cl2。
(3)提取粗盐后的母液中含较高浓度的溴元素。某课外兴趣小组先将母液中的溴元素氧化成Br2,再获取液溴,流程如下:

①“萃取”时,使用一定体积的有机萃取剂。为提高Br2的萃取率,应采取的措施为___________ 。萃取后静置,进行___________ (填操作名称),可得到溴的有机溶液。
②“反萃取”时,Br2与Na2CO3溶液反应生成NaBrO3与NaBr。该反应生成的BrO 与Br-物质的量之比为
与Br-物质的量之比为___________ 。
(1)将金属钠放入液氨中,钠沉入液氨底部。其中一部分钠与液氨反应:2Na+2NH3=2NaNH2+H2↑,并缓慢放出气泡;另一部分钠与液氨溶剂化,生成氨合钠离子[Na+(NH3)6]和氨合电子[e-(NH3)6],钠的溶剂化过程如图所示。

①密度:ρ(Na)
②将2.3g钠投入液氨中,得到0.224L(标准状况下)H2.与液氨反应产生H2的钠和发生溶剂化作用的钠,两者物质的量之比为
(2)工业上可用Cl2和NaOH溶液反应生产“84”消毒液,“84”消毒液中含有ClO-和Cl-。
①Cl2和NaOH溶液反应生成ClO-和Cl-的化学方程式为
②“84”消毒液使用时不能与洁厕剂(成分为盐酸)混用,原因是这两种溶液混合时,
(3)提取粗盐后的母液中含较高浓度的溴元素。某课外兴趣小组先将母液中的溴元素氧化成Br2,再获取液溴,流程如下:

①“萃取”时,使用一定体积的有机萃取剂。为提高Br2的萃取率,应采取的措施为
②“反萃取”时,Br2与Na2CO3溶液反应生成NaBrO3与NaBr。该反应生成的BrO
 与Br-物质的量之比为
与Br-物质的量之比为
您最近一年使用:0次
名校
解题方法
5 . 化学反应速率和限度与生产、生活密切相关。
(1)某温度下, 恒容密闭容器中,X、Y、Z三种物质的物质的量随反应时间的变化曲线如图所示。
恒容密闭容器中,X、Y、Z三种物质的物质的量随反应时间的变化曲线如图所示。 内,用
内,用 的浓度变化表示的平均反应速率为
的浓度变化表示的平均反应速率为_______ mol·L-1·min-1。
②该反应的化学方程式为_______ 。
③若 均为气体,在
均为气体,在 时,向容器中通入氩气(容器体积不变),
时,向容器中通入氩气(容器体积不变), 的反应速率将
的反应速率将_______ (填“变大”、“不变”或“变小”)。
④若 均为气体,下列能说明该反应达到平衡状态的是
均为气体,下列能说明该反应达到平衡状态的是_______ (填字母)。
a. 三种气体的浓度相等
三种气体的浓度相等
b.混合气体的质量不随时间变化
c.混合气体的密度不随时间变化
d.单位时间内消耗X和 的物质的量之比为
的物质的量之比为
(2)实验室用 溶液与
溶液与 溶液反应探究条件的改变对化学反应速率的影响,设计的实验方案如下表(已知
溶液反应探究条件的改变对化学反应速率的影响,设计的实验方案如下表(已知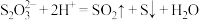 ):
):
①对比实验1和2可探究_______ 因素对化学反应速率的影响。
②对比实验1和3来探究浓度对化学反应速率的影响,则
_______ ,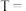
_______ 。
(1)某温度下,
 恒容密闭容器中,X、Y、Z三种物质的物质的量随反应时间的变化曲线如图所示。
恒容密闭容器中,X、Y、Z三种物质的物质的量随反应时间的变化曲线如图所示。
 内,用
内,用 的浓度变化表示的平均反应速率为
的浓度变化表示的平均反应速率为②该反应的化学方程式为
③若
 均为气体,在
均为气体,在 时,向容器中通入氩气(容器体积不变),
时,向容器中通入氩气(容器体积不变), 的反应速率将
的反应速率将④若
 均为气体,下列能说明该反应达到平衡状态的是
均为气体,下列能说明该反应达到平衡状态的是a.
 三种气体的浓度相等
三种气体的浓度相等b.混合气体的质量不随时间变化
c.混合气体的密度不随时间变化
d.单位时间内消耗X和
 的物质的量之比为
的物质的量之比为
(2)实验室用
 溶液与
溶液与 溶液反应探究条件的改变对化学反应速率的影响,设计的实验方案如下表(已知
溶液反应探究条件的改变对化学反应速率的影响,设计的实验方案如下表(已知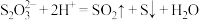 ):
):| 实验序号 | 体积/ | 温度/ | 溶液出现浑浊的时间/s | ||
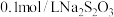 溶液 溶液 | 水 | 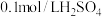 溶液 溶液 | |||
| 1 | 2.0 | 0.0 | 2.0 | 25 |  |
| 2 | 2.0 | 0.0 | 2.0 | 50 |  |
| 3 | 1.0 | V | 2.0 | T |  |
②对比实验1和3来探究浓度对化学反应速率的影响,则

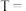
您最近一年使用:0次
2023-07-28更新
|
344次组卷
|
4卷引用:湖南师大附中博才实验中学2022-2023年高一下学期期末考试化学试题
湖南师大附中博才实验中学2022-2023年高一下学期期末考试化学试题广西南宁市第八中学2023-2024学年高二上学期开学考化学试题(已下线)重难点04 化学反应速率及平衡图像问题的分析-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(人教版2019必修第二册)名校期末好题汇编-化学反应与能量(非选择题)
名校
6 . 丙烯酸乙酯天然存在于菠萝等水果中,是一种食品用合成香料,其合成路线如下:
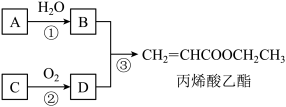
已知:A是石油化工的重要基本原料,还可用于催熟水果;A、C互为同系物,相对分子质量差14。
(1)A的名称为___________ 。
(2)D中含氧官能团名称为___________ 。
(3)写出下列反应的化学方程式及反应类型:
反应①___________ ,反应类型为___________ ;
反应③___________ ,反应类型为___________ 。
(4)下列说法正确的是___________(填字母)。
(5)久置的丙烯酸乙酯自身会发生加聚反应,所得聚合物具有较好的弹性,可用于生产织物和作皮革处理剂,聚丙烯酸乙酯的结构简式为___________ 。

已知:A是石油化工的重要基本原料,还可用于催熟水果;A、C互为同系物,相对分子质量差14。
(1)A的名称为
(2)D中含氧官能团名称为
(3)写出下列反应的化学方程式及反应类型:
反应①
反应③
(4)下列说法正确的是___________(填字母)。
| A.物质A中有6个原子共平面 |
| B.物质A的加聚产物能使溴的四氯化碳溶液褪色 |
| C.物质B可用作燃料,其属于可再生资源 |
| D.C在一定条件下能与HCl发生加成反应,只能得到一种产物 |
您最近一年使用:0次
2023-07-06更新
|
221次组卷
|
2卷引用:广东省梅州市2022-2023学年高一下学期7月期末考试化学试题
名校
7 . 某研究小组用下列实验装置依次研究二氧化硫的漂白性、氧化性、还原性。回答下列问题:

(1)实验室若使用Cu与浓硫酸反应来制取SO2,则该反应的化学方程式为___________ 。
(2)上述装置按气流从左至右,接口连接顺序为:h → a → b → ___ → ___ → ___ → ____ → g,_____ 。连接好装置后,需检查___________ 。
(3)C装置中现象为___________ 。
(4)D装置的作用是___________ 。D装置中的溶液不适宜使用Ca(OH)2溶液代替的原因是___________ 。
(5)B装置中发生反应的离子方程式为___________ 。B中FeCl3溶液也可用___________ (填序号)代替。
a.NaCl溶液 b.碘水 c.浓硫酸 d.BaCl2溶液

(1)实验室若使用Cu与浓硫酸反应来制取SO2,则该反应的化学方程式为
(2)上述装置按气流从左至右,接口连接顺序为:h → a → b → ___ → ___ → ___ → ____ → g,
(3)C装置中现象为
(4)D装置的作用是
(5)B装置中发生反应的离子方程式为
a.NaCl溶液 b.碘水 c.浓硫酸 d.BaCl2溶液
您最近一年使用:0次
2023-04-29更新
|
401次组卷
|
4卷引用:四川省成都市蓉城名校联盟2022-2023学年高一下学期期中联考化学试题
名校
解题方法
8 . 我国稀土产业发达,利用稀土元素制备新型电池材料是一个潜在的研究热点。铈(元素符号为Ce)是最重要的稀土元素之一,以氟碳铈矿(假设只含 、BaO、
、BaO、 )为原料制备氧化铈,其工艺流程如图所示:
)为原料制备氧化铈,其工艺流程如图所示:

提示:稀土元素离子易与 形成复盐沉淀。
形成复盐沉淀。 在空气中易被氧化为
在空气中易被氧化为 。
。
请回答下列问题:
(1)为提高焙烧效率,在焙烧前会将矿石粉碎,简要解释原因__________________ 。
(2)滤渣A的主要成分是 和
和______ (填化学式)。
(3)焙烧后加入稀硫酸浸出,Ce的浸出率和稀硫酸浓度、温度有关,其关系如图所示:
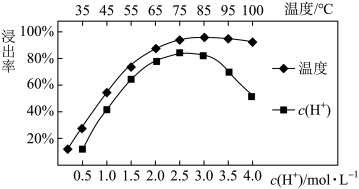
应选择的适宜条件为______ 。硫酸浓度过大时,浸出率降低的原因是______ 。
(4)在进行步骤③时,应该特别注意的问题是_____________________ 。
(5)写出步骤⑤中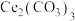 在空气中灼烧的化学反应方程式
在空气中灼烧的化学反应方程式__________________ 。
 、BaO、
、BaO、 )为原料制备氧化铈,其工艺流程如图所示:
)为原料制备氧化铈,其工艺流程如图所示:
提示:稀土元素离子易与
 形成复盐沉淀。
形成复盐沉淀。 在空气中易被氧化为
在空气中易被氧化为 。
。请回答下列问题:
(1)为提高焙烧效率,在焙烧前会将矿石粉碎,简要解释原因
(2)滤渣A的主要成分是
 和
和(3)焙烧后加入稀硫酸浸出,Ce的浸出率和稀硫酸浓度、温度有关,其关系如图所示:

应选择的适宜条件为
(4)在进行步骤③时,应该特别注意的问题是
(5)写出步骤⑤中
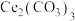 在空气中灼烧的化学反应方程式
在空气中灼烧的化学反应方程式
您最近一年使用:0次
名校
解题方法
9 . NOx会危害人体健康,破坏环境,对其进行无害处理研究一直是科技界关注的重点。请回答以下问题:
(1)选择性催化还原技术(SCR)是针对柴油车尾气排放中的一项处理工艺。已知在催化剂的作用下,有如下反应发生:
①4NH3(g) + 5O2(g) 4NO (g) + 6H2O(g) ΔH1= - 905kJ·mol-1
4NO (g) + 6H2O(g) ΔH1= - 905kJ·mol-1
②4NH3(g) + 3O2(g) 2N2(g) + 6H2O(g) ΔH2=- 1268kJ· mol-1
2N2(g) + 6H2O(g) ΔH2=- 1268kJ· mol-1
③4NH3(g) + 6NO(g) 5N2(g) + 6H2O(g) ΔH3
5N2(g) + 6H2O(g) ΔH3
反应③的反应热ΔH3=_______ 。
(2)氨催化氧化时会发生(1)中的①、②两个竞争反应。为研究某催化剂的效果,在1L恒容密闭容器中充入1molNH3和2molO2,测得反应达到平衡时有关物质的量关系如图:
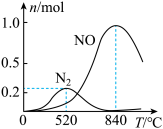
①根据以上信息,其他条件不变时,下列措施中可以提高NH3转化为N2的平衡转化率的是_______ (填字母)。
A.升高反应温度 B.降低反应温度
C.增大NH3和O2的初始投料比 D.及时分离出H2O
②520°C-840°C时体系中NO含量迅速增加的原因是_______ 。
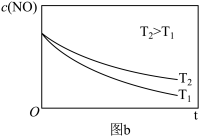
(3)已知:2NO(g)+O2(g) 2NO2(g)分两步进行,其反应过程能量变化如图a。
2NO2(g)分两步进行,其反应过程能量变化如图a。

I.2NO(g) N2O2(g)
N2O2(g)
II.N2O2(g)+O2(g) 2NO2(g)
2NO2(g)
①决定NO氧化反应速率的步骤是_______ (填“I”或“II”)。
②在恒容的密闭容器中充入一定量的NO和O2气体,保持其它条件不变,在温度为T1和T2(T2>T1),测得c(NO)随t(时间)的变化曲线如图b,转化相同量的NO,在温度_______ (填“T1”或“T2”)下消耗的时间较长,结合图a分析其原因_______ 。
(4)在恒温条件下,向初始压强为pMPa的恒容密闭容器中加入等物质的量CO和NO发生反应: 2CO(g)+2NO(g) N2(g)+2CO2(g),反应达平衡时,N2的体积分数为20%,则NO的转化率为
N2(g)+2CO2(g),反应达平衡时,N2的体积分数为20%,则NO的转化率为_______ (保留一位小数)。该条件下反应平衡常数Kp=_______ MPa-1(用平衡分压代替平衡浓度计算,分压=总压 ×物质的量分数)。
(1)选择性催化还原技术(SCR)是针对柴油车尾气排放中的一项处理工艺。已知在催化剂的作用下,有如下反应发生:
①4NH3(g) + 5O2(g)
 4NO (g) + 6H2O(g) ΔH1= - 905kJ·mol-1
4NO (g) + 6H2O(g) ΔH1= - 905kJ·mol-1②4NH3(g) + 3O2(g)
 2N2(g) + 6H2O(g) ΔH2=- 1268kJ· mol-1
2N2(g) + 6H2O(g) ΔH2=- 1268kJ· mol-1③4NH3(g) + 6NO(g)
 5N2(g) + 6H2O(g) ΔH3
5N2(g) + 6H2O(g) ΔH3反应③的反应热ΔH3=
(2)氨催化氧化时会发生(1)中的①、②两个竞争反应。为研究某催化剂的效果,在1L恒容密闭容器中充入1molNH3和2molO2,测得反应达到平衡时有关物质的量关系如图:

①根据以上信息,其他条件不变时,下列措施中可以提高NH3转化为N2的平衡转化率的是
A.升高反应温度 B.降低反应温度
C.增大NH3和O2的初始投料比 D.及时分离出H2O
②520°C-840°C时体系中NO含量迅速增加的原因是
(3)已知:2NO(g)+O2(g)
 2NO2(g)分两步进行,其反应过程能量变化如图a。
2NO2(g)分两步进行,其反应过程能量变化如图a。
I.2NO(g)
 N2O2(g)
N2O2(g)II.N2O2(g)+O2(g)
 2NO2(g)
2NO2(g)①决定NO氧化反应速率的步骤是
②在恒容的密闭容器中充入一定量的NO和O2气体,保持其它条件不变,在温度为T1和T2(T2>T1),测得c(NO)随t(时间)的变化曲线如图b,转化相同量的NO,在温度

(4)在恒温条件下,向初始压强为pMPa的恒容密闭容器中加入等物质的量CO和NO发生反应: 2CO(g)+2NO(g)
 N2(g)+2CO2(g),反应达平衡时,N2的体积分数为20%,则NO的转化率为
N2(g)+2CO2(g),反应达平衡时,N2的体积分数为20%,则NO的转化率为
您最近一年使用:0次
2023-03-22更新
|
499次组卷
|
3卷引用:四川省凉山彝族自治州2023届高三下学期第二次诊断检测理科综合化学试题
名校
10 . 铁元素的纳米材料因具备良好的电学特性和磁学特性,而引起了广泛的研究。纳米零价铁可用于去除水体中的六价铬[Cr(VI)]与硝酸盐等污染物。
(1)①用 溶液与
溶液与 (H元素为-1价)溶液反应制备纳米零价铁的化学方程式:
(H元素为-1价)溶液反应制备纳米零价铁的化学方程式: 。当生成1mol Fe时,反应中转移电子的物质的量为
。当生成1mol Fe时,反应中转移电子的物质的量为_______ 。
②纳米Fe和 均可用于降解含
均可用于降解含 的废水。实验证明
的废水。实验证明 辅助纳米铁去除
辅助纳米铁去除 效果更佳,结合图1,分析其原因是
效果更佳,结合图1,分析其原因是_______ 。 时正极电极反应式为
时正极电极反应式为_______ 。
(3)利用纳米铁粉去除水体中的Cr(VI)反应机理如图2所示。_______ 。
②为了考察溶解氧对水体中的Cr(VI)去除率的影响,实验小组设计了一组对比实验,其中一组在反应中通入 ,另一组不通入
,另一组不通入 。结果表明,实验初期,通入
。结果表明,实验初期,通入 的去除率远高于未通
的去除率远高于未通 的,其原因可能是
的,其原因可能是_______ 。
③某水样Cr(VI)的初始浓度为 ,在相同条件下,探讨了温度为15℃、25℃、35℃、45℃对Cr(Ⅵ)的去除率的影响,结果如图3所示,由图可知,温度在25℃时,去除率最高,其原因是
,在相同条件下,探讨了温度为15℃、25℃、35℃、45℃对Cr(Ⅵ)的去除率的影响,结果如图3所示,由图可知,温度在25℃时,去除率最高,其原因是_______ 。
(1)①用
 溶液与
溶液与 (H元素为-1价)溶液反应制备纳米零价铁的化学方程式:
(H元素为-1价)溶液反应制备纳米零价铁的化学方程式: 。当生成1mol Fe时,反应中转移电子的物质的量为
。当生成1mol Fe时,反应中转移电子的物质的量为②纳米Fe和
 均可用于降解含
均可用于降解含 的废水。实验证明
的废水。实验证明 辅助纳米铁去除
辅助纳米铁去除 效果更佳,结合图1,分析其原因是
效果更佳,结合图1,分析其原因是
 时正极电极反应式为
时正极电极反应式为(3)利用纳米铁粉去除水体中的Cr(VI)反应机理如图2所示。

②为了考察溶解氧对水体中的Cr(VI)去除率的影响,实验小组设计了一组对比实验,其中一组在反应中通入
 ,另一组不通入
,另一组不通入 。结果表明,实验初期,通入
。结果表明,实验初期,通入 的去除率远高于未通
的去除率远高于未通 的,其原因可能是
的,其原因可能是③某水样Cr(VI)的初始浓度为
 ,在相同条件下,探讨了温度为15℃、25℃、35℃、45℃对Cr(Ⅵ)的去除率的影响,结果如图3所示,由图可知,温度在25℃时,去除率最高,其原因是
,在相同条件下,探讨了温度为15℃、25℃、35℃、45℃对Cr(Ⅵ)的去除率的影响,结果如图3所示,由图可知,温度在25℃时,去除率最高,其原因是
您最近一年使用:0次
2023-03-10更新
|
942次组卷
|
3卷引用:江苏省新高考基地学校2022-2023学年高三下学期3月大联考化学试题