名校
1 . 室温下,HR、 、
、 三份溶液中分别加入等物质的量浓度的NaOH溶液,pM[p表示负对数,M表示
三份溶液中分别加入等物质的量浓度的NaOH溶液,pM[p表示负对数,M表示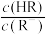 、
、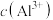 、
、 ]随溶液pH变化的关系如图所示。已知
]随溶液pH变化的关系如图所示。已知 比
比 更难溶,下列说法正确的是
更难溶,下列说法正确的是
 、
、 三份溶液中分别加入等物质的量浓度的NaOH溶液,pM[p表示负对数,M表示
三份溶液中分别加入等物质的量浓度的NaOH溶液,pM[p表示负对数,M表示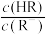 、
、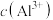 、
、 ]随溶液pH变化的关系如图所示。已知
]随溶液pH变化的关系如图所示。已知 比
比 更难溶,下列说法正确的是
更难溶,下列说法正确的是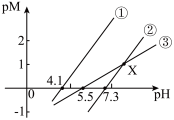
A.室温下,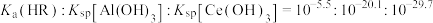 |
B.调节HR溶液pH=7时,溶液中: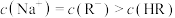 |
| C.可通过计算得出曲线②③的交点X点横坐标为8.6 |
D.向 沉淀中加入足量饱和 沉淀中加入足量饱和 溶液可生成 溶液可生成 沉淀 沉淀 |
您最近一年使用:0次
7日内更新
|
153次组卷
|
2卷引用:辽宁省沈阳市郊联体2024-2025学年高三上学期开学考试化学试题
2 . 乙二醇是一种重要的化工原料,可用于生产聚酯纤维、防冻剂、增塑剂、不饱和聚酯树脂等。由合成气直接合成乙二醇的主要反应过程如下:
Ⅰ.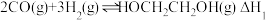
Ⅱ.
(1)已知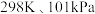 下:
下: ;
; 则反应Ⅱ的△H2=
则反应Ⅱ的△H2=_______ ;反应Ⅱ的正反应活化能_______ (填“大于”、“小于”或“等于”)逆反应活化能。
(2)在恒压密闭容器中充入合成气 和H2,仅考虑发生上述反应Ⅰ,维持10%转化率,所需反应条件(温度、压强)如下表:
和H2,仅考虑发生上述反应Ⅰ,维持10%转化率,所需反应条件(温度、压强)如下表:
随着温度升高所需压强增大的原因是_______ 。
(3)在1 L刚性容器中充入合成气CO和H2,发生反应Ⅰ和反应Ⅱ,在温度473 K,催化剂Rh4(CO)120 (含0.8 mg-Rh)下进行反应。
①测得HOCH2CH2OH(0g)和CH3OH(g)的时空收率分别为1.0 mol·(mg-Rh)-1·h-1和0.5 mol·(mg-Rh)-1·h-1 (时空收率是指催化剂中单位质量Rh在单位时间内所获得的产物量),则用CO表示的反应速率为_______ 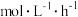 。
。
②若起始总压30 MPa,充入合成气CO和H2物质的量之比为1:2,平衡时HOCH2CH2OH(g)和CH3OH(g)的物质的量之比为1:1,H2的平衡分压为5 MPa,则反应Ⅱ的平衡常数Kp=_______ (MPa)-2(结果用分数表示,分压=总压×物质的量分数)。
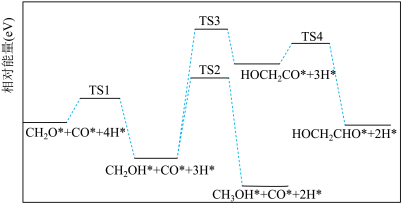
(4)合成气直接法制乙二醇的反应I、Ⅱ的反应历程(部分)如图,下列过程中活化能最大的基元反应方程式为_______ 。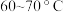 、酸性条件下可电解甲醛制备乙二醇。生成乙二醇的阴极电极反应式为
、酸性条件下可电解甲醛制备乙二醇。生成乙二醇的阴极电极反应式为_______ 。
Ⅰ.
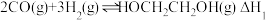
Ⅱ.

(1)已知
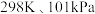 下:
下: ;
; 则反应Ⅱ的△H2=
则反应Ⅱ的△H2=(2)在恒压密闭容器中充入合成气
 和H2,仅考虑发生上述反应Ⅰ,维持10%转化率,所需反应条件(温度、压强)如下表:
和H2,仅考虑发生上述反应Ⅰ,维持10%转化率,所需反应条件(温度、压强)如下表:温度 | 298 | 300 | 346 | 400 |
压强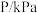 | 5.7 | 6.4 | 49.2 | 261.0 |
| 反应平衡常数K |  | 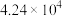 | 1 | 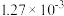 |
(3)在1 L刚性容器中充入合成气CO和H2,发生反应Ⅰ和反应Ⅱ,在温度473 K,催化剂Rh4(CO)120 (含0.8 mg-Rh)下进行反应。
①测得HOCH2CH2OH(0g)和CH3OH(g)的时空收率分别为1.0 mol·(mg-Rh)-1·h-1和0.5 mol·(mg-Rh)-1·h-1 (时空收率是指催化剂中单位质量Rh在单位时间内所获得的产物量),则用CO表示的反应速率为
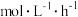 。
。②若起始总压30 MPa,充入合成气CO和H2物质的量之比为1:2,平衡时HOCH2CH2OH(g)和CH3OH(g)的物质的量之比为1:1,H2的平衡分压为5 MPa,则反应Ⅱ的平衡常数Kp=
(4)合成气直接法制乙二醇的反应I、Ⅱ的反应历程(部分)如图,下列过程中活化能最大的基元反应方程式为
 、酸性条件下可电解甲醛制备乙二醇。生成乙二醇的阴极电极反应式为
、酸性条件下可电解甲醛制备乙二醇。生成乙二醇的阴极电极反应式为
您最近一年使用:0次
名校
3 . 人工合成某维生素(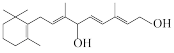 )的路线如下所示。
)的路线如下所示。
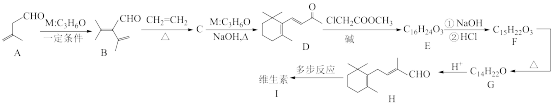
已知:①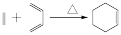 ;
;
②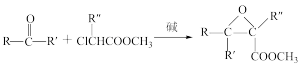 (R、R′、R″为H原子或烃基)。
(R、R′、R″为H原子或烃基)。
(1)有机物A与足量
 反应生成产物的名称为
反应生成产物的名称为(2)B→C的反应类型为
(3)D→E的化学方程式为
(4)F中含有
(5)G的同系物K分子式为
 ,其同分异构体中符合下列条件的有
,其同分异构体中符合下列条件的有①苯环上含有两个取代基 ②能与金属钠反应 ③存在两个甲基 ④水溶液呈中性
(6)参照上述合成路线,写出以氯乙酸甲酯(
 )和
)和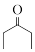 为主要原料合成
为主要原料合成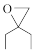 的路线。
的路线。
您最近一年使用:0次
2024-09-15更新
|
182次组卷
|
3卷引用:辽宁省沈阳市郊联体2024-2025学年高三上学期开学考试化学试题
4 . 药物M(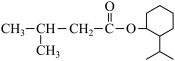 )可用于治疗心脏病,下列有关M的说法错误的是
)可用于治疗心脏病,下列有关M的说法错误的是
| A.M分子中存在3个手性碳原子 |
| B.M遇碱溶液或酸溶液均易变质 |
C.M分子式为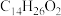 |
D. 与M互为同分异构体 与M互为同分异构体 |
您最近一年使用:0次
5 . 乙苯主要用于生产苯乙烯。已知相关反应的热化学方程式:
①乙苯直接脱氢: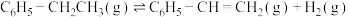
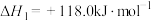
②
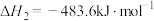
回答下列问题:
(1)写出 与乙苯气体反应生成苯乙烯气体和水蒸气的热化学方程式:
与乙苯气体反应生成苯乙烯气体和水蒸气的热化学方程式:___________ 。
(2)乙苯直接脱氢制苯乙烯的反应历程如图甲所示(—Ph表示苯基)。___________ (填序号)。
②若正丙苯也可进行该反应,则相应的产物为___________ (不考虑立体异构)。
(3)向密闭容器中通入2mol 和1mol
和1mol ,若容器内仅发生
,若容器内仅发生 氧化乙苯脱氢反应,实验测得乙苯的平衡转化率随温度和压强的变化如图乙所示。
氧化乙苯脱氢反应,实验测得乙苯的平衡转化率随温度和压强的变化如图乙所示。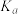 、
、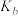 、
、 由大到小的顺序是
由大到小的顺序是___________ 。
②若Ⅹ表示压强,则
___________ (填“>”“<”或“=”) 。
。
③若A点的压强为150kPa,则A点对应条件下,该反应的平衡常数
___________ kPa( 为用分压表示的平衡常数,分压=总压×物质的量分数)。
为用分压表示的平衡常数,分压=总压×物质的量分数)。
(4)合成某种脱氢催化剂的主要成分之一为立方ZnO,其晶胞结构如图丙,已知晶体密度为 ,设
,设 为阿伏加德罗常数的值。
为阿伏加德罗常数的值。 的配位数为
的配位数为___________ 。
②2个 间的最短距离为
间的最短距离为___________ nm。
①乙苯直接脱氢:
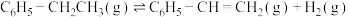
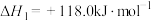
②

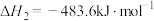
回答下列问题:
(1)写出
 与乙苯气体反应生成苯乙烯气体和水蒸气的热化学方程式:
与乙苯气体反应生成苯乙烯气体和水蒸气的热化学方程式:(2)乙苯直接脱氢制苯乙烯的反应历程如图甲所示(—Ph表示苯基)。

②若正丙苯也可进行该反应,则相应的产物为
(3)向密闭容器中通入2mol
 和1mol
和1mol ,若容器内仅发生
,若容器内仅发生 氧化乙苯脱氢反应,实验测得乙苯的平衡转化率随温度和压强的变化如图乙所示。
氧化乙苯脱氢反应,实验测得乙苯的平衡转化率随温度和压强的变化如图乙所示。
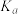 、
、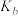 、
、 由大到小的顺序是
由大到小的顺序是②若Ⅹ表示压强,则

 。
。③若A点的压强为150kPa,则A点对应条件下,该反应的平衡常数

 为用分压表示的平衡常数,分压=总压×物质的量分数)。
为用分压表示的平衡常数,分压=总压×物质的量分数)。(4)合成某种脱氢催化剂的主要成分之一为立方ZnO,其晶胞结构如图丙,已知晶体密度为
 ,设
,设 为阿伏加德罗常数的值。
为阿伏加德罗常数的值。
 的配位数为
的配位数为②2个
 间的最短距离为
间的最短距离为
您最近一年使用:0次
名校
解题方法
6 . 纳米级二氧化钛的用途非常广泛。某科研小组在实验室中用普通 制备纳米级
制备纳米级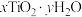 并测定其组成。
并测定其组成。
已知:① 在盐酸中的存在形式为
在盐酸中的存在形式为 ,可吸收CO生成黑色颗粒Pd;
,可吸收CO生成黑色颗粒Pd;
② 为无色或微黄色液体,有刺激性酸味;熔点为-25℃,沸点为136.4℃。
为无色或微黄色液体,有刺激性酸味;熔点为-25℃,沸点为136.4℃。
实验Ⅰ.制备 。
。___________ 。
(2)仪器a名称是___________ ;装置B中长导管的作用是___________ 。
(3)加热装置C前先通入一段时间 的目的为
的目的为___________ ,装置C中发生反应的化学方程式为___________ 。
(4) 遇水易发生潮解,需在
遇水易发生潮解,需在___________ 加装一个干燥装置。
(5)装置F中发生反应的离子方程式为___________ 。
实验Ⅱ.制备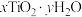
以 为载体,用
为载体,用 和水蒸气反应得到
和水蒸气反应得到 ,再控制温度生成纳米级
,再控制温度生成纳米级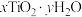 。
。
实验Ⅲ.测定纳米级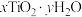 的组成
的组成
步骤ⅰ:将4.54g纳米级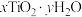 样品溶于稀硫酸得到
样品溶于稀硫酸得到 溶液,再加入锌粉将
溶液,再加入锌粉将 全部还原成
全部还原成 ,过滤除锌粉,将滤液稀释至500mL。
,过滤除锌粉,将滤液稀释至500mL。
步骤ⅱ:取待测液25.00mL,用0.1000 标准
标准 溶液滴定,将
溶液滴定,将 氧化为
氧化为 ,三次滴定消耗标准溶液的平均体积为25.00mL。
,三次滴定消耗标准溶液的平均体积为25.00mL。
(6)计算得该样品的组成为___________ (填化学式)。
 制备纳米级
制备纳米级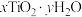 并测定其组成。
并测定其组成。已知:①
 在盐酸中的存在形式为
在盐酸中的存在形式为 ,可吸收CO生成黑色颗粒Pd;
,可吸收CO生成黑色颗粒Pd;②
 为无色或微黄色液体,有刺激性酸味;熔点为-25℃,沸点为136.4℃。
为无色或微黄色液体,有刺激性酸味;熔点为-25℃,沸点为136.4℃。实验Ⅰ.制备
 。
。
(2)仪器a名称是
(3)加热装置C前先通入一段时间
 的目的为
的目的为(4)
 遇水易发生潮解,需在
遇水易发生潮解,需在(5)装置F中发生反应的离子方程式为
实验Ⅱ.制备
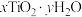
以
 为载体,用
为载体,用 和水蒸气反应得到
和水蒸气反应得到 ,再控制温度生成纳米级
,再控制温度生成纳米级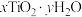 。
。实验Ⅲ.测定纳米级
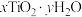 的组成
的组成步骤ⅰ:将4.54g纳米级
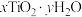 样品溶于稀硫酸得到
样品溶于稀硫酸得到 溶液,再加入锌粉将
溶液,再加入锌粉将 全部还原成
全部还原成 ,过滤除锌粉,将滤液稀释至500mL。
,过滤除锌粉,将滤液稀释至500mL。步骤ⅱ:取待测液25.00mL,用0.1000
 标准
标准 溶液滴定,将
溶液滴定,将 氧化为
氧化为 ,三次滴定消耗标准溶液的平均体积为25.00mL。
,三次滴定消耗标准溶液的平均体积为25.00mL。(6)计算得该样品的组成为
您最近一年使用:0次
2024-09-09更新
|
164次组卷
|
2卷引用:辽宁省沈阳市郊联体2024-2025学年高三上学期开学考试化学试题
名校
解题方法
7 . 下列说法正确的是
| A.金属氧化物都是碱性氧化物 |
B. 与 与 反应生成 反应生成 ,故 ,故 是酸性氧化物 是酸性氧化物 |
C.金刚石、石墨和 是碳元素的同素异形体 是碳元素的同素异形体 |
D. 固体不导电,所以 固体不导电,所以 不是电解质 不是电解质 |
您最近一年使用:0次
2024-09-09更新
|
494次组卷
|
2卷引用:辽宁省名校联盟2024-2025学年高三上学期开学大联考化学试题
名校
8 . 已知过二硫酸分子中含有一个过氧键( ),过二硫酸钾(
),过二硫酸钾( )与
)与 反应的化学方程式为
反应的化学方程式为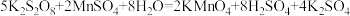 。下列说法错误的是
。下列说法错误的是
 ),过二硫酸钾(
),过二硫酸钾( )与
)与 反应的化学方程式为
反应的化学方程式为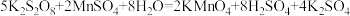 。下列说法错误的是
。下列说法错误的是| A.反应中硫元素被还原 |
B.氧化性: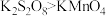 |
C.参加反应的氧化剂与还原剂的物质的量之比为 |
| D.过二硫酸为二元酸 |
您最近一年使用:0次
2024-09-09更新
|
230次组卷
|
2卷引用:辽宁省名校联盟2024-2025学年高三上学期开学大联考化学试题
名校
解题方法
9 . 研究人员设计以葡萄糖( )溶液为原料通过电解法制备山梨醇(
)溶液为原料通过电解法制备山梨醇(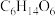 )和葡萄糖酸(
)和葡萄糖酸( ),原理示意图如下(忽略副反应)。已知:①在电场作用下,双极膜可将水解离,在两侧分别得到
),原理示意图如下(忽略副反应)。已知:①在电场作用下,双极膜可将水解离,在两侧分别得到 和
和 ;②—R为
;②—R为 。下列说法正确的是
。下列说法正确的是
 )溶液为原料通过电解法制备山梨醇(
)溶液为原料通过电解法制备山梨醇(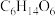 )和葡萄糖酸(
)和葡萄糖酸( ),原理示意图如下(忽略副反应)。已知:①在电场作用下,双极膜可将水解离,在两侧分别得到
),原理示意图如下(忽略副反应)。已知:①在电场作用下,双极膜可将水解离,在两侧分别得到 和
和 ;②—R为
;②—R为 。下列说法正确的是
。下列说法正确的是
| A.左端电极连接电源负极,发生氧化反应 |
| B.该装置工作一段时间后,左池溶液pH几乎不变 |
C.工作时,左池溶液产生的 透过双极膜移向右池 透过双极膜移向右池 |
| D.电路中每转移2mol电子,消耗1mol葡萄糖 |
您最近一年使用:0次
2024-09-09更新
|
144次组卷
|
2卷引用:辽宁省沈阳市郊联体2024-2025学年高三上学期开学考试化学试题
名校
解题方法
10 . 原子序数依次增大的四种元素W、X、Y、Z可形成蓝色难溶于水的化合物 ,W和X同周期,W为有机化合物骨架元素,基态X原子2p能级半充满,Y元素原子半径在第四周期最大(稀有气体元素除外),Z元素的合金是用量最大、用途最广的合金。下列说法错误的是
,W和X同周期,W为有机化合物骨架元素,基态X原子2p能级半充满,Y元素原子半径在第四周期最大(稀有气体元素除外),Z元素的合金是用量最大、用途最广的合金。下列说法错误的是
 ,W和X同周期,W为有机化合物骨架元素,基态X原子2p能级半充满,Y元素原子半径在第四周期最大(稀有气体元素除外),Z元素的合金是用量最大、用途最广的合金。下列说法错误的是
,W和X同周期,W为有机化合物骨架元素,基态X原子2p能级半充满,Y元素原子半径在第四周期最大(稀有气体元素除外),Z元素的合金是用量最大、用途最广的合金。下列说法错误的是A.原子半径: |
B.第一电离能: |
| C.Z位于元素周期表d区 |
D.化合物 为配合物,其中Z的配位数为6 为配合物,其中Z的配位数为6 |
您最近一年使用:0次
2024-09-09更新
|
94次组卷
|
2卷引用:辽宁省名校联盟2024-2025学年高三上学期开学大联考化学试题



