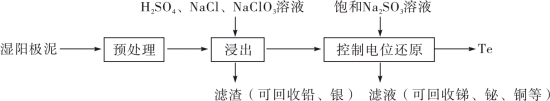
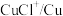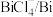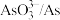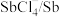1 . 碲(Te)是一种重要的稀有分散元素,广泛应用于冶金、石油、化工、航空、电子等领域。以某冶炼厂的湿阳极泥(含水26%,主要含锑、砷、铅、铋、银和少量铜、碲等)为原料回收碲的流程如下:
请回答下列问题:
(1)52Te的基态原子的电子排布式为___________ 。
(2)原料预处理可采用干燥箱中加热氧化或自然堆放氧化(四天以上)两种方式,两相比较,后者的主要优点是_______________ ;氧化后的原料还需粉碎、过筛,目的是_________________ 。
(3)浸出时,所得滤渣主要含铅、银的化合物,其化学式分别为___________ 、___________ ;添加 可显著提高碲和铜的浸出率,说明预处理后的原料中仍存在低价态的碲和铜,写出
可显著提高碲和铜的浸出率,说明预处理后的原料中仍存在低价态的碲和铜,写出 转化为
转化为 、
、 而被浸出的离子方程式
而被浸出的离子方程式________________ 。
(4)电解时为防止除Te以外的单质生成,需控制电位的范围为___________ ;加入饱和Na2SO3溶液还原 可减少电能消耗并防止阳极生成
可减少电能消耗并防止阳极生成_____________ (填化学式)。
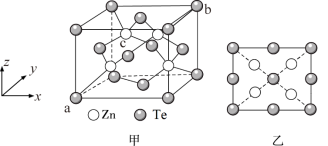
(5)将碲与锌一起加热,然后升华可制得碲化锌。碲化锌是一种重要的半导体材料,图甲为它的一种立方晶胞结构,图乙为该晶胞沿z轴投影图。已知a点的坐标为(0,0,0),b点的坐标为(1,1,1),则c点的坐标为_______________ ,设ZnTe的摩尔质量为M,阿伏加德罗常数的值为NA,密度为dg/cm3,则Zn与Te最近距离为___________ nm(列出计算式即可)。
物质 |
|
|
|
|
|
氧化还原电位(E)/V | 0.342 | 0.568 | 0.16 | 小于0.16 | 小于0.16 |
(1)52Te的基态原子的电子排布式为
(2)原料预处理可采用干燥箱中加热氧化或自然堆放氧化(四天以上)两种方式,两相比较,后者的主要优点是
(3)浸出时,所得滤渣主要含铅、银的化合物,其化学式分别为
 可显著提高碲和铜的浸出率,说明预处理后的原料中仍存在低价态的碲和铜,写出
可显著提高碲和铜的浸出率,说明预处理后的原料中仍存在低价态的碲和铜,写出 转化为
转化为 、
、 而被浸出的离子方程式
而被浸出的离子方程式(4)电解时为防止除Te以外的单质生成,需控制电位的范围为
 可减少电能消耗并防止阳极生成
可减少电能消耗并防止阳极生成(5)将碲与锌一起加热,然后升华可制得碲化锌。碲化锌是一种重要的半导体材料,图甲为它的一种立方晶胞结构,图乙为该晶胞沿z轴投影图。已知a点的坐标为(0,0,0),b点的坐标为(1,1,1),则c点的坐标为
您最近一年使用:0次
7日内更新
|
52次组卷
|
2卷引用:福建省永春一中2023-2024学年高三化学最后一卷试卷
名校
2 . 常温下,下列各组粒子在指定溶液中能大量共存的是
A. 碳酸钠溶液 碳酸钠溶液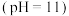 中: 中: 、 、 、 、 |
B.加入苯酚显紫色的溶液中能大量共存的离子: 、 、 、 、 、 、 |
C. 酸性 酸性 溶液中: 溶液中: 、 、 、 、 、 、 |
D.常温下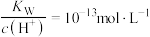 的溶液中: 的溶液中: 、 、 、 、 、 、 |
您最近一年使用:0次
名校
3 . “零碳甲醇”是符合“碳中和”属性的绿色能源。请回答下列有关问题。
(1)已知: ;
; ,
, (a>0,b>0)假设该反应的焓变和熵变不随温度的改变而改变,则该反应能自发进行温度范围
(a>0,b>0)假设该反应的焓变和熵变不随温度的改变而改变,则该反应能自发进行温度范围_____ K(用含a、b的代数式表示)。
(2)某温度下,用 溶液吸收一定量的
溶液吸收一定量的 后,
后, ,则该溶液pOH=
,则该溶液pOH=_____ (该温度下 的
的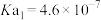 、
、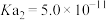 、
、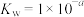 ,用含a的代数式表示)。
,用含a的代数式表示)。
(3)合成甲醇有两种方法。
直接法:
Ⅰ.
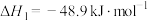
间接法: 和
和 通过逆水煤气反应,先合成CO后,CO和
通过逆水煤气反应,先合成CO后,CO和 再合成甲醇。
再合成甲醇。
Ⅱ.
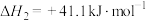
Ⅲ.
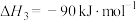
①若利用间接工艺法合成甲醇,反应的决速步为逆水煤气反应,下列示意图中能体现上述反应体系能量变化的是_____ (填字母)。_____ 。
③一定温度、50bar(1bar=100kPa)恒压下,按进料气含a% 、3a%
、3a% (体积分数,杂质气体不反应)合成甲醇,仅发生反应Ⅰ.平衡时二氧化碳转化率为90%,则
(体积分数,杂质气体不反应)合成甲醇,仅发生反应Ⅰ.平衡时二氧化碳转化率为90%,则
_____ bar,反应的平衡常数
_____  (用含a的代数式表示)。
(用含a的代数式表示)。
(4)甲醇、乙醇、正丙醇三种物质在温度传感器尖头处蒸发时的温度变化曲线如图,根据曲线下降的幅度和速率的快慢,可以比较分子间作用力的大小。请判断表示甲醇的曲线是_____ ,理由是_____ 。
(1)已知:
 ;
; ,
, (a>0,b>0)假设该反应的焓变和熵变不随温度的改变而改变,则该反应能自发进行温度范围
(a>0,b>0)假设该反应的焓变和熵变不随温度的改变而改变,则该反应能自发进行温度范围(2)某温度下,用
 溶液吸收一定量的
溶液吸收一定量的 后,
后, ,则该溶液pOH=
,则该溶液pOH= 的
的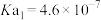 、
、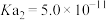 、
、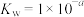 ,用含a的代数式表示)。
,用含a的代数式表示)。(3)合成甲醇有两种方法。
直接法:
Ⅰ.

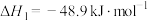
间接法:
 和
和 通过逆水煤气反应,先合成CO后,CO和
通过逆水煤气反应,先合成CO后,CO和 再合成甲醇。
再合成甲醇。Ⅱ.

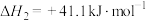
Ⅲ.

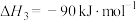
①若利用间接工艺法合成甲醇,反应的决速步为逆水煤气反应,下列示意图中能体现上述反应体系能量变化的是


③一定温度、50bar(1bar=100kPa)恒压下,按进料气含a%
 、3a%
、3a% (体积分数,杂质气体不反应)合成甲醇,仅发生反应Ⅰ.平衡时二氧化碳转化率为90%,则
(体积分数,杂质气体不反应)合成甲醇,仅发生反应Ⅰ.平衡时二氧化碳转化率为90%,则

 (用含a的代数式表示)。
(用含a的代数式表示)。(4)甲醇、乙醇、正丙醇三种物质在温度传感器尖头处蒸发时的温度变化曲线如图,根据曲线下降的幅度和速率的快慢,可以比较分子间作用力的大小。请判断表示甲醇的曲线是

您最近一年使用:0次
名校
4 . 氯化磷酸三钠熔点67℃,常温下较稳定,受热易分解,具有良好的消杀、漂白作用,广泛用于医药、餐饮行业。某小组设计如下流程制备氯化磷酸三钠。下列叙述错误的是
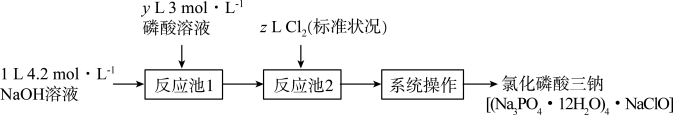
| A.理论上制得的氯化磷酸三钠不超过0.3mol |
B.“反应池1”中最少应加入400mL3 磷酸溶液 磷酸溶液 |
| C.“系列操作”包括蒸发浓缩、降温结晶、过滤、洗涤和高温烘干 |
| D.氧化磷酸三钠因含NaClO而具有消杀、漂白作用 |
您最近一年使用:0次
名校
解题方法
5 . 锂辉矿(主要成分为 )可用低温重构-直接浸出技术制备碳酸锂,同时得到氧化铝,工艺流程如图,下列说法不正确的是
)可用低温重构-直接浸出技术制备碳酸锂,同时得到氧化铝,工艺流程如图,下列说法不正确的是
 )可用低温重构-直接浸出技术制备碳酸锂,同时得到氧化铝,工艺流程如图,下列说法不正确的是
)可用低温重构-直接浸出技术制备碳酸锂,同时得到氧化铝,工艺流程如图,下列说法不正确的是
A.“水热反应”为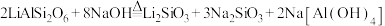 |
| B.“滤渣1”和“滤渣2”主要成分不同 |
| C.流程中不涉及氧化还原反应 |
| D.冶炼金属锂可用电解其熔融氯化物的方法,而冶炼金属铝则不可以 |
您最近一年使用:0次
名校
解题方法
6 . 某小组设计如下装置测定新装修居室内空气中甲醛的含量(夹持装置略)。
已知:①测定原理为甲醛把Ag+还原成Ag,产生的Ag与Fe3+定量反应生成Fe2+,Fe2+与菲洛嗪形成有色配合物,通过测定吸光度计算出甲醛的含量;
②吸光度用A表示,计算公式为A=abc,其中a为吸光度系数,b为光在样本中经过的距离,c为溶液浓度。
Ⅰ.制备银氨溶液。
(1)仪器A的名称是____________ 。
(2)向仪器A、B中加入药品,将B中的___________ (填“AgNO3溶液”或“氨水”)逐滴加入A中至___________ (填实验现象)。
Ⅱ.吸收室内空气中甲醛。
(3)选择正确的操作,完成室内空气中甲醛含量的测定:
操作①:取下玻璃塞→操作②:____ →操作③:______ →操作④:使可滑动隔板处于最右端→操作⑤:___ →操作⑥:_____ →操作⑦:_____ →再将操作③~⑦重复 4 次 →测定溶液吸光度。
a.打开K1,关闭K2
b.打开K2,关闭K1
c.将可滑动隔板拉至最左端
d.热水浴加热仪器A
e.将可滑动隔板缓慢推至最右端
f.将可滑动隔板迅速推至最右端
(4)装置中使用毛细管而非普通玻璃管的原因是_____________ ,写出甲醛与银氨溶液反应的化学方程式____________ 。
Ⅲ.测定甲醛含量。
(5)将仪器A中溶液的pH调至1,加入足量Fe2(SO4)3溶液,充分反应后加入菲洛嗪,通过测定吸光度确定生成Fe2+1.12mg,则空气中甲醛的含量为__________ mg/L。
(6)下列说法正确的是__________。
(7)Fe2+能够与许多化合物形成配位化合物。邻二氮菲( )与Fe2+形成的红色配合物[Fe(phen)3]2+,该配合物的特征颜色可用于测定Fe2+的浓度。
)与Fe2+形成的红色配合物[Fe(phen)3]2+,该配合物的特征颜色可用于测定Fe2+的浓度。
①红色配离子[Fe(phen)3]2+中不存在的作用力有__________ 。
A.σ键 B.π键 C.离子键 D.氢键 E.配位键
②实验表明,邻二氮菲检验Fe2+的适宜pH范围是2~9,试分析原因是_____________ 。
已知:①测定原理为甲醛把Ag+还原成Ag,产生的Ag与Fe3+定量反应生成Fe2+,Fe2+与菲洛嗪形成有色配合物,通过测定吸光度计算出甲醛的含量;
②吸光度用A表示,计算公式为A=abc,其中a为吸光度系数,b为光在样本中经过的距离,c为溶液浓度。

Ⅰ.制备银氨溶液。
(1)仪器A的名称是
(2)向仪器A、B中加入药品,将B中的
Ⅱ.吸收室内空气中甲醛。
(3)选择正确的操作,完成室内空气中甲醛含量的测定:
操作①:取下玻璃塞→操作②:
a.打开K1,关闭K2
b.打开K2,关闭K1
c.将可滑动隔板拉至最左端
d.热水浴加热仪器A
e.将可滑动隔板缓慢推至最右端
f.将可滑动隔板迅速推至最右端
(4)装置中使用毛细管而非普通玻璃管的原因是
Ⅲ.测定甲醛含量。
(5)将仪器A中溶液的pH调至1,加入足量Fe2(SO4)3溶液,充分反应后加入菲洛嗪,通过测定吸光度确定生成Fe2+1.12mg,则空气中甲醛的含量为
(6)下列说法正确的是__________。
| A.本实验缺少尾气处理装置 |
| B.实验应在室内不同点位进行空气取样,以保证数据的准确性 |
| C.毛细管的作用是减小空气通入速率,保证空气中的HCHO被吸收完全 |
| D.有色配合物浓度越大,测得吸光度数值越大 |
 )与Fe2+形成的红色配合物[Fe(phen)3]2+,该配合物的特征颜色可用于测定Fe2+的浓度。
)与Fe2+形成的红色配合物[Fe(phen)3]2+,该配合物的特征颜色可用于测定Fe2+的浓度。①红色配离子[Fe(phen)3]2+中不存在的作用力有
A.σ键 B.π键 C.离子键 D.氢键 E.配位键
②实验表明,邻二氮菲检验Fe2+的适宜pH范围是2~9,试分析原因是
您最近一年使用:0次
名校
解题方法
7 . 徐光宪在《分子共和国》一书中介绍了许多明星分子,如O3、CO2、Cl2、CH3COOH等。下列说法不正确的是
| A.Cl2分子中,Cl-Cl键是p-pσ键 |
| B.酸性:甲酸>乙酸>丙酸 |
| C.在H2S和H2O晶体中,每个分子周围紧邻的分子数均是12 |
| D.O3极性微弱,在CCl4中的溶解度高于在水中的溶解度 |
您最近一年使用:0次
名校
8 . 镍电池芯废料中主要含有金属镍,还含有金属钴、铁、铝。一种从镍电池芯废料中回收金属的工艺流程如下。下列说法正确的是

| A.“酸浸”时,若改用浓硫酸,反应速率更快,效果更好 |
B. 在“氧化除杂”和“酸溶”中的作用相同 在“氧化除杂”和“酸溶”中的作用相同 |
C.洗涤“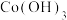 ”操作是向漏斗内加水至浸没滤饼,用玻璃棒搅拌使水快速流下 ”操作是向漏斗内加水至浸没滤饼,用玻璃棒搅拌使水快速流下 |
| D.“结晶”时,应加热至出现少量晶膜时,再冷却结晶 |
您最近一年使用:0次
名校
9 . 某新型合成药物的中间体结构如图所示,科学家需要对其进行成酯修饰后患者才能服用。已知连在同一碳上的两个羟基易脱水,下列说法正确的是
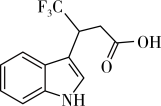
A. 该化合物最多与 该化合物最多与 反应 反应 |
| B.该化合物分子中最多有11个碳原子共平面 |
| C.对该化合物分子进行成酯修饰目的是增强其水溶性 |
| D.分析该化合物的质谱图,可获得分子中含有的官能团的信息 |
您最近一年使用:0次
名校
10 . 茴香油是淡黄色液体或晶体,难溶于水,易溶于有机溶剂,在水蒸气作用下易挥发,某茴香油主要成分是含有酯基的芳香族化合物。实验室提取该茴香油的流程如下:

| A.操作A是利用沸点差异进行分离 |
| B.水蒸气蒸馏和减压蒸馏的原理相同 |
C.有机层加入的无水 可用碱石灰代替 可用碱石灰代替 |
| D.馏出液加NaCl至饱和可以提高茴香油的提取率 |
您最近一年使用:0次
2024-06-08更新
|
104次组卷
|
2卷引用:福建省泉州第五中学2024届高三下学期适应性检测化学试题