名校
1 . 从1869年俄国化学家门捷列夫编制出第一张元素周期表到现在形成的周期表经过了众多化学家的艰辛努力。元素周期表体现了元素“位-构-性”的关系,揭示了元素间的内在联系。下表列出①~⑧八种元素在周期表中的位置,回答下列问题:
(1)②③④的原子半径由大到小的顺序是_______ (填元素符号)。
(2)⑧的元素符号是_______ ,它的最高价含氧酸的分子式是_______ 。
(3)④能形成多种同素异形体,如_______ 、_______ 等,它们之间的转化是_______ 变化(填“物理”或“化学”)。
(4)①与⑤形成的化合物可做野外生氢剂,写出该物质与水反应的化学方程式_______ ,其中氧化剂是_______ 。
(5)⑥与⑦的简单氢化物更稳定的是_______ (填化学式)。
(6)门捷列夫编制元素周期表时预言了几种当时还没有发现的元素,并在表中留了空位,其中铝元素正下方的“类铝”后来被发现并命名为“镓”,元素符号为 ,镓的金属性比铝
,镓的金属性比铝_______ (填“强”或“弱”),其氢氧化物与盐酸反应的化学方程式为_______ 。
族 周期 | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(2)⑧的元素符号是
(3)④能形成多种同素异形体,如
(4)①与⑤形成的化合物可做野外生氢剂,写出该物质与水反应的化学方程式
(5)⑥与⑦的简单氢化物更稳定的是
(6)门捷列夫编制元素周期表时预言了几种当时还没有发现的元素,并在表中留了空位,其中铝元素正下方的“类铝”后来被发现并命名为“镓”,元素符号为
 ,镓的金属性比铝
,镓的金属性比铝
您最近一年使用:0次
2023-01-01更新
|
241次组卷
|
2卷引用:黑龙江省哈尔滨市2021-2022学年高一上学期期末学业质量检测化学试题
名校
2 . Ⅰ.几种短周期元素的原子半径及主要化合价如下表:已知X是短周期中最活泼的金属,且与R同周期。(请用相应的化学用语答题 )
(1)R的元素符号为________ ;M在元素周期表中的位置为________________ 。
(2)X与Y按原子个数比1∶1构成的物质的电子式为________________ ;所含化学键类型__________________________ 。
(3)X+、Y2-、M2-离子半径大小顺序为__________________ 。
(4)将YM2通入FeCl3溶液中的离子方程式:_________________________________________ 。
Ⅱ.如图转化关系(A、B、C中含相同元素)
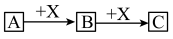
(1)若B为白色胶状不溶物,则A与C反应的离子方程式为_________________________ 。
(2)若向B溶液中滴加铁氰化钾溶液会产生特征蓝色沉淀,则A与C反应生成B的离子方程式为_____________________________________________ 。
| 元素代号 | X | Y | Z | M | R |
| 原子半径/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 |
| 主要化合价 | +1 | +6 -2 | +5 -3 | -2 | +3 |
(1)R的元素符号为
(2)X与Y按原子个数比1∶1构成的物质的电子式为
(3)X+、Y2-、M2-离子半径大小顺序为
(4)将YM2通入FeCl3溶液中的离子方程式:
Ⅱ.如图转化关系(A、B、C中含相同元素)

(1)若B为白色胶状不溶物,则A与C反应的离子方程式为
(2)若向B溶液中滴加铁氰化钾溶液会产生特征蓝色沉淀,则A与C反应生成B的离子方程式为
您最近一年使用:0次
2019-05-11更新
|
168次组卷
|
2卷引用:【全国百强校】黑龙江省哈尔滨市第六中学2018-2019学年高二下学期期中考试化学试题
11-12高三上·黑龙江哈尔滨·期中
解题方法
3 . A-H及X均为中学化学常见物质, X是一种金属单质,A、B是非金属单质且A在常温下为气体。它们在一定条件下有如下转化关系(图中条件均已略去)。
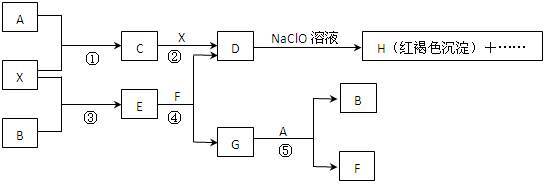
试回答下列问题:
(1)写出C物质的化学式___________ ;
(2)在上述①-⑤反应中肯定不属于氧化还原反应的是___________ (填编号);
(3)指出元素X在元素周期表中的位置:___________ ;
(4)请写出反应④和⑤的离子方程式:④___________ ,⑤___________ ;
(5)用离子方程式表示在D溶液中加入NaClO溶液产生红褐色沉淀的原因:___________ 。

试回答下列问题:
(1)写出C物质的化学式
(2)在上述①-⑤反应中肯定不属于氧化还原反应的是
(3)指出元素X在元素周期表中的位置:
(4)请写出反应④和⑤的离子方程式:④
(5)用离子方程式表示在D溶液中加入NaClO溶液产生红褐色沉淀的原因:
您最近一年使用:0次
名校
4 . 己二酸是一种重要的化工原料,科学家在现有工业路线基础上,提出了一条“绿色”合成路线;
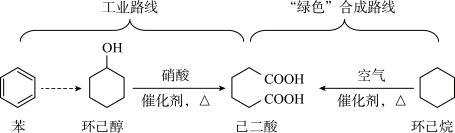
| A.环己烷分子的组成元素均位于元素周期表p区 |
| B.工业路线中涉及苯的取代反应,该反应需使用苯、浓溴水混合加热制得溴苯 |
C.由于环己醇分子之间存在氢键,环己醇的沸点比甲基环己烷(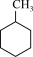 )高 )高 |
| D.己二酸分子中所含σ键个数与π键个数之比为11∶2 |
您最近一年使用:0次
名校
解题方法
5 . X、Y、Z、Q、W、R 六种短周期元素原子序数依次增大。化合物甲俗称苛性钠,由 X、Z、Q 三种元素 组成。医学中常用QR 溶液配制生理盐水。化合物乙由X、R 两种元素组成。请回答下列问题:
(1)Z 的离子结构示意图为___________ ,由X、Z、Q 三种元素组成的化合物与 R 单质反应的离子方程式___________ 。
(2)元素 Y 在元素周期表中的位置是第___________ 周期___________ 族
(3)与R 处于同一主族气态氢化物最稳定的元素是___________
(4)Y元素的单质及其化合物能发生如图所示的转化,则 Y元素为___________ (填元素符号)。在甲溶液中通入少量YZ2气体,写出该反应的离子方程式:___________ 。
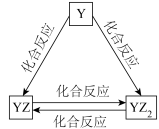
(5)W 的单质既能与甲溶液反应,又能与乙溶液反应。常温下,将 W 的单质和甲溶液混合,发生反应的离子方程式___________ 。
(1)Z 的离子结构示意图为
(2)元素 Y 在元素周期表中的位置是第
(3)与R 处于同一主族气态氢化物最稳定的元素是
(4)Y元素的单质及其化合物能发生如图所示的转化,则 Y元素为

(5)W 的单质既能与甲溶液反应,又能与乙溶液反应。常温下,将 W 的单质和甲溶液混合,发生反应的离子方程式
您最近一年使用:0次
名校
6 . 磷、硫元素的单质及其化合物应用广泛。
(1)磷元素在元素周期表中的位置是____ 。
(2)磷的重要化合物NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某微粒的浓度占各微粒浓度之和的分数)与pH的关系如图所示。
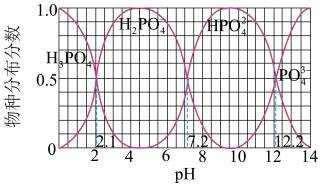
①为获得尽可能纯的NaH2PO4,pH应控制在____ ;pH=8时,溶液中主要含磷微粒浓度大小关系为c(HPO )
)____ c(H2PO )。(填“>”、“<”或“=”)
)。(填“>”、“<”或“=”)
②Na2HPO4溶液显碱性,试用数据及文字简述其原因____ 。
(3)H2O2的一种衍生物(NH4)2S2O8(过二硫酸铵),阴离子结构式为(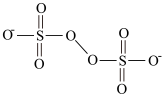 ),其S元素的化合价为
),其S元素的化合价为____ ;其溶液加热至沸后,S2O 与H2O反应,使溶液pH降低,写出S2O
与H2O反应,使溶液pH降低,写出S2O 与H2O反应的离子方程式:
与H2O反应的离子方程式:____ 。
(4)电解(NH4)2SO4和稀硫酸的混合溶液,常被用于电解产生(NH4)2S2O8,电解时均用惰性电极,阳极发生的电极反应式可表示为____ ;阴极生成的气体单质分子式为____ 。
(1)磷元素在元素周期表中的位置是
(2)磷的重要化合物NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某微粒的浓度占各微粒浓度之和的分数)与pH的关系如图所示。

①为获得尽可能纯的NaH2PO4,pH应控制在
 )
) )。(填“>”、“<”或“=”)
)。(填“>”、“<”或“=”)②Na2HPO4溶液显碱性,试用数据及文字简述其原因
(3)H2O2的一种衍生物(NH4)2S2O8(过二硫酸铵),阴离子结构式为(
 ),其S元素的化合价为
),其S元素的化合价为 与H2O反应,使溶液pH降低,写出S2O
与H2O反应,使溶液pH降低,写出S2O 与H2O反应的离子方程式:
与H2O反应的离子方程式:(4)电解(NH4)2SO4和稀硫酸的混合溶液,常被用于电解产生(NH4)2S2O8,电解时均用惰性电极,阳极发生的电极反应式可表示为
您最近一年使用:0次
解题方法
7 . 研究氮及其化合物的性质,可以有效改善人类的生存环境。氮元素化合价—物质类别关系图如下。
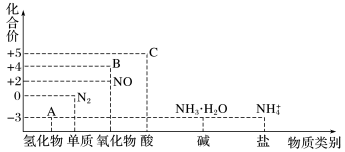
回答下列问题:
(1)氮气是空气的主要成分,性质十分稳定。氮元素在元素周期表中的位置是_______ 。
(2)物质A中的化学键为_______ 。(填极性键或非极性键)
(3)物质A与物质C反应生成的化合物属于_______ 化合物。(填离子或共价)
(4)物质B为红棕色气体,写出该物质与水反应的离子方程式:_______ 。当反应消耗3.36L(标准状况)物质B时,转移电子的物质的量为_______ mol。

回答下列问题:
(1)氮气是空气的主要成分,性质十分稳定。氮元素在元素周期表中的位置是
(2)物质A中的化学键为
(3)物质A与物质C反应生成的化合物属于
(4)物质B为红棕色气体,写出该物质与水反应的离子方程式:
您最近一年使用:0次
8 . 乙烯和丙烯是工业生产中非常重要的化工基本原料。
I.丙烯(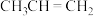 )是一种重要的化工原料,它存在如下转化关系:
)是一种重要的化工原料,它存在如下转化关系:_______ 。
(2)在120℃、 条件下时,取一定体积的丙烯和足量的氧气混合点燃,相同条件下测得反应前后气体体积将
条件下时,取一定体积的丙烯和足量的氧气混合点燃,相同条件下测得反应前后气体体积将_______ (填“变大”“变小”或“不变”)。
(3)丙烯能使溴水褪色,其反应的化学方程式为_______ ,反应类型为_______ 。
Ⅱ.以乙烯为原料制备一种工业增塑剂的合成路线如图:_______ 。
(5)有机物B与足量金属钠反应的化学方程式为_______ 。
(6)合成增塑剂的化学方程式为_______ ,反应类型是_______ 。
I.丙烯(
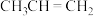 )是一种重要的化工原料,它存在如下转化关系:
)是一种重要的化工原料,它存在如下转化关系: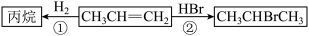
(2)在120℃、
 条件下时,取一定体积的丙烯和足量的氧气混合点燃,相同条件下测得反应前后气体体积将
条件下时,取一定体积的丙烯和足量的氧气混合点燃,相同条件下测得反应前后气体体积将(3)丙烯能使溴水褪色,其反应的化学方程式为
Ⅱ.以乙烯为原料制备一种工业增塑剂的合成路线如图:
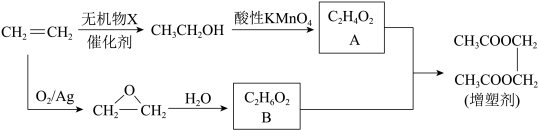
(5)有机物B与足量金属钠反应的化学方程式为
(6)合成增塑剂的化学方程式为
您最近一年使用:0次
2023-01-09更新
|
1271次组卷
|
4卷引用:黑龙江省哈尔滨市第一二二中学2021-2022学年高一下学期期末考试化学试题
黑龙江省哈尔滨市第一二二中学2021-2022学年高一下学期期末考试化学试题(已下线)专题06 乙醇、乙酸、糖、油、蛋白质(知识串讲+专题过关)-2022-2023学年高一化学下学期期中期末考点大串讲(沪科版2020必修第二册)名校期末好题汇编-有机化合物(非选择题)新疆塔城地区第一高级中学2023-2024学年高二下学期5月期中考试化学试题
名校
解题方法
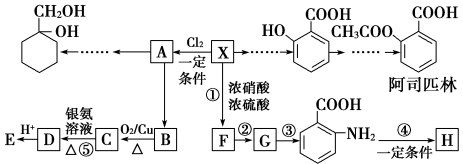
9 . 相对分子质量为92的某芳香烃X是一种重要有机化工原料,研究部门以它为初始原料设计出如下转化关系图(部分产物、合成路线、反应条件略去)。其中A是一氯代物,H是一种功能高分子,链节组成为C7H5NO。

请根据所学知识与本题所给信息回答下列问题:
(1)X的分子中最多有________ 个原子共面。
(2)H的结构简式为_____________________________________ 。
(3)反应②、④的类型分别为____________ 反应、____________ 反应。
(4)反应⑤的化学方程式是____________________________________________ 。
(5)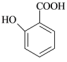 有多种同分异构体,其中含有1个醛基和2个羟基,其核磁共振氢谱图中峰面积之比为1:2:2:1,则符合上述条件的所有同分异构体的结构简式是
有多种同分异构体,其中含有1个醛基和2个羟基,其核磁共振氢谱图中峰面积之比为1:2:2:1,则符合上述条件的所有同分异构体的结构简式是_______________________ 。

请根据所学知识与本题所给信息回答下列问题:
(1)X的分子中最多有
(2)H的结构简式为
(3)反应②、④的类型分别为
(4)反应⑤的化学方程式是
(5)
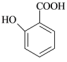 有多种同分异构体,其中含有1个醛基和2个羟基,其核磁共振氢谱图中峰面积之比为1:2:2:1,则符合上述条件的所有同分异构体的结构简式是
有多种同分异构体,其中含有1个醛基和2个羟基,其核磁共振氢谱图中峰面积之比为1:2:2:1,则符合上述条件的所有同分异构体的结构简式是
您最近一年使用:0次
名校
解题方法
10 . A、B、C、D、E、F是分属三个短周期的主族元素,且原子序数依次增大。A、D同主族,B的氢化物水溶液呈碱性,C、E同主族,形成的化合物EC2是形成酸雨的主要物质之一。请用化学用语回答下列问题:
(1)F在元素周期表中的位置为_______________ 。
(2)常温下,液态的B2A4与气态的BC2两者发生反应生成无毒物质,16g B2A4发生反应放热akJ,该反应的热化学方程式为____________________________________________ 。
(3)D2E溶液在空气中长期放置发生反应,生成物之一为H。H与过氧化钠的结构和化学性质相似,其溶液显黄色,H的电子式为_________________ 。写出在空气中长期放置生成H的化学反应方程式为:___________________________________ 。H的溶液与稀硫酸反应产生的现象为____________________________________ 。
(4)化学家发现一种化学式为A4B4的离子化合物,一定条件下1mol 熔融A4B4电离生成两种离子各1mol,则该物质熔融时的电离方程式为____________________________________ 。
(5)向30mL某浓度由A、B、C、D中三种元素形成的一元强碱溶液中通入CO2气体后得溶液M,因CO2通入量的不同,溶液M的组成也不同。若向M中逐滴加入0.1mol/L盐酸,产生的气体V(CO2)与加入盐酸的体积V[HCl(aq)]的关系有下列图示两种情况(不计CO2的溶解)。则曲线Y表明M中的溶质为_______________ ;原NaOH溶液的物质的量浓度为____________ ;由曲线X、Y可知,两次实验通入的CO2的体积比为_________ 。

(1)F在元素周期表中的位置为
(2)常温下,液态的B2A4与气态的BC2两者发生反应生成无毒物质,16g B2A4发生反应放热akJ,该反应的热化学方程式为
(3)D2E溶液在空气中长期放置发生反应,生成物之一为H。H与过氧化钠的结构和化学性质相似,其溶液显黄色,H的电子式为
(4)化学家发现一种化学式为A4B4的离子化合物,一定条件下1mol 熔融A4B4电离生成两种离子各1mol,则该物质熔融时的电离方程式为
(5)向30mL某浓度由A、B、C、D中三种元素形成的一元强碱溶液中通入CO2气体后得溶液M,因CO2通入量的不同,溶液M的组成也不同。若向M中逐滴加入0.1mol/L盐酸,产生的气体V(CO2)与加入盐酸的体积V[HCl(aq)]的关系有下列图示两种情况(不计CO2的溶解)。则曲线Y表明M中的溶质为

您最近一年使用:0次
2017-05-21更新
|
281次组卷
|
2卷引用:黑龙江省哈尔滨师范大学附属中学2019届高三上学期第一次月考化学试题



