解题方法
1 . 磷的单质及其化合物在生产、生活中具有广泛应用。回答下列问题:
(1)基态磷原子价电子排布式为___________ ,核外电子占据的最高能级的电子云轮廓图为___________ 形。
(2)第三周期元素中第一电离能介于硅和磷之间的元素为___________ (填元素符号),离子半径:
___________ (填“>”“<”或“=”) 。
。
(3) 固体属于
固体属于___________ 晶体,键能: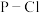
___________ (填“>”“<”或“=”) ,
, 、
、 中键角较大的是
中键角较大的是___________ 。
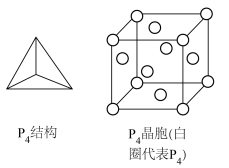
(4)白磷的分子结构及其晶胞结构如图所示,晶胞参数为 。
。 中磷原子的杂化方式为
中磷原子的杂化方式为___________ 。
②白磷晶体中,距离一个 最近的
最近的 个数为
个数为___________ 。
③该晶体的密度=___________  (
( 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
(1)基态磷原子价电子排布式为
(2)第三周期元素中第一电离能介于硅和磷之间的元素为

 。
。(3)
 固体属于
固体属于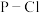
 ,
, 、
、 中键角较大的是
中键角较大的是(4)白磷的分子结构及其晶胞结构如图所示,晶胞参数为
 。
。
 中磷原子的杂化方式为
中磷原子的杂化方式为②白磷晶体中,距离一个
 最近的
最近的 个数为
个数为③该晶体的密度=
 (
( 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近一年使用:0次
2 . 氮、氧、磷、砷及其化合物在工农业生产等方面有着重要应用。请按要求回答下列问题。
(1)电负性P_______ As(填“>”或“<”或“=”)。
(2)尿素(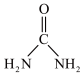 )中碳原子杂化类型
)中碳原子杂化类型_______ ; 离子的立体构型名称(即空间构型)为
离子的立体构型名称(即空间构型)为_______ 。
(3)AsH3是无色稍有大蒜味的气体。AsH3的沸点高于PH3,其主要原因是_______ 。
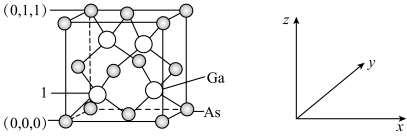
(4)我国的“天宫”空间站的核心舱“天和”选择了高效柔性砷化镓(GaAs)薄膜太阳能电池来供电。已知砷化镓的熔点为1238℃,GaAs的晶胞结构如图所示。_______ ,As与Ga之间存在的化学键有_______ (填字母)。
A.离子键 B.σ键 C.π键 D.氢键 E.配位键 F.金属键 G.极性键
②1号镓原子的坐标为_______ 。晶胞密度为dg∙cm-3,摩尔质量为Mg∙mol-1 ,阿伏加德罗常数的值用NA表示,则晶胞中最近的As和Ga原子核间距为_______ nm(列式表示)。
(1)电负性P
(2)尿素(
 )中碳原子杂化类型
)中碳原子杂化类型 离子的立体构型名称(即空间构型)为
离子的立体构型名称(即空间构型)为(3)AsH3是无色稍有大蒜味的气体。AsH3的沸点高于PH3,其主要原因是
(4)我国的“天宫”空间站的核心舱“天和”选择了高效柔性砷化镓(GaAs)薄膜太阳能电池来供电。已知砷化镓的熔点为1238℃,GaAs的晶胞结构如图所示。
A.离子键 B.σ键 C.π键 D.氢键 E.配位键 F.金属键 G.极性键
②1号镓原子的坐标为
您最近一年使用:0次
3 .  具有反萤石结构,晶胞结构如图所示,其晶胞参数为0.635nm。下列叙述错误的是
具有反萤石结构,晶胞结构如图所示,其晶胞参数为0.635nm。下列叙述错误的是
 具有反萤石结构,晶胞结构如图所示,其晶胞参数为0.635nm。下列叙述错误的是
具有反萤石结构,晶胞结构如图所示,其晶胞参数为0.635nm。下列叙述错误的是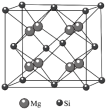
A. 的配位数为8 的配位数为8 |
B.紧邻的两个 原子的距离为 原子的距离为 nm nm |
C.紧邻的两个 原子间的距离为 原子间的距离为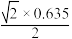 nm nm |
D. 的密度计算式为 的密度计算式为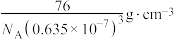 |
您最近一年使用:0次
4 . 氨是无碳的能源载体和潜在的储氢燃料,广泛应用于化肥、塑料和炸药的生产。回答下列问题:
(1)已知: ,
, 。
。
在下列温度下,该反应可能自发进行的是___________(填字母)。
(2)反应历程中各步势能变化如下图所示,其中吸附在催化剂表面的物种用“ad”表示。___________ (填“释放”或“吸收”)能量;该反应历程中有___________ 个基元反应,决速步骤的反应可以表示为_____________________ 。
(3)在容积为 的恒容密闭容器内充入
的恒容密闭容器内充入 和
和 ,加入合适催化剂(体积可以忽略不计),在不同催化剂作用下,相同时间内
,加入合适催化剂(体积可以忽略不计),在不同催化剂作用下,相同时间内 的转化率随温度的变化如下图所示:
的转化率随温度的变化如下图所示: 的转化率随温度升高先增大后减小的原因可能是
的转化率随温度升高先增大后减小的原因可能是_____________ (不考虑温度对催化剂活性的影响);c点
________ (填“大于”或“小于”)b点 ,简述其原因:
,简述其原因:________________________ 。
(4)在某催化剂作用下,合成氮的反应速率为 (k为速率常数,只与温度、催化剂有关,与浓度无关。
(k为速率常数,只与温度、催化剂有关,与浓度无关。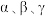 为反应级数,可取正数、负数、0,也可取分数),为了测定反应级数,
为反应级数,可取正数、负数、0,也可取分数),为了测定反应级数,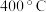 下进行实验,结果如表所示:
下进行实验,结果如表所示:
则
___________ 。
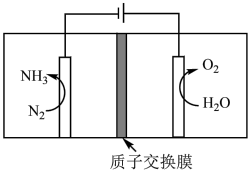
(5)利用催化剂通过电化学反应在室温下合成氨的原理如下图所示,该装置中阴极的电极反应式为______________________________ 。
(1)已知:
 ,
, 。
。在下列温度下,该反应可能自发进行的是___________(填字母)。
A. | B.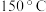 | C. | D. |
(2)反应历程中各步势能变化如下图所示,其中吸附在催化剂表面的物种用“ad”表示。
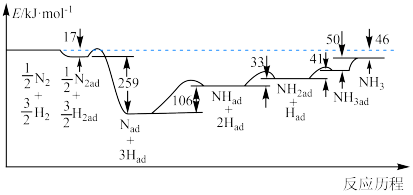
(3)在容积为
 的恒容密闭容器内充入
的恒容密闭容器内充入 和
和 ,加入合适催化剂(体积可以忽略不计),在不同催化剂作用下,相同时间内
,加入合适催化剂(体积可以忽略不计),在不同催化剂作用下,相同时间内 的转化率随温度的变化如下图所示:
的转化率随温度的变化如下图所示:
 的转化率随温度升高先增大后减小的原因可能是
的转化率随温度升高先增大后减小的原因可能是
 ,简述其原因:
,简述其原因:(4)在某催化剂作用下,合成氮的反应速率为
 (k为速率常数,只与温度、催化剂有关,与浓度无关。
(k为速率常数,只与温度、催化剂有关,与浓度无关。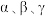 为反应级数,可取正数、负数、0,也可取分数),为了测定反应级数,
为反应级数,可取正数、负数、0,也可取分数),为了测定反应级数,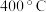 下进行实验,结果如表所示:
下进行实验,结果如表所示:序号 |
|
|
| 反应速率 |
I | 0.1 | 0.1 | 0.1 | v |
II | 0.2 | 0.1 | 0.1 |
|
III | 0.2 | 0.4 | 0.1 |
|
IV | 0.1 | 0.9 | 0.3 |
|

(5)利用催化剂通过电化学反应在室温下合成氨的原理如下图所示,该装置中阴极的电极反应式为
您最近一年使用:0次
2024-03-26更新
|
144次组卷
|
2卷引用:2024届黑龙江省绥化市高三下学期3月联考模拟检测化学试卷
名校
解题方法
5 . “天问一号”着陆火星,“嫦娥五号”采回月壤,探索宇宙奥秘离不开化学。镍铼合金是制造喷气发动机的燃烧室、涡轮叶片及排气喷嘴的重要材料。元素铼( )的熔点仅次于钨,是稀有金属之一,地壳中铼的含量极低,多伴生于铜、锌、铅等矿物中。工业上,常从冶炼铜的富铼渣(含
)的熔点仅次于钨,是稀有金属之一,地壳中铼的含量极低,多伴生于铜、锌、铅等矿物中。工业上,常从冶炼铜的富铼渣(含 )中提取铼,其工艺流程如图所示:
)中提取铼,其工艺流程如图所示:
(1)矿样粒度与浸出率关系如下图所示,则“浸出”时应将富铼渣粉碎至___________目(填字母)。
(2)已知“浸出”时反应中 转化为两种强酸,写出富铼渣“浸出”时发生反应的离子方程式:
转化为两种强酸,写出富铼渣“浸出”时发生反应的离子方程式:__________________ 。
(3)实验室中,操作Ⅲ所用装置应选用___________(填字母)。
(4)“一系列操作”包括①________ (填操作名称,下同)、冷却结晶、过滤、洗涤和②____________ ;从下列仪器中选出①②中需使用的仪器,依次为______ (填字母)。___________ 法提纯;“热还原”反应中氧化剂与还原剂的物质的量之比为___________ 。
(6)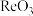 晶胞结构如下图所示,其中氧原子配位数为
晶胞结构如下图所示,其中氧原子配位数为___________ ,铼原子填在了氧原子围成的___________ (填“四面体”“立方体”或“八面体”)空隙中。
 )的熔点仅次于钨,是稀有金属之一,地壳中铼的含量极低,多伴生于铜、锌、铅等矿物中。工业上,常从冶炼铜的富铼渣(含
)的熔点仅次于钨,是稀有金属之一,地壳中铼的含量极低,多伴生于铜、锌、铅等矿物中。工业上,常从冶炼铜的富铼渣(含 )中提取铼,其工艺流程如图所示:
)中提取铼,其工艺流程如图所示: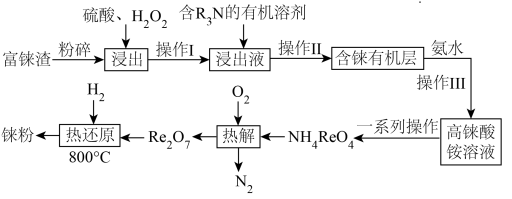
(1)矿样粒度与浸出率关系如下图所示,则“浸出”时应将富铼渣粉碎至___________目(填字母)。
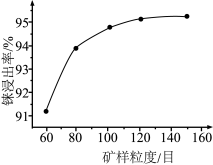
| A.60 | B.80 | C.100 | D.120 |
(2)已知“浸出”时反应中
 转化为两种强酸,写出富铼渣“浸出”时发生反应的离子方程式:
转化为两种强酸,写出富铼渣“浸出”时发生反应的离子方程式:(3)实验室中,操作Ⅲ所用装置应选用___________(填字母)。
A.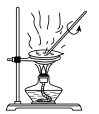 | B.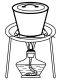 | C. | D. |
(4)“一系列操作”包括①
A. B.
B. C.
C. D.
D.
(6)
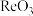 晶胞结构如下图所示,其中氧原子配位数为
晶胞结构如下图所示,其中氧原子配位数为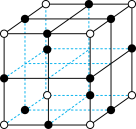
您最近一年使用:0次
2024-03-26更新
|
173次组卷
|
2卷引用:2024届黑龙江省绥化市高三下学期3月联考模拟检测化学试卷
名校
解题方法
6 . 硫氰化钾(KSCN)俗称玫瑰红酸钾,是一种用途广泛的化学药品。实验室模拟工业制备硫氰化钾的实验装置如下图所示:

已知:①CS2不溶于水,密度比水的大;
②NH3不溶于CS2;
③三颈烧瓶内盛放有CS2、水和催化剂。
回答下列问题:
(1)制备NH4SCN溶液:
①实验前,经检验装置的气密性良好。其中装置B中的试剂是___________ 。
②实验开始时,打开K,加热装置A、D,使A中产生的气体缓缓通入D中,发生反应CS2+3NH3 NH4SCN+NH4HS该反应比较缓慢),当看到
NH4SCN+NH4HS该反应比较缓慢),当看到___________ 现象时说明该反应接近完全。
(2)制备KSCN溶液:
①熄灭A处的酒精灯,关闭K2,移开水浴,将装置D继续加热至105℃,当NH4HS完全分解后(NH4HS=H2S↑+NH3↑),打开K2,继续保持液温105℃,缓缓滴入适量的KOH溶液,发生反应的化学方程式为___________ 。
②装置E中多孔球泡的作用是___________ 。
(3)制备KSCN晶体:先滤去三颈烧瓶中的固体催化剂,___________ 、___________ 、过滤、洗涤、干燥,得到硫氰化钾晶体。
(4)测定晶体中KSCN的含量:称取10.0g样品,配成500mL溶液。量取20.00mL溶液于锥形瓶中,加入适量稀硝酸,再加入几滴Fe(NO3)3溶液作指示剂,用0.1000mol/LAgNO3标准溶液滴定,达到滴定终点时消耗AgNO3标准溶液20.00mL。
①滴定时发生的反应:SCN-+Ag+=AgSCN↓(白色)。则判断到达滴定终点的方法是_____ 。
②晶体中KSCN的质量分数为_______ (计算结果精确至0.1%)。
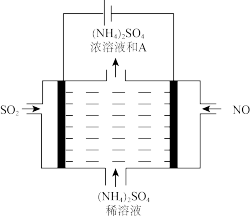
(5)利用电解装置也可进行烟气处理,如图可将雾霾中的NO、SO2分别转化为 和
和 ,阳极的电极反应式为
,阳极的电极反应式为_______ 。

已知:①CS2不溶于水,密度比水的大;
②NH3不溶于CS2;
③三颈烧瓶内盛放有CS2、水和催化剂。
回答下列问题:
(1)制备NH4SCN溶液:
①实验前,经检验装置的气密性良好。其中装置B中的试剂是
②实验开始时,打开K,加热装置A、D,使A中产生的气体缓缓通入D中,发生反应CS2+3NH3
 NH4SCN+NH4HS该反应比较缓慢),当看到
NH4SCN+NH4HS该反应比较缓慢),当看到(2)制备KSCN溶液:
①熄灭A处的酒精灯,关闭K2,移开水浴,将装置D继续加热至105℃,当NH4HS完全分解后(NH4HS=H2S↑+NH3↑),打开K2,继续保持液温105℃,缓缓滴入适量的KOH溶液,发生反应的化学方程式为
②装置E中多孔球泡的作用是
(3)制备KSCN晶体:先滤去三颈烧瓶中的固体催化剂,
(4)测定晶体中KSCN的含量:称取10.0g样品,配成500mL溶液。量取20.00mL溶液于锥形瓶中,加入适量稀硝酸,再加入几滴Fe(NO3)3溶液作指示剂,用0.1000mol/LAgNO3标准溶液滴定,达到滴定终点时消耗AgNO3标准溶液20.00mL。
①滴定时发生的反应:SCN-+Ag+=AgSCN↓(白色)。则判断到达滴定终点的方法是
②晶体中KSCN的质量分数为
(5)利用电解装置也可进行烟气处理,如图可将雾霾中的NO、SO2分别转化为
 和
和 ,阳极的电极反应式为
,阳极的电极反应式为
您最近一年使用:0次
2023-09-25更新
|
148次组卷
|
2卷引用:黑龙江省海伦市第二中学2022-2023学年高三上学期期末考试化学试题
7 . 氨基甲酸铵(NH2COONH4)为白色粉末,易溶于水,难溶于CCl4,水解生成NH4HCO3,受热分解生成CO(NH2)2,是一种优良的氨化剂,其工业制取原理为2NH3(g) +CO2(g) NH2COONH4 (s) ΔH<0。某化学小组模拟工业原理制备少量NH2COONH4,实验装置(夹持仪器及冷却装置已省略)如图所示。
NH2COONH4 (s) ΔH<0。某化学小组模拟工业原理制备少量NH2COONH4,实验装置(夹持仪器及冷却装置已省略)如图所示。

回答下列问题:
(1)装置Ⅰ中胶皮管a的作用为___________ ,仪器 b中发生反应的离子方程式为___________ 。
(2)装置Ⅱ中盛放的试剂为___________ ,若某同学实验时忘记安装装置V,其导致的后果是___________ 。
(3)装置Ⅳ可采取的冷却方式为___________ ,若没有冷却装置会导致氨基甲酸铵的产量降低,其原因是___________ 。
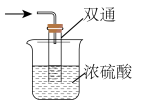
(4)尾气处理装置如图所示,浓硫酸的作用是___________ 。
(5)测量氨基甲酸铵样品的纯度:称取含有NH4HCO3的NH2COONH4样品0.782g,用足量石灰水充分处理后,使碳元素完全转化为CaCO3,过滤、洗涤、干燥,所得固体的质量为1. 000 g。则样品中NH2COONH4的纯度为___________ (保留三位有效数字)。
 NH2COONH4 (s) ΔH<0。某化学小组模拟工业原理制备少量NH2COONH4,实验装置(夹持仪器及冷却装置已省略)如图所示。
NH2COONH4 (s) ΔH<0。某化学小组模拟工业原理制备少量NH2COONH4,实验装置(夹持仪器及冷却装置已省略)如图所示。
回答下列问题:
(1)装置Ⅰ中胶皮管a的作用为
(2)装置Ⅱ中盛放的试剂为
(3)装置Ⅳ可采取的冷却方式为
(4)尾气处理装置如图所示,浓硫酸的作用是

(5)测量氨基甲酸铵样品的纯度:称取含有NH4HCO3的NH2COONH4样品0.782g,用足量石灰水充分处理后,使碳元素完全转化为CaCO3,过滤、洗涤、干燥,所得固体的质量为1. 000 g。则样品中NH2COONH4的纯度为
您最近一年使用:0次
名校
解题方法
8 . “佛尔哈德法”可用于标定硝酸银样品中硝酸银的含量。该方法是以铁铵矾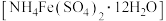 溶液作指示剂,用KSCN标准溶液滴定溶液中的
溶液作指示剂,用KSCN标准溶液滴定溶液中的 。取14.0g硝酸银样品溶于蒸馏水配成500mL待测溶液。取出25.00mL待测溶液置于锥形瓶中,加入硝酸酸化,然后加水稀释至50mL,滴入几滴铁铵矾溶液,用
。取14.0g硝酸银样品溶于蒸馏水配成500mL待测溶液。取出25.00mL待测溶液置于锥形瓶中,加入硝酸酸化,然后加水稀释至50mL,滴入几滴铁铵矾溶液,用 的KSCN标准溶液滴定,消耗标准溶液35.00mL。
的KSCN标准溶液滴定,消耗标准溶液35.00mL。
已知:AgSCN(白色,s) ,
, ;
;
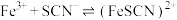 (红色),
(红色), 。
。
回答下列问题:
(1)称量样品时,砝码生锈(锈迹未脱落)会导致测得的硝酸银的含量_______ (填“偏高”“偏低”或“无影响”)。
(2)配制好的待测溶液应置于棕色试剂瓶中,其原因是_______ 。量取25.00mL待测溶液应使用_______ (填“酸式”或“碱式”)滴定管。
(3)滴定反应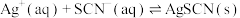 的
的
_______ 。
(4)该滴定不能在中性或碱性条件下进行,因为 会转化为
会转化为_______ (填化学式,下同), 会转化为
会转化为_______ 。
(5)该样品中硝酸银的质量分数为_______ %。
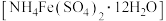 溶液作指示剂,用KSCN标准溶液滴定溶液中的
溶液作指示剂,用KSCN标准溶液滴定溶液中的 。取14.0g硝酸银样品溶于蒸馏水配成500mL待测溶液。取出25.00mL待测溶液置于锥形瓶中,加入硝酸酸化,然后加水稀释至50mL,滴入几滴铁铵矾溶液,用
。取14.0g硝酸银样品溶于蒸馏水配成500mL待测溶液。取出25.00mL待测溶液置于锥形瓶中,加入硝酸酸化,然后加水稀释至50mL,滴入几滴铁铵矾溶液,用 的KSCN标准溶液滴定,消耗标准溶液35.00mL。
的KSCN标准溶液滴定,消耗标准溶液35.00mL。已知:AgSCN(白色,s)
 ,
, ;
;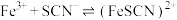 (红色),
(红色), 。
。回答下列问题:
(1)称量样品时,砝码生锈(锈迹未脱落)会导致测得的硝酸银的含量
(2)配制好的待测溶液应置于棕色试剂瓶中,其原因是
(3)滴定反应
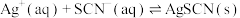 的
的
(4)该滴定不能在中性或碱性条件下进行,因为
 会转化为
会转化为 会转化为
会转化为(5)该样品中硝酸银的质量分数为
您最近一年使用:0次
2023-02-28更新
|
62次组卷
|
2卷引用:黑龙江省海伦市第一中学2022-2023学年高二上学期11月期中考试化学试题
9 . 天津大学化学团队以 和辛胺为原料实现了甲酸和辛腈的高选择性合成,装置工作原理如图(隔膜a只允许
和辛胺为原料实现了甲酸和辛腈的高选择性合成,装置工作原理如图(隔膜a只允许 通过,右池反应无气体生成)。下列说法错误的是
通过,右池反应无气体生成)。下列说法错误的是
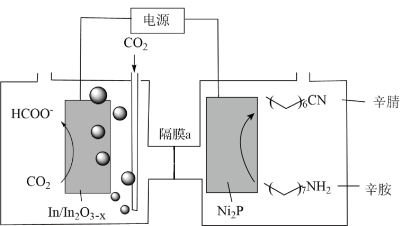
 和辛胺为原料实现了甲酸和辛腈的高选择性合成,装置工作原理如图(隔膜a只允许
和辛胺为原料实现了甲酸和辛腈的高选择性合成,装置工作原理如图(隔膜a只允许 通过,右池反应无气体生成)。下列说法错误的是
通过,右池反应无气体生成)。下列说法错误的是
A. 电极的电势比 电极的电势比 电极的高 电极的高 |
B.阴极发生的电极反应为 |
C.电解过程中, 由 由 电极区向 电极区向 电极区迁移 电极区迁移 |
| D.当电路中有2mol电子转移时,阳极区液体质量增加10g(不考虑气体的溶解) |
您最近一年使用:0次
2023-02-08更新
|
508次组卷
|
5卷引用:黑龙江省绥化市2023届高三下学期4月联合考试理科综合化学试题
黑龙江省绥化市2023届高三下学期4月联合考试理科综合化学试题山东省泰安市2022-2023学年高三上学期1月期末考试化学试题(已下线)2022年重庆高考真题化学试题变式题(选择题11-14)(已下线)山东省青岛市2023届高三下学期一模化学试题变式题(不定项选择题)辽宁省朝阳市2022-2023学年高三上学期1月期末化学试题
名校
解题方法
10 . 铁及其化合物与生产、生活息息相关。回答下列问题:
(1) 易被人体吸收,医生建议在服用该补铁剂时,同时服用维生素C.维生素C的作用是
易被人体吸收,医生建议在服用该补铁剂时,同时服用维生素C.维生素C的作用是_______ 。
(2)印刷电路板的制作原理是用足量的 溶液腐蚀覆铜板上不需要的铜箔。写出上述反应的化学方程式:
溶液腐蚀覆铜板上不需要的铜箔。写出上述反应的化学方程式:_______ 。
(3)生铁是通过高炉冶炼而得到的,以赤铁矿为例用 将其还原的化学方程式为
将其还原的化学方程式为_______ 。
(4)某废料铁泥的主要成分为 、
、 、
、 和杂质(杂质不与硫酸反应)。现取
和杂质(杂质不与硫酸反应)。现取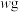 废料铁泥提取
废料铁泥提取 ,设计实验流程如下:
,设计实验流程如下:

①分离溶液A和沉淀C的操作中使用到的玻璃仪器有烧杯、_______ 、_______ 。
②能检验溶液A中含有 的试剂是
的试剂是_______ (填字母)。
A.铁粉 B.酸性 溶液 C.KSCN溶液
溶液 C.KSCN溶液
③步骤Ⅱ中发生反应的离子方程式为_______ 。
④若最终获得 ,则废料铁泥中铁元素的质量分数为
,则废料铁泥中铁元素的质量分数为_______ 。
(1)
 易被人体吸收,医生建议在服用该补铁剂时,同时服用维生素C.维生素C的作用是
易被人体吸收,医生建议在服用该补铁剂时,同时服用维生素C.维生素C的作用是(2)印刷电路板的制作原理是用足量的
 溶液腐蚀覆铜板上不需要的铜箔。写出上述反应的化学方程式:
溶液腐蚀覆铜板上不需要的铜箔。写出上述反应的化学方程式:(3)生铁是通过高炉冶炼而得到的,以赤铁矿为例用
 将其还原的化学方程式为
将其还原的化学方程式为(4)某废料铁泥的主要成分为
 、
、 、
、 和杂质(杂质不与硫酸反应)。现取
和杂质(杂质不与硫酸反应)。现取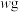 废料铁泥提取
废料铁泥提取 ,设计实验流程如下:
,设计实验流程如下:
①分离溶液A和沉淀C的操作中使用到的玻璃仪器有烧杯、
②能检验溶液A中含有
 的试剂是
的试剂是A.铁粉 B.酸性
 溶液 C.KSCN溶液
溶液 C.KSCN溶液③步骤Ⅱ中发生反应的离子方程式为
④若最终获得
 ,则废料铁泥中铁元素的质量分数为
,则废料铁泥中铁元素的质量分数为
您最近一年使用:0次
2023-01-20更新
|
524次组卷
|
7卷引用:黑龙江省绥化市绥棱县第一中学2023-2024学年高一上学期12月月考化学试题









