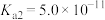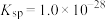名校
1 . 下列各组物质的转化中,不是通过一步反应实现的是
A.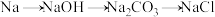 |
B.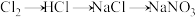 |
C.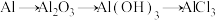 |
D. |
您最近一年使用:0次
名校
解题方法
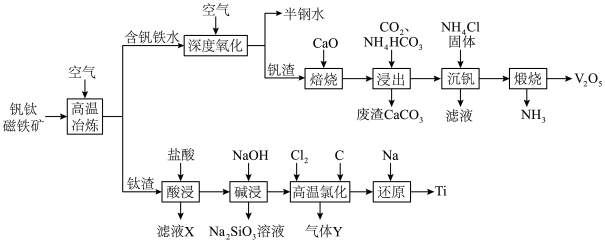
2 . 稀有金属钒和钛在钢铁、化工、航空航天等领域应用广泛。从钒钛磁铁矿中提取钒、钛的工艺流程图如下: 、
、 、
、 和
和 等。
等。
②“高温氯化”后的产物中含少量的 、
、 、
、 、
、 杂质,相关物质的沸点如下表:
杂质,相关物质的沸点如下表:
回答下列问题:
(1)钛在周期表中的位置为___________ ,上述获得钛单质的“还原”工序中需要通入氩气的目的是___________ 。
(2)滤液X中含有的主要金属离子有___________ 。
(3)“高温氯化”工序生成 和一种可燃性气体Y,该反应的化学方程式为
和一种可燃性气体Y,该反应的化学方程式为___________ ; 的粗产品可以通过分馏提纯,但收集的
的粗产品可以通过分馏提纯,但收集的 中总是混有
中总是混有 的原因是
的原因是___________ 。
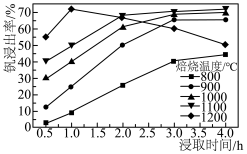
(4)钒的浸出率随焙烧温度和浸取时间的变化如图所示,则“焙烧”时最适合的反应条件为___________ 。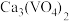 转化成
转化成 进入水相,以便后续沉钒,则“浸出”时反应的离子方程式为
进入水相,以便后续沉钒,则“浸出”时反应的离子方程式为___________ 。
(6)采用USTB工艺电解制备高纯钛,过程以 固体为阳极、碳棒为阴极,
固体为阳极、碳棒为阴极, 熔融盐为电解质。阳极产生
熔融盐为电解质。阳极产生 与
与 ,阴极只发生
,阴极只发生 的还原反应。请写出电池阳极反应的电极反应式:
的还原反应。请写出电池阳极反应的电极反应式:___________ 。
 、
、 、
、 和
和 等。
等。②“高温氯化”后的产物中含少量的
 、
、 、
、 、
、 杂质,相关物质的沸点如下表:
杂质,相关物质的沸点如下表:| 化合物 |  |  |  |  |  |
| 沸点/℃ | 136 | 310 | 56.5 | 180 | 127 |
(1)钛在周期表中的位置为
(2)滤液X中含有的主要金属离子有
(3)“高温氯化”工序生成
 和一种可燃性气体Y,该反应的化学方程式为
和一种可燃性气体Y,该反应的化学方程式为 的粗产品可以通过分馏提纯,但收集的
的粗产品可以通过分馏提纯,但收集的 中总是混有
中总是混有 的原因是
的原因是(4)钒的浸出率随焙烧温度和浸取时间的变化如图所示,则“焙烧”时最适合的反应条件为
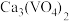 转化成
转化成 进入水相,以便后续沉钒,则“浸出”时反应的离子方程式为
进入水相,以便后续沉钒,则“浸出”时反应的离子方程式为(6)采用USTB工艺电解制备高纯钛,过程以
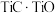 固体为阳极、碳棒为阴极,
固体为阳极、碳棒为阴极, 熔融盐为电解质。阳极产生
熔融盐为电解质。阳极产生 与
与 ,阴极只发生
,阴极只发生 的还原反应。请写出电池阳极反应的电极反应式:
的还原反应。请写出电池阳极反应的电极反应式:
您最近一年使用:0次
2024-04-22更新
|
470次组卷
|
4卷引用:河南省焦作市博爱县第一中学2023-2024学年高三下学期5月月考化学试题
名校
解题方法
3 . 碳酸铈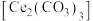 ]是一种稀土材料,工业上常以氟碳铈矿(主要成分为
]是一种稀土材料,工业上常以氟碳铈矿(主要成分为 、
、 、
、 )为原料制备碳酸铈,其工艺流程如图所示:
)为原料制备碳酸铈,其工艺流程如图所示:
①“酸浸”后铈元素主要以 的形式存在;
的形式存在;
② 在空气中易被氧化为
在空气中易被氧化为 ,两者均能形成氢氧化物沉淀。
,两者均能形成氢氧化物沉淀。
(1)“焙烧”时,从焙烧室的底部通入空气的目的是____________________ 。
(2)“滤渣1”的主要成分为__________ 。
(3)“还原”时,加入硫脲( )的目的是将
)的目的是将 还原为
还原为 ,硫脲被氧化为
,硫脲被氧化为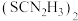 。
。
①该反应的离子方程式为____________________ 。
②硫脲属于__________ (填“极性”或“非极性”)分子,该分子中键角
__________ 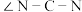 (填“>”“<”或“=”)
(填“>”“<”或“=”)
(4)“碱转酸浸”在加入盐酸后,通常还需加入另一种化学试剂X,根据题中信息推测,加入X的作用为______________________________________________________________________ 。
(5)若“沉淀”后,溶液的pH为6,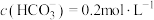 ,此时
,此时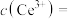
__________ 。已知常温下:
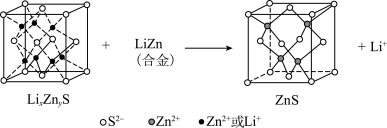
(6)某研究小组利用硫化锌锂电池电解含Ce(Ⅱ)的溶液,可将Ce(Ⅱ)转化为Ce(Ⅳ)。该硫化锌锂电池放电时,负极材料晶胞组成变化如图所示: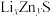 中,
中,
__________ 。
②ZnS晶胞中, 填充在
填充在 构成的部分正四面体空隙中,
构成的部分正四面体空隙中, 和
和 之间的核间距为apm,设
之间的核间距为apm,设 为阿伏加德罗常数的值,则晶体密度为
为阿伏加德罗常数的值,则晶体密度为__________  (列出计算式,ZnS的摩尔质量为
(列出计算式,ZnS的摩尔质量为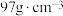 )。
)。
 ]是一种稀土材料,工业上常以氟碳铈矿(主要成分为
]是一种稀土材料,工业上常以氟碳铈矿(主要成分为 、
、 、
、 )为原料制备碳酸铈,其工艺流程如图所示:
)为原料制备碳酸铈,其工艺流程如图所示: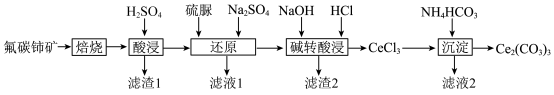
①“酸浸”后铈元素主要以
 的形式存在;
的形式存在;②
 在空气中易被氧化为
在空气中易被氧化为 ,两者均能形成氢氧化物沉淀。
,两者均能形成氢氧化物沉淀。(1)“焙烧”时,从焙烧室的底部通入空气的目的是
(2)“滤渣1”的主要成分为
(3)“还原”时,加入硫脲(
 )的目的是将
)的目的是将 还原为
还原为 ,硫脲被氧化为
,硫脲被氧化为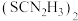 。
。①该反应的离子方程式为
②硫脲属于

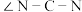 (填“>”“<”或“=”)
(填“>”“<”或“=”)(4)“碱转酸浸”在加入盐酸后,通常还需加入另一种化学试剂X,根据题中信息推测,加入X的作用为
(5)若“沉淀”后,溶液的pH为6,
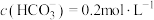 ,此时
,此时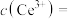
|
| |
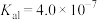 |
|
|
(6)某研究小组利用硫化锌锂电池电解含Ce(Ⅱ)的溶液,可将Ce(Ⅱ)转化为Ce(Ⅳ)。该硫化锌锂电池放电时,负极材料晶胞组成变化如图所示:
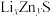 中,
中,
②ZnS晶胞中,
 填充在
填充在 构成的部分正四面体空隙中,
构成的部分正四面体空隙中, 和
和 之间的核间距为apm,设
之间的核间距为apm,设 为阿伏加德罗常数的值,则晶体密度为
为阿伏加德罗常数的值,则晶体密度为 (列出计算式,ZnS的摩尔质量为
(列出计算式,ZnS的摩尔质量为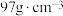 )。
)。
您最近一年使用:0次
2024-04-15更新
|
322次组卷
|
3卷引用:河南省焦作市博爱县第一中2023-2024学年高二下学期4月期中考试化学试题
11-12高二下·甘肃天水·阶段练习
名校
解题方法
4 . 碳化硅的一种晶体(SiC)具有类似金刚石的结构,其中碳原子和硅原子的位置是交替的。下列三种晶体:①金刚石②晶体硅③碳化硅中,它们的熔点由高到低的顺序是
| A.①③② | B.②③① | C.③①② | D.②①③ |
您最近一年使用:0次
2024-04-02更新
|
235次组卷
|
16卷引用:河南省焦作市2022-2023学年第四中学高二下学期期中考试 化学试卷
河南省焦作市2022-2023学年第四中学高二下学期期中考试 化学试卷(已下线)2011-2012学年甘肃省甘谷一中高二下学期第二次月考化学试卷(已下线)2012-2013学年吉林省龙井市三中高二下学期期中考试化学试卷2014-2015福建省漳浦县三校高二下学期期中化学试卷2015-2016学年山西阳泉十五中高三第一次阶段考试化学试卷河北省馆陶县第一中学2016-2017学年高二下学期期中考试化学试题人教版2017-2018学年高二化学选修三同步训练:3.2 分子晶体与原子晶体(第2课时)贵州省遵义市正安县第一中学2018-2019学年高二上学期期中考试化学试题福建省莆田第二十五中学2019-2020学年高二下学期返校考试化学试题江苏省泗阳县众兴中学2020-2021学年高二上学期10月月考化学试题江苏省泗阳县实验高级中学2021-2022学年高二上学期第一次质量调研化学试题宁夏青铜峡市宁朔中学2021-2022学年高二3月月考化学试题云南省蒙自一中2021-2022学年高二下学期3月份考试化学试题福建省莆田第十五中学2021-2022学年高二下学期期中考试化学试题(已下线)第三章章节专项提升(已下线)3.2.2 共价晶体课堂例题
5 . 绿色化学就是改变先污染后治理的观念和做法,利用化学原理和技术手段实现从源头减少或消除环境污染。按照绿色化学的思想,最理想的“原子经济反应”就是反应物的原子全部转化为期望的最终产物。石油化工中丁烷裂解产物A转化为B、E、F、G都符合绿色化学思想,已知A的产量是衡量一个国家石油化工水平的标志。回答下列问题:_______ ;加热条件下,B在铜或银的催化作用下转化为C,C中含有的官能团的结构简式为_______ 。
(2)加热条件下,B和D在浓硫酸的催化作用下经可逆反应可制得G(有淡淡香味的无色透明油状液体),则A+D→G的反应类型是_____ ,G的分子式是______ ,反应方程式为_______ 。
(3)下列说法正确的是_______ 。
①A、B、C均能发生加聚反应生成高分子化合物
②B、D、G均能与Na发生反应
③饱和 溶液能鉴别B、D、G三种物质
溶液能鉴别B、D、G三种物质
④A、B、C中所有原子均共面
(4)G的同分异构体中能与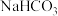 溶液反应产生气泡的有
溶液反应产生气泡的有_______ 种,其结构简式为_______ 。
(5)A在Ag的催化下与氧气进行“原子经济反应”,产物F的分子式为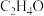 ,则生成F反应的化学方程式为
,则生成F反应的化学方程式为_______ 。
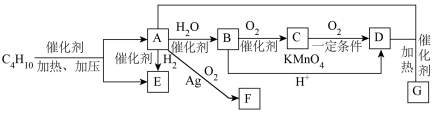
(2)加热条件下,B和D在浓硫酸的催化作用下经可逆反应可制得G(有淡淡香味的无色透明油状液体),则A+D→G的反应类型是
(3)下列说法正确的是
①A、B、C均能发生加聚反应生成高分子化合物
②B、D、G均能与Na发生反应
③饱和
 溶液能鉴别B、D、G三种物质
溶液能鉴别B、D、G三种物质④A、B、C中所有原子均共面
(4)G的同分异构体中能与
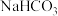 溶液反应产生气泡的有
溶液反应产生气泡的有(5)A在Ag的催化下与氧气进行“原子经济反应”,产物F的分子式为
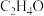 ,则生成F反应的化学方程式为
,则生成F反应的化学方程式为
您最近一年使用:0次
2024-03-30更新
|
394次组卷
|
3卷引用:河南省焦作市博爱县第一中学2023-2024学年高一下学期4月期中考试化学试题
名校
解题方法
6 . 通过化学实验现象得出相应的结论是探究物质性质的一种重要方法,下列实验操作和现象或结论不正确的是
| 选项 | 实验操作和现象 | 结论 |
| A | 向包有足量过氧化钠粉末的脱脂棉上滴加几滴水,脱脂棉燃烧 | 过氧化钠与水反应放热 |
| B | 向某未知溶液(不含 )中加入足量硝酸酸化的硝酸银溶液,无气体产生,但有白色沉淀出现 )中加入足量硝酸酸化的硝酸银溶液,无气体产生,但有白色沉淀出现 | 未知溶液中可能含有Cl-,一定不含CO 或HCO 或HCO |
| C | 氢气在氯气中燃烧时瓶口上方出现白雾 | 氯化氢与空气中的水蒸气结合而呈现雾状 |
| D | 将金属Na投入硫酸铜溶液中,有紫红色固体产生 | 说明Na比Cu活泼 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-03-17更新
|
27次组卷
|
13卷引用:河南省焦作市第一中学2023-2024学年高一上学期1月月考 化学试题
河南省焦作市第一中学2023-2024学年高一上学期1月月考 化学试题河南省名校2022-2023学年高一上学期11月联考化学试题湖南省三湘名校教育联盟2022-2023学年高一上学期期中联考化学试题河南省新密市第一高级中学2022-2023学年高一上学期11月月考化学试题山东省济南外国语学校2022-2023学年高一上学期12月月考化学试题吉林省长春市东北师大附属中学2022-2023学年高一上学期期末考试化学试题山西省朔州市怀仁市第一中学2022-2023学年高一上学期期末考试化学试题吉林省东北师范大学附属中学2022-2023学年高一上学期1月期末考试化学试题江苏省泰州市2023-2024学年高一上学期1月期末化学试题四川省绵阳市东辰学校2023-2024学年高一上学期化学期末复习综合模拟试题黑龙江省哈尔滨市宾县第二中学2023-2024学年高一上学期第三次月考化学试题 河南省郑州钱学森实验学校2023-2024学年高一上学期第二次月考化学试题安徽省淮北市龙兴中学2023-2024学年高一上学期期末化学试卷
名校
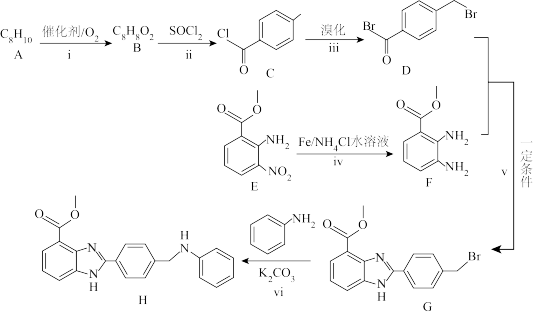
7 . 苯并咪唑类有机物以其独特的结构与性质在新型医药方面具有广泛的应用前景,H属于其中一种,其合成路线如图所示:
(1)A的结构简式为__________ 。E中含氧官能团的名称为_________ 。
(2)反应ⅱ除生成C和SO2外,还有__________ 生成(填化学式)。
(3)反应ⅲ的反应类型为__________ 。
(4)反应ⅳ中另一种产物为Fe3O4,反应ⅳ的化学方程式为__________ 。
(5)苯胺的结构为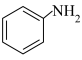 ,
,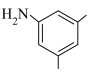 可用系统命名法命名为
可用系统命名法命名为________ 。
(6)反应ⅵ中K2CO3的作用可能是__________ 。
(7)D的同分异构体中,同时满足下列条件的有__________ 种(考虑顺反异构),
①遇FeCl3溶液发生显色反应;②含有碳碳双键;③苯环上有两个取代基。
其中,核磁共振氢谱有四组峰的有__________ 种。
(1)A的结构简式为
(2)反应ⅱ除生成C和SO2外,还有
(3)反应ⅲ的反应类型为
(4)反应ⅳ中另一种产物为Fe3O4,反应ⅳ的化学方程式为
(5)苯胺的结构为
 ,
, 可用系统命名法命名为
可用系统命名法命名为(6)反应ⅵ中K2CO3的作用可能是
(7)D的同分异构体中,同时满足下列条件的有
①遇FeCl3溶液发生显色反应;②含有碳碳双键;③苯环上有两个取代基。
其中,核磁共振氢谱有四组峰的有
您最近一年使用:0次
2024-03-11更新
|
932次组卷
|
5卷引用:2024届河南省焦作市普通高中高三上学期第一次模拟考试理科综合试题-高中化学
2024届河南省焦作市普通高中高三上学期第一次模拟考试理科综合试题-高中化学河南省信阳高级中学2023-2024学年高三下学期3月月考理综试题-高中化学(已下线)第三章 烃的衍生物(B卷)(已下线)大题预测卷(江西专用)-【大题精做】冲刺2024年高考化学大题突破+限时集训(新高考专用)2024届河南省禹州市高级中学高三下学期综合考试(1)理综试题-高中化学
8 . “碳一化学”是指以碳单质或分子中含一个碳原子的物质(如CO、CO2、CH4、CH3OH、HCOOH等)为原料合成工业产品的化学工艺,对开发新能源和控制环境污染有重要意义。回答下列问题:
(1)我国用铜基催化剂,由CO2加氢制甲醇已工业化,部分反应历程如图所示(带*微粒为催化剂表面的吸附物种,氢原子没有全部标出),由CO2*→CH2O*+OH*过程的焓变△H=△H1+△H2+_________ (将结果补充完整,用含E1、E2、E3、E4的代数式表示);理论上,反应历程中消耗的H*与生成的甲醇的物质的量之比为_________ 。 催化重整技术制合成气是研究热点之一,具有广阔的市场前景、经济效应和社会意义,发生的主要反应如下:
催化重整技术制合成气是研究热点之一,具有广阔的市场前景、经济效应和社会意义,发生的主要反应如下:
主反应:
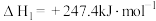
副反应:
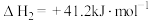
一定温度下,向某2L恒容密闭容器中充入2molCO2和1molCH4,使起始压强为 ,30s后上述主、副反应达到平衡,此时测得CO的物质的量为1.7mol,H2O的物质的量为0.1mol。
,30s后上述主、副反应达到平衡,此时测得CO的物质的量为1.7mol,H2O的物质的量为0.1mol。
①平衡时的总压强为_________ (用含 的代数式表示)。
的代数式表示)。
②在0~30s内,用CO2表示的平均反应速率
_________  。
。
③该温度下,副反应的压强平衡常数
___________ (用分数表示)。
(3)一定条件下,水气变换反应: 的中间产物是HCOOH。温度为T0℃时,在密封石英管内充满0.1mol·L-1HCOOH水溶液,HCOOH(aq)的分解反应如下(分解产物均完全溶于水):
的中间产物是HCOOH。温度为T0℃时,在密封石英管内充满0.1mol·L-1HCOOH水溶液,HCOOH(aq)的分解反应如下(分解产物均完全溶于水):
i.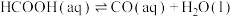
 (快反应);
(快反应);
ⅱ.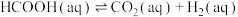
 (慢反应)。
(慢反应)。
研究发现,H+仅对反应i有催化加速作用,反应i速率远大于反应ⅱ,故近似认为反应i建立平衡后始终处于平衡状态。忽略水的电离,其浓度视为常数。
①部分物质浓度与反应时间的变化关系如图所示,试推测CO的浓度随反应时间的变化趋势是____________ (填字母),其理由是___________ (忽略碳元素的其他存在形式)。
A.增大 B.减小 C.先增大后减小 D.先减小后增大___________ (填“增大”“减小”或“不变”)。
(1)我国用铜基催化剂,由CO2加氢制甲醇已工业化,部分反应历程如图所示(带*微粒为催化剂表面的吸附物种,氢原子没有全部标出),由CO2*→CH2O*+OH*过程的焓变△H=△H1+△H2+

 催化重整技术制合成气是研究热点之一,具有广阔的市场前景、经济效应和社会意义,发生的主要反应如下:
催化重整技术制合成气是研究热点之一,具有广阔的市场前景、经济效应和社会意义,发生的主要反应如下:主反应:

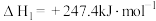
副反应:

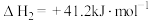
一定温度下,向某2L恒容密闭容器中充入2molCO2和1molCH4,使起始压强为
 ,30s后上述主、副反应达到平衡,此时测得CO的物质的量为1.7mol,H2O的物质的量为0.1mol。
,30s后上述主、副反应达到平衡,此时测得CO的物质的量为1.7mol,H2O的物质的量为0.1mol。①平衡时的总压强为
 的代数式表示)。
的代数式表示)。②在0~30s内,用CO2表示的平均反应速率

 。
。③该温度下,副反应的压强平衡常数

(3)一定条件下,水气变换反应:
 的中间产物是HCOOH。温度为T0℃时,在密封石英管内充满0.1mol·L-1HCOOH水溶液,HCOOH(aq)的分解反应如下(分解产物均完全溶于水):
的中间产物是HCOOH。温度为T0℃时,在密封石英管内充满0.1mol·L-1HCOOH水溶液,HCOOH(aq)的分解反应如下(分解产物均完全溶于水):i.
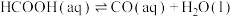
 (快反应);
(快反应);ⅱ.
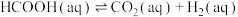
 (慢反应)。
(慢反应)。研究发现,H+仅对反应i有催化加速作用,反应i速率远大于反应ⅱ,故近似认为反应i建立平衡后始终处于平衡状态。忽略水的电离,其浓度视为常数。
①部分物质浓度与反应时间的变化关系如图所示,试推测CO的浓度随反应时间的变化趋势是
A.增大 B.减小 C.先增大后减小 D.先减小后增大

您最近一年使用:0次
2024-03-11更新
|
230次组卷
|
5卷引用:2024届河南省焦作市普通高中高三上学期第一次模拟考试理科综合试题-高中化学
名校
解题方法
9 . 已知下列反应的平衡常数: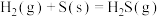 ,
, ;
; ,
, ;则反应
;则反应 的平衡常数是
的平衡常数是
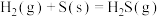 ,
, ;
; ,
, ;则反应
;则反应 的平衡常数是
的平衡常数是A. | B. | C. | D.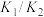 |
您最近一年使用:0次
2024-03-05更新
|
172次组卷
|
65卷引用:河南省焦作市博爱县第一中学2023-2024学年高三上学期9月月考化学试题
河南省焦作市博爱县第一中学2023-2024学年高三上学期9月月考化学试题2016届湖南省衡阳县第四中学高三9月月考试化学试卷2015-2016学年内蒙古巴彦淖尔高二上10月月考化学试卷2015-2016学年重庆市第一中学高二上期中测试化学试卷2015-2016学年吉林省松原市油田高中高一下期末化学试卷2016-2017学年四川省成都外国语学校高二上10月月考化学试卷辽宁省庄河市高级中学2016-2017学年高一下学期期末考试化学试题陕西省渭南市尚德中学2017-2018学年高二第一次教学质量检测化学试题甘肃省兰州第一中学2017-2018学年高二上学期期中考试化学(理)试题湖南省娄底市第四中学2018-2019学年高二上学期10月月考化学试题江西省九江市同文中学2018-2019学年高二上学期期中考试化学试题【全国百强校】内蒙古自治区杭锦后旗奋斗中学2018-2019学年高二上学期期末考试化学试题四川省遂宁市2018-2019学年高二下学期期末考试化学试题(已下线)2019年9月16日《每日一题》选修4—— 化学平衡常数甘肃省甘谷第一中学2019-2020学年高二上学期第一次月考化学试题山东省日照市第一中学2019-2020学年高二10月月考化学试题吉林省吉化第一高级中学校2019-2020学年高二9月月考化学试题新疆乌鲁木齐市第四中学2019-2020学年高二上学期期中考试化学试题广东省梅州市水寨中学2019-2020学年高二上学期期中考试化学试题湖南省长沙市长郡中学2019-2020学年高二上学期期中考试化学试题安徽省黄山市“八校联盟”2019-2020学年高二上学期期中考试化学试题四川省自贡市田家炳中学2019-2020学年高二下学期开学考试化学试题(已下线)【南昌新东方】江西省九江市同文中学2018-2019学年高二上学期期中考试化学试题安徽省亳州市涡阳县第九中学2019-2020学年高一7月月考化学试题广东省广州大学附属中学2019-2020学年高一下学期期末考试化学试题广东省广州大学附属中学等三校2019~2020学年高一下学期期末联考化学试题福建省泰宁第一中学2019-2020学年高二上学期第一阶段考试化学(选考)试题(已下线)2.3.3+化学平衡常数-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)(已下线)2.3.3化学平衡常数(重点练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)安徽省舒城中学2020-2021学年高二上学期第二次月考化学试题河北省鸡泽县第一中学2020-2021学年高二上学期第一次月考化学试题河北省张家口市宣化区宣化第一中学2020-2021学年高二上学期10月月考化学试题黑龙江省伊春市伊美区第二中学2020-2021学年高二上学期第一次月考化学试题辽宁省大连市一〇三中学2020-2021学年高二10月月考化学试题鲁科版(2019)高二选择性必修第一册第2章 化学反应的方向、限度与速率 第2节 化学反应的限度课时1 化学平衡常数 平衡转化率人教版(2019)高二化学选择性必修1第二章 化学反应速率与化学平衡 第二节 化学平衡 课时2 化学平衡常数及相关计算(已下线)【浙江新东方】绍兴qw122选择性必修1(SJ)专题2第二单元课时3 化学平衡常数平衡转化率(已下线)第20讲 化学平衡常数及转化率的计算(练) — 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)考向23 化学平衡常数及其应用-备战2022年高考化学一轮复习考点微专题湖南省武冈市第二中学2021-2022学年高二上学期开学摸底考试化学试题天津市武清区梅厂中学2021-2022学年高二上学期阶段性练习化学试题黑龙江省绥化市望奎县第一中学2021-2022学年高二上学期第一次月考化学试题江苏省盐城市实验高级中学(新洋高级中学)2020-2021学年高二下学期期中考试化学试题(已下线)2.2.3 化学平衡常数(备作业)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)重庆市清华中学校2021—2022学年上学期高二10月月考化学试题福建省福州黎明中学2021-2022学年高二上学期期中考试化学试题(已下线)第27练 化学平衡-2023年高考化学一轮复习小题多维练(全国通用)广东省揭阳华侨高级中学2021-2022学年高二上学期第一次阶段考试化学试题(已下线)2.2.1 化学平衡状态 化学平衡常数 -2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)山东省济宁市泗水县2021-2022学年高二上学期期中考试化学试题广西柳州市第三中学2022-2023学年高二上学期10月月考化学试题陕西省宝鸡市千阳县中学2022-2023学年高二上学期第一次月考(理)化学试题福建省建瓯市芝华中学2021-2022学年高二上学期期中考试化学试题福建省建瓯市芝华中学2022-2023学年高二上学期期中考试化学试题福建省福州第十五中学2022-2023学年高二上学期11月线上限时训练化学试题2.2.3化学平衡常数 课中第二章 化学反应速率与化学平衡 第二节 化学平衡 第2课时 化学平衡常数河北省石家庄市第四十二中学2023-2024学年高二上学期第一次月考化学试题(已下线)第3讲 化学平衡计算 平衡常数甘肃省兰州市教育局第四片区联考2023-2024学年高二上学期期中考试化学试题黑龙江省佳木斯市四校联考2023-2024学年高二上学期11月期中化学考试试题广东省台山市某校2023-2024学年高二上学期期中考试化学试题甘肃省武威市民勤县第一中学2023-2024学高二下学期开学考试化学试题湖南省衡阳县第四中学2023-2024学年高二上学期11月期中化学试题
名校
10 . 下列有关乙醇的物理性质的应用不正确的是
| A.由于乙醇的密度比水小,故乙醇中的水可以通过分液的方法除去 |
| B.由于乙醇能够溶解很多有机物和无机物,故可用乙醇提取中药的有效成分 |
| C.由于乙醇能够以任意比溶解于水中,故酒厂可以勾兑各种浓度的酒 |
| D.由于乙醇容易挥发,故有“酒香不怕巷子深”的说法 |
您最近一年使用:0次
2024-03-01更新
|
516次组卷
|
5卷引用:河南省焦作市博爱县第一中学2023-2024学年高二下学期开学化学试题