名校
1 . 氯化亚铁在冶金、医药制造、媒染剂等方面有着较为广泛的用途,氯化亚铁可以对许多分子进行激活反应,成为一种新型“明星分子”。回答下列问题:
(1)由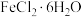 固体粗略配制
固体粗略配制 溶液,称取
溶液,称取___________ g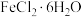 固体在
固体在___________ (填试剂)中溶解后,加水稀释为 ,最后加入少量铁粉。
,最后加入少量铁粉。
(2)“无汞定铁法”标定 溶液浓度:
溶液浓度:
①将___________ (填酸式或碱式)滴定管先水洗,再润洗,最后盛装 标准
标准 溶液,其下一步操作是
溶液,其下一步操作是___________ ,……正确安装滴定管。
②用移液管准确量取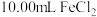 溶液注入锥形瓶中,并加入
溶液注入锥形瓶中,并加入 硫酸和几滴二苯胺磺酸钠。二苯胺磺酸钠的作用是
硫酸和几滴二苯胺磺酸钠。二苯胺磺酸钠的作用是___________ 。
③用 标准溶液滴定,当锥形瓶中溶液颜色从绿色变为紫红色即为滴定终点,平行滴定三次,平均消耗
标准溶液滴定,当锥形瓶中溶液颜色从绿色变为紫红色即为滴定终点,平行滴定三次,平均消耗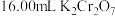 标准溶液,写出滴定反应的离子方程式
标准溶液,写出滴定反应的离子方程式___________ 。 溶液的标定浓度为
溶液的标定浓度为___________ 。
(3)取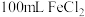 溶液加热、蒸干、灼烧至质量不变。固体质量为
溶液加热、蒸干、灼烧至质量不变。固体质量为___________ 。
(4)已知:亚硫酰氯( )沸点为
)沸点为 ,遇水极易水解。实验室利用
,遇水极易水解。实验室利用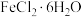 固体和亚硫酰氯(
固体和亚硫酰氯( )制备新型“明星分子”
)制备新型“明星分子” 固体的装置如下图所示:
固体的装置如下图所示: 后,先加热装置
后,先加热装置___________ (填“a”或“b”)。
②装置c、d连接在一起共同起到的作用___________ 。
③硬质玻璃试管b中发生反应的化学方程式___________ 。
④装置e中试剂为 的酸性
的酸性 溶液,发生反应的离子方程式为
溶液,发生反应的离子方程式为___________ 。
(1)由
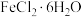 固体粗略配制
固体粗略配制 溶液,称取
溶液,称取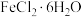 固体在
固体在 ,最后加入少量铁粉。
,最后加入少量铁粉。(2)“无汞定铁法”标定
 溶液浓度:
溶液浓度:①将
 标准
标准 溶液,其下一步操作是
溶液,其下一步操作是②用移液管准确量取
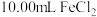 溶液注入锥形瓶中,并加入
溶液注入锥形瓶中,并加入 硫酸和几滴二苯胺磺酸钠。二苯胺磺酸钠的作用是
硫酸和几滴二苯胺磺酸钠。二苯胺磺酸钠的作用是③用
 标准溶液滴定,当锥形瓶中溶液颜色从绿色变为紫红色即为滴定终点,平行滴定三次,平均消耗
标准溶液滴定,当锥形瓶中溶液颜色从绿色变为紫红色即为滴定终点,平行滴定三次,平均消耗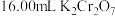 标准溶液,写出滴定反应的离子方程式
标准溶液,写出滴定反应的离子方程式 溶液的标定浓度为
溶液的标定浓度为(3)取
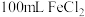 溶液加热、蒸干、灼烧至质量不变。固体质量为
溶液加热、蒸干、灼烧至质量不变。固体质量为(4)已知:亚硫酰氯(
 )沸点为
)沸点为 ,遇水极易水解。实验室利用
,遇水极易水解。实验室利用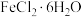 固体和亚硫酰氯(
固体和亚硫酰氯( )制备新型“明星分子”
)制备新型“明星分子” 固体的装置如下图所示:
固体的装置如下图所示: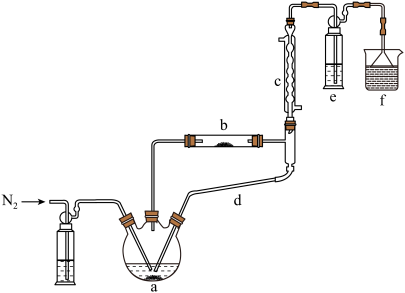
 后,先加热装置
后,先加热装置②装置c、d连接在一起共同起到的作用
③硬质玻璃试管b中发生反应的化学方程式
④装置e中试剂为
 的酸性
的酸性 溶液,发生反应的离子方程式为
溶液,发生反应的离子方程式为
您最近一年使用:0次
2024-05-18更新
|
220次组卷
|
2卷引用:河南省焦作市博爱县第一中学2023-2024学年高三下学期5月月考化学试题
名校
解题方法
2 . X、Y、Z、W、Q为原子半径依次增大的短周期主族元素,基态Y原子核外电子排布的L层中只有两对成对电子,基态W原子核外s能级和p能级电子数相等,基态Z原子核外电子的空间运动状态数比基态W原子多2。下列说法一定正确的是
| A.第一电离能:W>Z>Q |
| B.Q与X形成的化合物一定是离子化合物 |
| C.工业上通过电解W和Y形成的化合物来制得W单质 |
| D.元素电负性:X>Y>Z |
您最近一年使用:0次
2024-05-16更新
|
193次组卷
|
2卷引用:河南省焦作市博爱县第一中学2023-2024学年高三下学期5月月考化学试题
名校
3 . 废旧磷酸铁锂电池中电极片主要由 、铝箔、少量铜及炭黑组成,回收
、铝箔、少量铜及炭黑组成,回收 、
、 的具体流程如下:
的具体流程如下: 溶于酸,不溶于碱;
溶于酸,不溶于碱; 、
、 在常温下的溶解度分别为
在常温下的溶解度分别为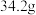 、
、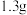 。
。
下列说法错误的是
 、铝箔、少量铜及炭黑组成,回收
、铝箔、少量铜及炭黑组成,回收 、
、 的具体流程如下:
的具体流程如下: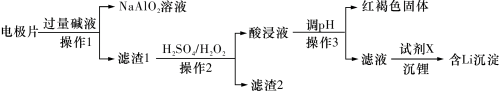
 溶于酸,不溶于碱;
溶于酸,不溶于碱; 、
、 在常温下的溶解度分别为
在常温下的溶解度分别为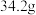 、
、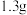 。
。下列说法错误的是
A. 中基态亚铁离子的电子排布式: 中基态亚铁离子的电子排布式: |
B.滤渣1中加入 和 和 可发生反应: 可发生反应: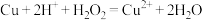 |
C.“调 ”和“沉锂”两个步骤都可以使用 ”和“沉锂”两个步骤都可以使用 ,但试剂的作用不同 ,但试剂的作用不同 |
| D.甲烷和三氧化硫都是由极性键构成的非极性分子 |
您最近一年使用:0次
2024-05-06更新
|
118次组卷
|
3卷引用:河南省焦作市博爱县第一中2023-2024学年高二下学期4月期中考试化学试题
名校
解题方法
4 . 常温下,下列关于电解质溶液的说法正确的是
| A.pH=12的氨水和氢氧化钠溶液按体积比1∶9混合后,pH值增大 |
B.等体积、等浓度的Na2CO3和NaHCO3溶液混合后,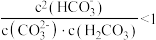 |
C.0.2mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合后存在: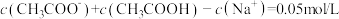 |
D.等浓度的氨水和硫酸按体积比3∶1混合后溶液显碱性,则混合溶液中存在: |
您最近一年使用:0次
2024-05-06更新
|
170次组卷
|
2卷引用:河南省焦作市博爱县第一中2023-2024学年高二下学期4月期中考试化学试题
名校
解题方法
5 . 某研究性学习小组进行某补血剂中铁元素( 价)含量测定的实验,其流程如下:
价)含量测定的实验,其流程如下:不 正确的是
 价)含量测定的实验,其流程如下:
价)含量测定的实验,其流程如下: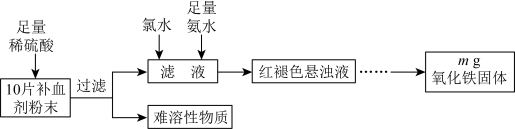
A.向过滤后的滤液中滴加 溶液,溶液可能呈红色 溶液,溶液可能呈红色 |
B.可以用 替代上述流程中的氯水 替代上述流程中的氯水 |
| C.红褐色悬浊液经过滤、洗涤、干燥,得到氧化铁固体 |
D.每片补血剂中铁元素的质量为 |
您最近一年使用:0次
2024-05-06更新
|
300次组卷
|
3卷引用:河南省焦作市博爱县第一中2023-2024学年高二下学期4月期中考试化学试题
解题方法
6 . 三草酸合铁酸钾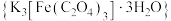 是制备铁触媒上的主要原料。在光照下分解:
是制备铁触媒上的主要原料。在光照下分解: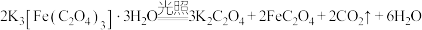 。回答下列问题:
。回答下列问题:
(1)基态 原子的电子排布式为
原子的电子排布式为___________ ,基态 与
与 中未成对电子的数目之比为
中未成对电子的数目之比为___________ 。
(2)三草酸合铁酸钾所含元素中,第一电离能最大的是___________ (填元素符号,下同),电负性最大的是___________ 。
(3)1个 与1个
与1个 分子中
分子中 键数目之比为
键数目之比为___________ , 分子的立体构型为
分子的立体构型为___________ 。
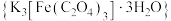 是制备铁触媒上的主要原料。在光照下分解:
是制备铁触媒上的主要原料。在光照下分解: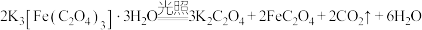 。回答下列问题:
。回答下列问题:(1)基态
 原子的电子排布式为
原子的电子排布式为 与
与 中未成对电子的数目之比为
中未成对电子的数目之比为(2)三草酸合铁酸钾所含元素中,第一电离能最大的是
(3)1个
 与1个
与1个 分子中
分子中 键数目之比为
键数目之比为 分子的立体构型为
分子的立体构型为
您最近一年使用:0次
解题方法
7 . 含硼物质在生产生活中有着广泛应用。回答下列问题:
(1)一种BN晶体硬度仅次于金刚石,是一种超硬材料,常用作刀具材料和磨料。该BN晶体属于_______ 晶体,熔点比晶体硼_______ (填“高”或“低”)。
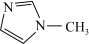
(2)N-甲基咪唑的结构为 ,它的某种衍生物与
,它的某种衍生物与 形成的离子化合物
形成的离子化合物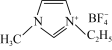 是离子液体。离子液体是在室温和接近室温时呈液态的盐类物质,由于其具有良好的化学稳定性,较低的熔点和良好的溶解性,应用越来越广泛。
是离子液体。离子液体是在室温和接近室温时呈液态的盐类物质,由于其具有良好的化学稳定性,较低的熔点和良好的溶解性,应用越来越广泛。
(1)一种BN晶体硬度仅次于金刚石,是一种超硬材料,常用作刀具材料和磨料。该BN晶体属于
(2)N-甲基咪唑的结构为
 ,它的某种衍生物与
,它的某种衍生物与 形成的离子化合物
形成的离子化合物 是离子液体。离子液体是在室温和接近室温时呈液态的盐类物质,由于其具有良好的化学稳定性,较低的熔点和良好的溶解性,应用越来越广泛。
是离子液体。离子液体是在室温和接近室温时呈液态的盐类物质,由于其具有良好的化学稳定性,较低的熔点和良好的溶解性,应用越来越广泛。①离子化合物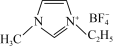 熔点低的原因是
熔点低的原因是
②分子中的大π键可用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 )。
)。 中存在大π键,其分子中的大π键可表示为
中存在大π键,其分子中的大π键可表示为
③1mol离子化合物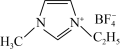 中,阿伏加德罗常数的值为
中,阿伏加德罗常数的值为 ,则根据价电子对互斥(
,则根据价电子对互斥( )理论,空间结构为四面体的原子共有
)理论,空间结构为四面体的原子共有
您最近一年使用:0次
解题方法
8 . 下列分子中,键能最小的是
| A.F2 | B.Br2 | C.Cl2 | D.N2 |
您最近一年使用:0次
解题方法
9 . 镁、铜等金属离子是人体内多种酶的辅因子。工业上从海水中提取镁时,先制备无水氯化镁,然后将其熔融电解,得到金属镁。
(1)以MgCl2为原料用熔融盐电解法制备镁时,常加入NaCl、KCl或CaCl2等金属氯化物,其主要作用除了降低熔点之外还有___________ 。
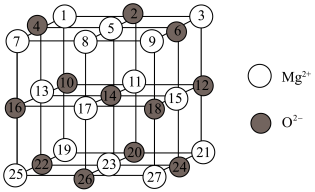
(2)已知MgO的晶体结构属于NaCl型。某同学画出的MgO晶胞结构示意图如下图所示,请改正图中错误:___________ 。___________ 。
(4)Mg是第三周期元素,该周期部分元素氟化物的熔点见下表:
解释表中氟化物熔点差异的原因:___________ 。
(5)人工模拟是当前研究的热点。有研究表明,化合物X可用于研究模拟酶,当其结合 或Cu(I)(I表示化合价为+1)时,分别形成a和b:
或Cu(I)(I表示化合价为+1)时,分别形成a和b:___________ 键的特性。
②微粒间的相互作用包括化学键和分子间相互作用,比较a和b中微粒间相互作用力的差异___________ 。
(1)以MgCl2为原料用熔融盐电解法制备镁时,常加入NaCl、KCl或CaCl2等金属氯化物,其主要作用除了降低熔点之外还有
(2)已知MgO的晶体结构属于NaCl型。某同学画出的MgO晶胞结构示意图如下图所示,请改正图中错误:
(4)Mg是第三周期元素,该周期部分元素氟化物的熔点见下表:

| 氧化物 | NaF | MgF2 | SiF4 |
| 熔点/K | 1266 | 1534 | 183 |
(5)人工模拟是当前研究的热点。有研究表明,化合物X可用于研究模拟酶,当其结合
 或Cu(I)(I表示化合价为+1)时,分别形成a和b:
或Cu(I)(I表示化合价为+1)时,分别形成a和b: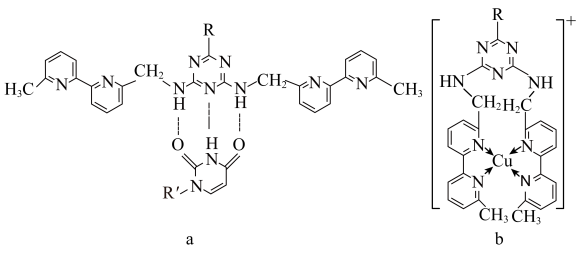
②微粒间的相互作用包括化学键和分子间相互作用,比较a和b中微粒间相互作用力的差异
您最近一年使用:0次
10 . 下列陈述I和陈述Ⅱ均正确,且具有因果关系的是
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | HCl的酸性强于CH3COOH | 盐酸的pH一定小于醋酸溶液 |
| B | 通过煤的干馏可获得苯、甲苯等化工原料 | 煤的干馏属于化学变化 |
| C | 将Cl2通入溴水中,溴水褪色 | Cl2具有漂白性 |
| D | 将金属Na加入CuSO4溶液中,析出红色固体 | 还原性:Na>Cu |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-04-23更新
|
854次组卷
|
2卷引用:2024届河南省焦作市博爱县第一中学高三下学期三模化学试题



