解题方法
1 . 某校化学兴趣小组为研究 的性质,设计如图所示装置进行实验。装置D中夹持装置已略去,其中a为干燥的红色布条,b为湿润的红色布条。回答下列问题:
的性质,设计如图所示装置进行实验。装置D中夹持装置已略去,其中a为干燥的红色布条,b为湿润的红色布条。回答下列问题:_________ 。写出装置A中发生反应的化学方程式:_________ 。
(2)装置B的作用是_________ 。
(3)装置C的作用是________ ,可选用的试剂是_______ (填字母)。
a. 溶液 b.
溶液 b. 溶液 c.碱石灰 d.浓硫酸
溶液 c.碱石灰 d.浓硫酸
(4)装置D中的实验现象为________ 。
(5)若产生 足量,实验过程中装置E中的实验现象是
足量,实验过程中装置E中的实验现象是_________ 。
(6)有一种“地康法”制取氯气的反应原理如图所示:______ (填“是”或“不是”)氧化还原反应。
②在450℃条件下,反应Ⅱ的化学方程式为_____ 。
 的性质,设计如图所示装置进行实验。装置D中夹持装置已略去,其中a为干燥的红色布条,b为湿润的红色布条。回答下列问题:
的性质,设计如图所示装置进行实验。装置D中夹持装置已略去,其中a为干燥的红色布条,b为湿润的红色布条。回答下列问题:
(2)装置B的作用是
(3)装置C的作用是
a.
 溶液 b.
溶液 b. 溶液 c.碱石灰 d.浓硫酸
溶液 c.碱石灰 d.浓硫酸(4)装置D中的实验现象为
(5)若产生
 足量,实验过程中装置E中的实验现象是
足量,实验过程中装置E中的实验现象是(6)有一种“地康法”制取氯气的反应原理如图所示:

②在450℃条件下,反应Ⅱ的化学方程式为
您最近一年使用:0次
名校
解题方法
2 . 几种短周期主族元素的原子半径及化合价见下表,下列说法正确的是
| 元素代号 | A | B | C | D | E | F |
| 化合价 | -2 | +4.-4 | -1 | +5.-3 | +3 | +1 |
| 原子半径/nm | 0.074 | 0.077 | 0.099 | 0.110 | 0.143 | 0.186 |
| A.A元素为氧元素,F元素为钾元素 |
| B.A元素与F元素形成的化合物中只含有共价键 |
| C.C、D的简单离子半径由大到小的顺序是C>D |
D.由上表信息可推测氮元素的原子半径:0.074nm 0.077nm 0.077nm |
您最近一年使用:0次
2024-01-13更新
|
269次组卷
|
5卷引用:广西北海市2023-2024学年高一上学期期末考试化学试题
3 .  催化重整对温室气体的减排具有重要意义,其反应为:
催化重整对温室气体的减排具有重要意义,其反应为: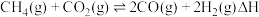 。回答下列问题:
。回答下列问题:
(1)已知相关物质的燃烧热(
 ):
):
则 催化重整反应的
催化重整反应的
_______  。
。
(2)将原料按初始组成
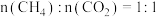 充入密闭容器中,保持体系压强为
充入密闭容器中,保持体系压强为
 发生反应。达到平衡时,
发生反应。达到平衡时,
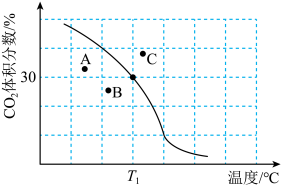
 体积分数与温度的关系如图所示。
体积分数与温度的关系如图所示。
①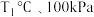 下,n(平衡时气体):n(初始气体)=
下,n(平衡时气体):n(初始气体)=_______ 。该温度下,此反应的平衡常数
_______ 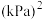 (以分压表示,分压=总压强×气体成分的物质的量分数。保留1位小数)。
(以分压表示,分压=总压强×气体成分的物质的量分数。保留1位小数)。
②若A、B、C三点表示不同温度和压强下达到平衡时 的体积分数,则
的体积分数,则_______ 点对应的平衡常数最小,理由是_______ 。
(3)其他条件相同,在不同催化剂(A、B)作用下,反应
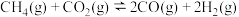 进行相同时间后,
进行相同时间后,
 的产率随反应温度的变化如图所示。
的产率随反应温度的变化如图所示。

①在催化剂A、B作用下,它们正、逆反应活化能差值分别用 表示,则
表示,则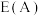
_______ 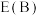 (填“>”“<”或“=”,下同)。
(填“>”“<”或“=”,下同)。
②y点对应的
_______ z点对应的 。
。
(4) 和
和
 都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示:
都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示:
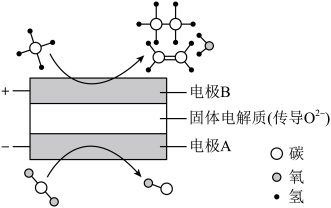
①阴极的电极反应式为_______ 。
②若生成的乙烯和乙烷的体积比为 ,则消耗的
,则消耗的 和
和 的体积比为
的体积比为_______ 。
 催化重整对温室气体的减排具有重要意义,其反应为:
催化重整对温室气体的减排具有重要意义,其反应为: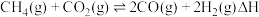 。回答下列问题:
。回答下列问题:(1)已知相关物质的燃烧热(
 ):
):| 物质 | 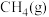 | 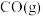 |  |
燃烧热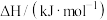 |  |  |  |
 催化重整反应的
催化重整反应的
 。
。(2)将原料按初始组成
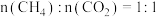 充入密闭容器中,保持体系压强为
充入密闭容器中,保持体系压强为 发生反应。达到平衡时,
发生反应。达到平衡时, 体积分数与温度的关系如图所示。
体积分数与温度的关系如图所示。
①
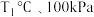 下,n(平衡时气体):n(初始气体)=
下,n(平衡时气体):n(初始气体)=
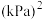 (以分压表示,分压=总压强×气体成分的物质的量分数。保留1位小数)。
(以分压表示,分压=总压强×气体成分的物质的量分数。保留1位小数)。②若A、B、C三点表示不同温度和压强下达到平衡时
 的体积分数,则
的体积分数,则(3)其他条件相同,在不同催化剂(A、B)作用下,反应
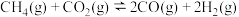 进行相同时间后,
进行相同时间后, 的产率随反应温度的变化如图所示。
的产率随反应温度的变化如图所示。
①在催化剂A、B作用下,它们正、逆反应活化能差值分别用
 表示,则
表示,则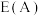
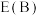 (填“>”“<”或“=”,下同)。
(填“>”“<”或“=”,下同)。②y点对应的

 。
。(4)
 和
和 都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示:
都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示:
①阴极的电极反应式为
②若生成的乙烯和乙烷的体积比为
 ,则消耗的
,则消耗的 和
和 的体积比为
的体积比为
您最近一年使用:0次
2023-10-29更新
|
681次组卷
|
4卷引用:广西北海市2024届高三一模考试化学试题
名校
解题方法
4 . 铁及其化合物与生产、生活息息相关。回答下列问题:
(1) 易被人体吸收,医生建议在服用该补铁剂时,同时服用维生素C.维生素C的作用是
易被人体吸收,医生建议在服用该补铁剂时,同时服用维生素C.维生素C的作用是_______ 。
(2)印刷电路板的制作原理是用足量的 溶液腐蚀覆铜板上不需要的铜箔。写出上述反应的化学方程式:
溶液腐蚀覆铜板上不需要的铜箔。写出上述反应的化学方程式:_______ 。
(3)生铁是通过高炉冶炼而得到的,以赤铁矿为例用 将其还原的化学方程式为
将其还原的化学方程式为_______ 。
(4)某废料铁泥的主要成分为 、
、 、
、 和杂质(杂质不与硫酸反应)。现取
和杂质(杂质不与硫酸反应)。现取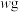 废料铁泥提取
废料铁泥提取 ,设计实验流程如下:
,设计实验流程如下:

①分离溶液A和沉淀C的操作中使用到的玻璃仪器有烧杯、_______ 、_______ 。
②能检验溶液A中含有 的试剂是
的试剂是_______ (填字母)。
A.铁粉 B.酸性 溶液 C.KSCN溶液
溶液 C.KSCN溶液
③步骤Ⅱ中发生反应的离子方程式为_______ 。
④若最终获得 ,则废料铁泥中铁元素的质量分数为
,则废料铁泥中铁元素的质量分数为_______ 。
(1)
 易被人体吸收,医生建议在服用该补铁剂时,同时服用维生素C.维生素C的作用是
易被人体吸收,医生建议在服用该补铁剂时,同时服用维生素C.维生素C的作用是(2)印刷电路板的制作原理是用足量的
 溶液腐蚀覆铜板上不需要的铜箔。写出上述反应的化学方程式:
溶液腐蚀覆铜板上不需要的铜箔。写出上述反应的化学方程式:(3)生铁是通过高炉冶炼而得到的,以赤铁矿为例用
 将其还原的化学方程式为
将其还原的化学方程式为(4)某废料铁泥的主要成分为
 、
、 、
、 和杂质(杂质不与硫酸反应)。现取
和杂质(杂质不与硫酸反应)。现取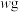 废料铁泥提取
废料铁泥提取 ,设计实验流程如下:
,设计实验流程如下:
①分离溶液A和沉淀C的操作中使用到的玻璃仪器有烧杯、
②能检验溶液A中含有
 的试剂是
的试剂是A.铁粉 B.酸性
 溶液 C.KSCN溶液
溶液 C.KSCN溶液③步骤Ⅱ中发生反应的离子方程式为
④若最终获得
 ,则废料铁泥中铁元素的质量分数为
,则废料铁泥中铁元素的质量分数为
您最近一年使用:0次
2023-01-20更新
|
525次组卷
|
7卷引用:广西北海市2023-2024学年高一上学期期末考试化学试题
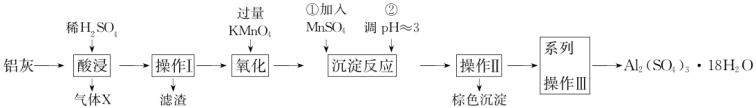
5 . 铝灰主要含有 、
、 ,以及少量硅石和
,以及少量硅石和 的氧化物,利用铝灰制备净水剂
的氧化物,利用铝灰制备净水剂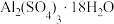 的工艺流程如图。
的工艺流程如图。
已知:金属离子浓度为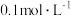 时生成氢氧化物沉淀的
时生成氢氧化物沉淀的
回答相关问题:
(1)酸浸时为确保安全应注意___________ ,酸浸充分后溶液中的金属阳离子是___________ 。
(2)操作I和II的名称是___________ 。
(3)若无氧化步骤,对实验的影响是___________ 。
(4)棕色沉淀含 。操作①加入
。操作①加入 反应的离子方程式是
反应的离子方程式是___________ ,判断该反应完成的现象是___________ 。
(5)操作②调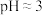 的原因是
的原因是___________ 。
(6)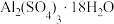 可制作聚合硫酸铝(
可制作聚合硫酸铝(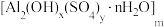 ),它是复合型高分子聚合物,净水效果优于传统的无机净水剂。若
),它是复合型高分子聚合物,净水效果优于传统的无机净水剂。若 ,则
,则
___________ 。引起聚合硫酸铝形态多变的基本成分是 ,可用实验测定其含量。称取
,可用实验测定其含量。称取 试样,将其移入锥形瓶中,用移液管加入
试样,将其移入锥形瓶中,用移液管加入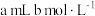 盐酸,充分溶解聚合物后,加
盐酸,充分溶解聚合物后,加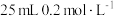 氟化钾溶液掩蔽掉全部铝离子,摇匀。加入3滴酚酞,用
氟化钾溶液掩蔽掉全部铝离子,摇匀。加入3滴酚酞,用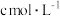 氢氧化钠标准溶液滴定至溶液呈微红色即为终点,消耗了标准液
氢氧化钠标准溶液滴定至溶液呈微红色即为终点,消耗了标准液 。则聚合硫酸铝中
。则聚合硫酸铝中 的质量分数为
的质量分数为___________ 。
 、
、 ,以及少量硅石和
,以及少量硅石和 的氧化物,利用铝灰制备净水剂
的氧化物,利用铝灰制备净水剂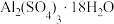 的工艺流程如图。
的工艺流程如图。
已知:金属离子浓度为
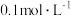 时生成氢氧化物沉淀的
时生成氢氧化物沉淀的
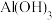 |  |  | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
回答相关问题:
(1)酸浸时为确保安全应注意
(2)操作I和II的名称是
(3)若无氧化步骤,对实验的影响是
(4)棕色沉淀含
 。操作①加入
。操作①加入 反应的离子方程式是
反应的离子方程式是(5)操作②调
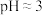 的原因是
的原因是(6)
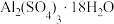 可制作聚合硫酸铝(
可制作聚合硫酸铝(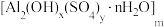 ),它是复合型高分子聚合物,净水效果优于传统的无机净水剂。若
),它是复合型高分子聚合物,净水效果优于传统的无机净水剂。若 ,则
,则
 ,可用实验测定其含量。称取
,可用实验测定其含量。称取 试样,将其移入锥形瓶中,用移液管加入
试样,将其移入锥形瓶中,用移液管加入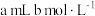 盐酸,充分溶解聚合物后,加
盐酸,充分溶解聚合物后,加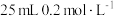 氟化钾溶液掩蔽掉全部铝离子,摇匀。加入3滴酚酞,用
氟化钾溶液掩蔽掉全部铝离子,摇匀。加入3滴酚酞,用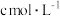 氢氧化钠标准溶液滴定至溶液呈微红色即为终点,消耗了标准液
氢氧化钠标准溶液滴定至溶液呈微红色即为终点,消耗了标准液 。则聚合硫酸铝中
。则聚合硫酸铝中 的质量分数为
的质量分数为
您最近一年使用:0次
6 . 设计如下实验装置制备硫代硫酸钠晶体(Na2S2O3·5H2O)(夹持仪器略),总反应为2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2.已知硫代硫酸钠晶体在中性或碱性溶液中较稳定,酸性溶液中产生浑浊。
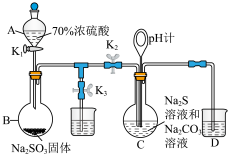
(1)仪器A的名称为___________ ,烧瓶B中制备SO2的化学方程式为___________ ,A中使用浓硫酸的质量分数为70%的原因是___________ 。
(2)Na2S2O3的制备:先组装好仪器,然后检验装置的气密性,将所需药品加入各仪器装置;打开K2,关闭K3,调节K1使硫酸缓缓滴下,导管口有气泡冒出,pH计读数逐渐减小,当pH计读数接近7时,必须立即打开K3,关闭K1、K2,原因是___________ (用离子方程式解释)。
(3)充分反应后,将C中溶液经过一系列操作可得硫代硫酸钠晶体。准确称取7.00g产品,溶于蒸馏水配成100.00 mL,溶液,取20.00 mL注入锥形瓶,以淀粉作指示剂,用0.10 mol/L标准碘溶液滴定。已知:2S2O +I2(aq)=S4O
+I2(aq)=S4O 后(无色)+2I-(aq)。
后(无色)+2I-(aq)。
①标准碘溶液应盛放在___________ (填“酸式”或“碱式”)滴定管中。
②第一次滴定开始和结束时,滴定管中的液面如图,则消耗标准碘溶液的体积为___________ mL。
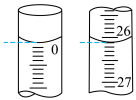
③重复上述操作三次,记录另两次数据如表中所示,则产品中Na2S2O3·5H2O(M=248 g·mol-1)的质量分数为___________ %。
(4)Na2S2O3有还原性,可作脱氯剂。向Na2S2O3溶液中通入少量Cl2,预测S2O 转变为SO
转变为SO ,设计实验方案验证该预测:取少量反应后的溶液于试管中,
,设计实验方案验证该预测:取少量反应后的溶液于试管中,___________ 。

(1)仪器A的名称为
(2)Na2S2O3的制备:先组装好仪器,然后检验装置的气密性,将所需药品加入各仪器装置;打开K2,关闭K3,调节K1使硫酸缓缓滴下,导管口有气泡冒出,pH计读数逐渐减小,当pH计读数接近7时,必须立即打开K3,关闭K1、K2,原因是
(3)充分反应后,将C中溶液经过一系列操作可得硫代硫酸钠晶体。准确称取7.00g产品,溶于蒸馏水配成100.00 mL,溶液,取20.00 mL注入锥形瓶,以淀粉作指示剂,用0.10 mol/L标准碘溶液滴定。已知:2S2O
 +I2(aq)=S4O
+I2(aq)=S4O 后(无色)+2I-(aq)。
后(无色)+2I-(aq)。①标准碘溶液应盛放在
②第一次滴定开始和结束时,滴定管中的液面如图,则消耗标准碘溶液的体积为

③重复上述操作三次,记录另两次数据如表中所示,则产品中Na2S2O3·5H2O(M=248 g·mol-1)的质量分数为
| 滴定次输 | 滴定前/mL | 滴定后/mL |
| 第二次 | 1.56 | 30.30 |
| 第三次 | 0.22 | 26.34 |
(4)Na2S2O3有还原性,可作脱氯剂。向Na2S2O3溶液中通入少量Cl2,预测S2O
 转变为SO
转变为SO ,设计实验方案验证该预测:取少量反应后的溶液于试管中,
,设计实验方案验证该预测:取少量反应后的溶液于试管中,
您最近一年使用:0次
7 . 在催化剂作用下H2(g)可将烟气中的SO2(g)还原成S(s)。回答下列问题:
(1)已知:
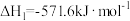

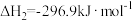
则H2(g)还原烟气中的SO2(g)的热化学方程式为___________ 。
(2)在容积为10L的容器中充入1mol SO2(g)与2mol H2(g)的混合气体,发生反应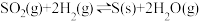
 。
。
①恒容时,反应经过4s后达到平衡,此时测得H2O(g)的物质的量为1.2mol。则0~4s内,v(H2)=___________ mol/(L·s),平衡时,c(SO2)=___________ mol/L;若平衡后升高温度,SO2的转化率将___________ (填“增 大”“减小”或“不变”)。
②恒温时,压强p与SO2的平衡转化率α如图所示,该温度下,该反应的平衡常数K=___________ L/mol;平衡状态由A变到B,平衡常数K(A) ___________ (填“>”“<”或“=”)K(B)。
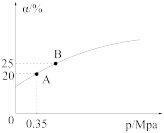
③若在恒温恒容密闭容器中发生上述反应,下列可作为该反应达到平衡状态的标志是___________ (填标号)。
A.压强不再变化
B.密度不再变化
C.气体的平均相对分子质量不再变化
D.SO2的消耗速率与H2的消耗速率之比为1∶2
(1)已知:

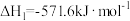

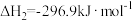
则H2(g)还原烟气中的SO2(g)的热化学方程式为
(2)在容积为10L的容器中充入1mol SO2(g)与2mol H2(g)的混合气体,发生反应
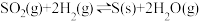
 。
。①恒容时,反应经过4s后达到平衡,此时测得H2O(g)的物质的量为1.2mol。则0~4s内,v(H2)=
②恒温时,压强p与SO2的平衡转化率α如图所示,该温度下,该反应的平衡常数K=

③若在恒温恒容密闭容器中发生上述反应,下列可作为该反应达到平衡状态的标志是
A.压强不再变化
B.密度不再变化
C.气体的平均相对分子质量不再变化
D.SO2的消耗速率与H2的消耗速率之比为1∶2
您最近一年使用:0次
2021-11-02更新
|
551次组卷
|
4卷引用:广西北海市2021-2022学年高三上学期第一次化学模拟考试理综化学试题
解题方法
8 . 点击化学的代表反应为铜催化的叠氮-炔基Husigen环加成反应,NaN3、SO2F2、FSO2N2等均是点击化学中常用无机试剂。回答下列问题:
(1)基态Cu原子价电子排布式为___________ ;基态N原子未成对电子有___________ 个。
(2)F、O、N的电负性从小到大的顺序是___________ 。
(3)SO2F2中硫原子价层电子对数目为___________ ;SO2F2的沸点比FSO2N3的低,其主要原因是___________ 。
(4)NaN3是HN3的钠盐,下列有关HN3说法正确的是___________ (填字母)。
a.HN3分子呈直线型 b.HN3分子间存在氢键
c.HN3中氮原子杂化方式只有sp d.HN3与HOCN互为等电子体
(5)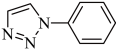 是一种叠氮-炔基Husigen环加成反应产物,每个该分子中含有
是一种叠氮-炔基Husigen环加成反应产物,每个该分子中含有___________ 个σ键。
(6)CuBr是点击化学常用的催化剂,其晶胞结构如图所示,晶胞参数为a pm。
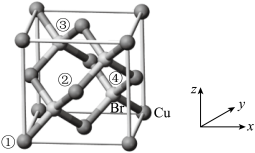
已知①、②号铜原子坐标依次为(0,0,0)、( ,0,
,0, ),则③号溴原子的坐标为
),则③号溴原子的坐标为___________ ;设NA为阿伏加德罗常数的值,CuBr的密度为___________ g·cm-3(列出计算式)。
(1)基态Cu原子价电子排布式为
(2)F、O、N的电负性从小到大的顺序是
(3)SO2F2中硫原子价层电子对数目为
(4)NaN3是HN3的钠盐,下列有关HN3说法正确的是
a.HN3分子呈直线型 b.HN3分子间存在氢键
c.HN3中氮原子杂化方式只有sp d.HN3与HOCN互为等电子体
(5)
 是一种叠氮-炔基Husigen环加成反应产物,每个该分子中含有
是一种叠氮-炔基Husigen环加成反应产物,每个该分子中含有(6)CuBr是点击化学常用的催化剂,其晶胞结构如图所示,晶胞参数为a pm。

已知①、②号铜原子坐标依次为(0,0,0)、(
 ,0,
,0, ),则③号溴原子的坐标为
),则③号溴原子的坐标为
您最近一年使用:0次
解题方法
9 . 某学习小组设计的探究SO2与Mg反应的装置如图所示(夹持及加热装置已略去)。

回答下列问题:
(1)A中发生反应的化学方程式为___________ 。
(2)B中盛放的试剂为___________ ;实验时应先加热装置___________ (填图中字母)。
(3)充分反应后,取C中少量固体加入试管中,管口放湿润Pb(NO3)2试纸(遇H2S变黑),然后滴入足量稀硫酸。
①若固体部分溶解,且无气体放出,试纸无明显变化,则C中的产物为___________ (填化学式)。
②若固体完全溶解,试纸变黑,则C中发生反应的化学方程式为___________ 。
(4)设计D装置的目的是___________ 。

回答下列问题:
(1)A中发生反应的化学方程式为
(2)B中盛放的试剂为
(3)充分反应后,取C中少量固体加入试管中,管口放湿润Pb(NO3)2试纸(遇H2S变黑),然后滴入足量稀硫酸。
①若固体部分溶解,且无气体放出,试纸无明显变化,则C中的产物为
②若固体完全溶解,试纸变黑,则C中发生反应的化学方程式为
(4)设计D装置的目的是
您最近一年使用:0次
名校
解题方法
10 . 25℃时,下列各组离子在指定溶液中一定能大量共存的是
A.0.1 mol·L-1 HCl溶液:Na+、 、 、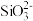 、 、 |
| B.0.1 mol·L-1 KI溶液:ClO-、K+、OH-、Na+ |
C.0.1 mol·L-1 CuSO4溶液:Fe3+、Cl-、 、H+ 、H+ |
D.0.1 mol·L-1 NaOH溶液:K+、Ca2+、Cl-、 |
您最近一年使用:0次
2020-12-15更新
|
465次组卷
|
3卷引用:广西北海市2021届高三第一次模拟考试化学试题



