1 . Cu及其化合物在医药、催化、材料等领域有广泛应用。回答下列问题:
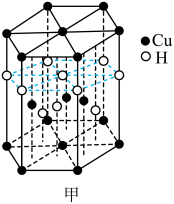
(1)Cu元素与H元素可形成一种红色化合物,其晶体结构单元如图甲所示。则该化合物的化学式为___________ 。___________ 种空间运动状态。与Cu元素同周期,基态原子有2个未成对电子的金属元素有___________ 种。
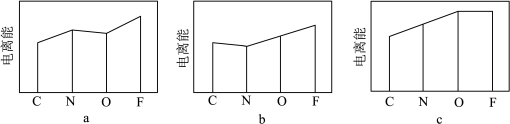
②下图a、b、c分别表示C、N、O和F的逐级电离能I变化趋势(纵坐标的标度不同)。第一电离能的变化图是___________ (填序号),第三电离能的变化图是___________ (填序号)。___________ ,图乙反应中断裂和生成的化学键有___________ (填序号)。
a.离子键 b. 键 c.极性键 d.氢键 e.配位键
键 c.极性键 d.氢键 e.配位键
(1)Cu元素与H元素可形成一种红色化合物,其晶体结构单元如图甲所示。则该化合物的化学式为
②下图a、b、c分别表示C、N、O和F的逐级电离能I变化趋势(纵坐标的标度不同)。第一电离能的变化图是
a.离子键 b.
 键 c.极性键 d.氢键 e.配位键
键 c.极性键 d.氢键 e.配位键
您最近一年使用:0次
名校
2 . 下列有关说法正确的是
| A.某晶体溶于水后可以导电,该晶体一定是离子晶体 |
B.干冰和 的晶体类型相同 的晶体类型相同 |
| C.分子晶体的结构特征都是分子密堆积,一个分子周围有12个紧邻的分子 |
| D.标准状况下HF不是气体的原因是HF分子间可以形成分子间氢键,沸点较高 |
您最近一年使用:0次
3 . 探究外界因素对化学平衡的影响
Ⅰ. 利用“[Cu(H2O)4]2+(蓝色)+4Cl- [CuCl4]2-(黄色)+4H2O ΔH > 0”探究温度和浓度对化学平衡的影响。
[CuCl4]2-(黄色)+4H2O ΔH > 0”探究温度和浓度对化学平衡的影响。
实验过程:常温下,将CuCl2溶于水中得到CuCl2浓溶液,获得黄绿色溶液。并平均分为5份置于5个试管中并标记为a、b、c、d、e号试管
(1)b号试管的实验现象为________ ,c号试管相对于a号试管来说,c的溶液由黄绿色变为________ (填“蓝”或“黄”)色。对比a、b、c三支试管颜色变化,得到的结论是________________ 。
(2)对比a、d、e三支试管颜色变化,得到的结论是________ 。
Ⅱ.利用2N2O5(g) 4NO2(g) +O2(g)探究压强对化学平衡的影响。(已知:N2O5是一种无色气体)
4NO2(g) +O2(g)探究压强对化学平衡的影响。(已知:N2O5是一种无色气体)
在初始体积为V 的、无色透明的、带有活塞的石英玻璃容器中充入一定量N2O5,将温度升到一定温度并保持不变使其充分反应,如下图所示。
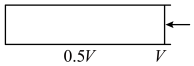
(3)待反应充分反应后,将容器的容积压缩为0.5V,可以观察到“混合气体颜色先快速变深,然后缓慢变浅”,说明该反应的平衡________ (填“正向”、“逆向”或“不”)移动;再将容积扩大到V,可以观察到“混合气体颜色先快速变浅,然后缓慢加深”,说明该反应的平衡________ (填“正向”、“逆向”或“不”)移动;
(4)通过上述实验,压强对化学平衡的影响是:________ 。
Ⅰ. 利用“[Cu(H2O)4]2+(蓝色)+4Cl-
 [CuCl4]2-(黄色)+4H2O ΔH > 0”探究温度和浓度对化学平衡的影响。
[CuCl4]2-(黄色)+4H2O ΔH > 0”探究温度和浓度对化学平衡的影响。实验过程:常温下,将CuCl2溶于水中得到CuCl2浓溶液,获得黄绿色溶液。并平均分为5份置于5个试管中并标记为a、b、c、d、e号试管
| 试管编号 | 处理方式 |
| a | 加入1ml 的水 |
| b | 加入1mL 0.1mol·L-1 AgNO3溶液(足量)充分反应 |
| c | 加入1ml 0.1mol·L-1 NaCl溶液(足量)充分反应 |
| d | 加入1mL 的水 并置于50℃的热水浴中充分反应 |
| e | 加入1mL 的水 并置于冰水浴中充分反应 |
(1)b号试管的实验现象为
(2)对比a、d、e三支试管颜色变化,得到的结论是
Ⅱ.利用2N2O5(g)
 4NO2(g) +O2(g)探究压强对化学平衡的影响。(已知:N2O5是一种无色气体)
4NO2(g) +O2(g)探究压强对化学平衡的影响。(已知:N2O5是一种无色气体)在初始体积为V 的、无色透明的、带有活塞的石英玻璃容器中充入一定量N2O5,将温度升到一定温度并保持不变使其充分反应,如下图所示。

(3)待反应充分反应后,将容器的容积压缩为0.5V,可以观察到“混合气体颜色先快速变深,然后缓慢变浅”,说明该反应的平衡
(4)通过上述实验,压强对化学平衡的影响是:
您最近一年使用:0次
4 . CO2(g) + 3H2(g) CH3OH(g) + H2O(g) ΔH = - 49kJ/mol是实现“2030年前实现碳达峰,2060年实现碳中和”的重要途径之一。一定温度下,在2L密闭容器中,加入2mol CO2(CO2起始量保持不变) 和一定量的H2,两种反应物的转化率随x[x =
CH3OH(g) + H2O(g) ΔH = - 49kJ/mol是实现“2030年前实现碳达峰,2060年实现碳中和”的重要途径之一。一定温度下,在2L密闭容器中,加入2mol CO2(CO2起始量保持不变) 和一定量的H2,两种反应物的转化率随x[x =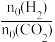 ,n0代表起始加入的物质的量]的变化如下图所示。下列说法正确的是
,n0代表起始加入的物质的量]的变化如下图所示。下列说法正确的是

 CH3OH(g) + H2O(g) ΔH = - 49kJ/mol是实现“2030年前实现碳达峰,2060年实现碳中和”的重要途径之一。一定温度下,在2L密闭容器中,加入2mol CO2(CO2起始量保持不变) 和一定量的H2,两种反应物的转化率随x[x =
CH3OH(g) + H2O(g) ΔH = - 49kJ/mol是实现“2030年前实现碳达峰,2060年实现碳中和”的重要途径之一。一定温度下,在2L密闭容器中,加入2mol CO2(CO2起始量保持不变) 和一定量的H2,两种反应物的转化率随x[x =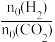 ,n0代表起始加入的物质的量]的变化如下图所示。下列说法正确的是
,n0代表起始加入的物质的量]的变化如下图所示。下列说法正确的是
| A.L1代表H2的转化率随x的变化情况 |
| B.2种反应物转化率相等时,图中x1= 3 |
| C.升高温度,化学平衡常数会变大 |
| D.增大压强,达到新平衡CO2的体积分数会增大 |
您最近一年使用:0次
5 . 已知,在铁触媒的催化下N2 (g)+ 3H2(g) 2NH3 (g) ∆H,请完成下列填空:
2NH3 (g) ∆H,请完成下列填空:
(1)反应过程的能量变化示意图如下图所示,已知N≡N和H-H的键能分别为946kJ·mol-1、436kJ·mol-1,则N-H的键能为________ kJ·mol-1。

(2)当达到平衡后,在某时刻降低温度,正、逆反应速率的变化情况符合像下图________(填“标号”)。
(3)下列措施能够提高H2平衡转化率的是________ 。
A升高温度 B增大压强 C.恒温恒压下通入Ar
D.恒温恒容下通入N2 E. 恒温恒容下通入H2 F.及时分离出NH3
(4)在一定温度下,在10L的密闭容器中充入3mol N2和10 mol H2和适量的铁触媒,产生NH3的物质的量变化情况如下表所示:
①在0~2min,用N2表示的化学反应速率v(N2)= ________ 。
②H2的平衡转化率为________ ,达到平衡时放出的热量为________ 。
③在该温度下,合成氨反应的化学平衡常数K=________ 可以不写“单位”)。
 2NH3 (g) ∆H,请完成下列填空:
2NH3 (g) ∆H,请完成下列填空:(1)反应过程的能量变化示意图如下图所示,已知N≡N和H-H的键能分别为946kJ·mol-1、436kJ·mol-1,则N-H的键能为

(2)当达到平衡后,在某时刻降低温度,正、逆反应速率的变化情况符合像下图________(填“标号”)。
A.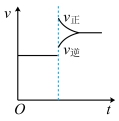 | B.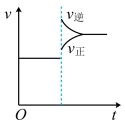 |
C.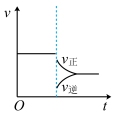 | D. |
(3)下列措施能够提高H2平衡转化率的是
A升高温度 B增大压强 C.恒温恒压下通入Ar
D.恒温恒容下通入N2 E. 恒温恒容下通入H2 F.及时分离出NH3
(4)在一定温度下,在10L的密闭容器中充入3mol N2和10 mol H2和适量的铁触媒,产生NH3的物质的量变化情况如下表所示:
| 时间t/min | 0 | 1 | 2 | 3 | 4 | 5 |
| N(NH3)/mol | 0 | 1.8 | 2.8 | 3.5 | 4 | 4 |
②H2的平衡转化率为
③在该温度下,合成氨反应的化学平衡常数K=
您最近一年使用:0次
6 . 将CO2转化为更有价值的化工原料,正成为科学家们研究的一个重要领域。回答下列问题:
Ⅰ.在活性Fe的催化下将CO2加氢转化为CO,经历的两个基元反应如下:
反应①:Fe(s)+CO2(g) FeO(s)+CO(g) ΔH1 平衡常数为K1;
FeO(s)+CO(g) ΔH1 平衡常数为K1;
反应②:FeO(s)+H2(g) Fe(s)+H2O(g) ΔH2 平衡常数为K2;
Fe(s)+H2O(g) ΔH2 平衡常数为K2;
在不同温度时K1、K2的值如下表:
(1)由表中数据可知反应①是________ (填“吸热”或“放热”)反应。700℃时总反应CO2(g)+H2(g) CO(g)+H2O(g)的化学平衡常数K3=
CO(g)+H2O(g)的化学平衡常数K3=________ 。
Ⅱ. CO2和CO加氢都可以制CH3OH,热化学方程式分别为:
③ CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH3 = -49kJ·mol-1,
CH3OH(g)+H2O(g) ΔH3 = -49kJ·mol-1,
④ CO(g)+2H2(g) CH3OH(g) ΔH4 = -90 kJ·mol-1
CH3OH(g) ΔH4 = -90 kJ·mol-1
(2)CO2(g)+H2(g) CO(g)+H2O(g)的反应为 ΔH =
CO(g)+H2O(g)的反应为 ΔH =________ ;
(3)CO2加氢制CH3OH的过程中,为了提高CO2的转化率,可以采取的措施是____________ (任写1条)。
(4)已知反应④CO(g)+2H2(g) CH3OH(g) 的速率表达式为v(CO) =k·cm(CO)·cn(H2) (k、m、n待测,k为速率常数,一般只受温度影响)。T℃时测得有关实验数据如下:
CH3OH(g) 的速率表达式为v(CO) =k·cm(CO)·cn(H2) (k、m、n待测,k为速率常数,一般只受温度影响)。T℃时测得有关实验数据如下:
分析上表中的数据,当速率以mol·L-1·s-1为单位时,k =________ 、m =________ 、n =________ ;在该温度下、在的密闭容器中,充入0.1mol ·L-1 CO 和0.2 mol·L-1 H2,则起始化学反应速率v(H2)= ________ 。
Ⅰ.在活性Fe的催化下将CO2加氢转化为CO,经历的两个基元反应如下:
反应①:Fe(s)+CO2(g)
 FeO(s)+CO(g) ΔH1 平衡常数为K1;
FeO(s)+CO(g) ΔH1 平衡常数为K1;反应②:FeO(s)+H2(g)
 Fe(s)+H2O(g) ΔH2 平衡常数为K2;
Fe(s)+H2O(g) ΔH2 平衡常数为K2;在不同温度时K1、K2的值如下表:
| 700℃ | 900℃ | |
| K1 | 1.5 | 2.0 |
| K2 | 0.4 | 0.6 |
(1)由表中数据可知反应①是
 CO(g)+H2O(g)的化学平衡常数K3=
CO(g)+H2O(g)的化学平衡常数K3=Ⅱ. CO2和CO加氢都可以制CH3OH,热化学方程式分别为:
③ CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH3 = -49kJ·mol-1,
CH3OH(g)+H2O(g) ΔH3 = -49kJ·mol-1,④ CO(g)+2H2(g)
 CH3OH(g) ΔH4 = -90 kJ·mol-1
CH3OH(g) ΔH4 = -90 kJ·mol-1 (2)CO2(g)+H2(g)
 CO(g)+H2O(g)的反应为 ΔH =
CO(g)+H2O(g)的反应为 ΔH =(3)CO2加氢制CH3OH的过程中,为了提高CO2的转化率,可以采取的措施是
(4)已知反应④CO(g)+2H2(g)
 CH3OH(g) 的速率表达式为v(CO) =k·cm(CO)·cn(H2) (k、m、n待测,k为速率常数,一般只受温度影响)。T℃时测得有关实验数据如下:
CH3OH(g) 的速率表达式为v(CO) =k·cm(CO)·cn(H2) (k、m、n待测,k为速率常数,一般只受温度影响)。T℃时测得有关实验数据如下:| 序号 | c(CO)/(mol·L-1) | c(H2)/(mol·L-1) | v(CO)/(mol·L-1·s-1) |
| ① | 0.01 | 0.01 | 2.0×10-6 |
| ② | 0.02 | 0.01 | 4.0×10-6 |
| ③ | 0.01 | 0.02 | 8.0×10-6 |
您最近一年使用:0次
7 . 某化学兴趣小组,利用NaHSO3溶液和酸性KMnO4溶液(使用稀H2SO4酸化)反应探究外界因素对化学反应速率的影响。
Ⅰ.原理分析:
(1)反应过程中 被氧化为
被氧化为 ,
, 被还原为Mn2+,请写出实验过程中的离子方程式
被还原为Mn2+,请写出实验过程中的离子方程式_______________ 。
(2)实验过程中,NaHSO3的用量要保证足量,通过比较________ (填“实验现象”)所需时间的长短来判断反应的快慢。
Ⅱ.实验过程
该化学兴趣小组设计如下实验方案:
(3)对比实验①②,使用探究________ 对化学反应速率的影响;若实验②③是用来探究温度对化学反应速率的影响,则V1=________ mL。
(4)若t1=25s,则用HSO 表示实验①的化学反应速率v(
表示实验①的化学反应速率v( )=
)= ________ 。
Ⅲ.实验分析和探究
该化学兴趣小组通过反复实验发现,该反应的化学反应速率总是先增大后减小,该化学兴趣小组猜想可能有两个原因,并作出了猜想:
猜想1:该反应放热,使溶液温度升高,化学反应速率加快
猜想2:新生成的微粒Mn2+对该反应有催化的作用
该化学兴趣小组,通过监测实验①反应过程的温度变化情况,数据显示反应过程中混合溶液的温度基本保持不变,排除猜想1的可能性。并设计第④组实验验证猜想2。设计如下:
(5)为了实验结论的可靠性,试剂X应该选择________。
(6)实验后,若t4_____ t1(填“大于”、“小于”或 “等于”),说明猜想2成立。
Ⅰ.原理分析:
(1)反应过程中
 被氧化为
被氧化为 ,
, 被还原为Mn2+,请写出实验过程中的离子方程式
被还原为Mn2+,请写出实验过程中的离子方程式(2)实验过程中,NaHSO3的用量要保证足量,通过比较
Ⅱ.实验过程
该化学兴趣小组设计如下实验方案:
| 编号 | 实验温度/℃ | 所用试剂的体积/mL | 达到(2)中现象所需时间/min | ||
| 0.6mol/L NaHSO3溶液 | 0.2mol/L酸性KMnO4溶液 | 水 | |||
| ① | 25 | 20 | 20 | 10 | t1 |
| ② | 25 | 25 | 20 | 5 | t2 |
| ③ | 50 | V1 | 20 | 5 | t3 |
(3)对比实验①②,使用探究
(4)若t1=25s,则用HSO
 表示实验①的化学反应速率v(
表示实验①的化学反应速率v( )=
)= Ⅲ.实验分析和探究
该化学兴趣小组通过反复实验发现,该反应的化学反应速率总是先增大后减小,该化学兴趣小组猜想可能有两个原因,并作出了猜想:
猜想1:该反应放热,使溶液温度升高,化学反应速率加快
猜想2:新生成的微粒Mn2+对该反应有催化的作用
该化学兴趣小组,通过监测实验①反应过程的温度变化情况,数据显示反应过程中混合溶液的温度基本保持不变,排除猜想1的可能性。并设计第④组实验验证猜想2。设计如下:
| 编号 | 实验温度/℃ | 所用试剂的体积/mL | 达到(2)中现象所需时间/min | ||
| 0.5mol/L NaHSO3溶液 | 0.2mol/L 酸性KMnO4溶液 | 试剂X | |||
| ④ | 25 | 20 | 20 | 10 | t4 |
(5)为了实验结论的可靠性,试剂X应该选择________。
| A.MnCl2溶液 | B.MnSO4溶液 |
| C.Mn(NO3)2溶液 | D.Mn(HSO3)2溶液 |
(6)实验后,若t4
您最近一年使用:0次
8 . 下列实验操作、现象和结论均正确的是
| 选项 | 操作和想象 | 结论 |
| A | 2mL 0.1mol·L-1FeCl3溶液加入3mL 0.1mol·L-1 KI溶液,充分反应后,滴加2~3滴KSCN溶液,溶液变为红色。 | Fe3+和I-反应存在限度 |
| B | 将装有“达到平衡的NO2和N2O4混合气体”的烧瓶放到热水中,溶液变深。[已知,2NO2(g) N2O4(g)] N2O4(g)] | 升高温度,所有可逆反应都逆向移动 |
| C | 将形状一样、质量相等的2块Fe片,分别投入稀硫酸和浓硫酸中,前者产生的气泡快,后者几乎不产生气泡。 | 其他条件相同,浓度越小,化学速率越快 |
| D | 一定温度下,向2L体积可以人为改变的容器中充0.2mol H2(g)和0.2mol I2(g),充分反应后。将体积压缩为1L。混合气体颜色变深。 | 对于可逆反应H2(g) +I2(g) 2HI(g)来说,增大压强,平衡逆向移动。 2HI(g)来说,增大压强,平衡逆向移动。 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
9 . 反应mA(g) + nB(g) pC(g) ΔH(m、n、p化学计量系数,A、B、C是物质) ,各物理量关系都符合下列两个图像,其中图1中T1、T2代表不同的温度,α(A)表示物质A的转化率,则
pC(g) ΔH(m、n、p化学计量系数,A、B、C是物质) ,各物理量关系都符合下列两个图像,其中图1中T1、T2代表不同的温度,α(A)表示物质A的转化率,则
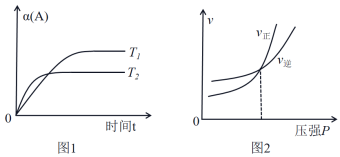
 pC(g) ΔH(m、n、p化学计量系数,A、B、C是物质) ,各物理量关系都符合下列两个图像,其中图1中T1、T2代表不同的温度,α(A)表示物质A的转化率,则
pC(g) ΔH(m、n、p化学计量系数,A、B、C是物质) ,各物理量关系都符合下列两个图像,其中图1中T1、T2代表不同的温度,α(A)表示物质A的转化率,则
| A.ΔH < 0,m+n > P | B.ΔH < 0,m+n <P |
| C.ΔH > 0,m+n > P | D.ΔH > 0,m+n <P |
您最近一年使用:0次
10 . 乙烯和HCl加成经历2步基元反应如图甲所示,其反应过程中能量的变化情况如图乙所示。下列有关乙烯和HCl的加成反应说法错误的是


| A.总反应的速率取决于第①步 | B.第②步反应是放热反应 |
C.中间产物CH3CH 能量高、不稳定 能量高、不稳定 | D.反应物的总键能高于生成物的总键能 |
您最近一年使用:0次



