解题方法
1 . 甲醇( )是一种重要的化工原料,应用前景广阔。请回答下列问题:
)是一种重要的化工原料,应用前景广阔。请回答下列问题:
(1)将 转化为
转化为 是实现碳中和的有效途径,已知部分化学键的键能数据如表所示:
是实现碳中和的有效途径,已知部分化学键的键能数据如表所示:
则反应

_____ kJ⋅mol ,该反应在
,该反应在_____ (填“高温”、“低温”或“任何温度”)下有利于自发进行。
(2)反应 的反应速率表达式为
的反应速率表达式为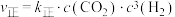 、
、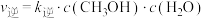 ,其中
,其中 、
、 为速率常数。则该反应的平衡常数K与
为速率常数。则该反应的平衡常数K与 、
、 的关系为
的关系为_____ (用含K、 、
、 的代数式表示),反应达到平衡后,仅降低温度,下列推断合理的是
的代数式表示),反应达到平衡后,仅降低温度,下列推断合理的是_____ (填标号)。
A. 、
、 均增大,且
均增大,且 增大的程度更大
增大的程度更大
B. 、
、 均减小,且
均减小,且 减小的程度更小
减小的程度更小
C. 增大、
增大、 减小,平衡正向移动
减小,平衡正向移动
D. 、
、 均减小,且
均减小,且 减小的程度更小
减小的程度更小
(3)甲醇脱氢可制取甲醛: 。温度恒定为T℃时,向体积不等的恒容密闭容器中均加入1mol
。温度恒定为T℃时,向体积不等的恒容密闭容器中均加入1mol 发生上述反应,反应tmin时,测得各容器中甲醇的转化率与容器体积的关系如图所示。
发生上述反应,反应tmin时,测得各容器中甲醇的转化率与容器体积的关系如图所示。

①由图判断,D点:
_____ (填“>”、“<”或“=”,下同) ;0~tmin内,消耗甲醇的反应速率:B点
;0~tmin内,消耗甲醇的反应速率:B点_____ D点。
②若C点为平衡点,则A、C点对应容器的体积比
_____ ,C点时容器总压强为 MPa,则该反应的压强平衡常数
MPa,则该反应的压强平衡常数
_____ MPa(以物质的分压表示的平衡常数为 ,分压=总压×物质的量分数)。
,分压=总压×物质的量分数)。
 )是一种重要的化工原料,应用前景广阔。请回答下列问题:
)是一种重要的化工原料,应用前景广阔。请回答下列问题:(1)将
 转化为
转化为 是实现碳中和的有效途径,已知部分化学键的键能数据如表所示:
是实现碳中和的有效途径,已知部分化学键的键能数据如表所示:| 化学键 | C=O | O-H | H-H | C-H | C-O |
键能/(kJ·mol ) ) | 803 | 464 | 436 | 414 | 326 |


 ,该反应在
,该反应在(2)反应
 的反应速率表达式为
的反应速率表达式为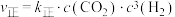 、
、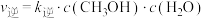 ,其中
,其中 、
、 为速率常数。则该反应的平衡常数K与
为速率常数。则该反应的平衡常数K与 、
、 的关系为
的关系为 、
、 的代数式表示),反应达到平衡后,仅降低温度,下列推断合理的是
的代数式表示),反应达到平衡后,仅降低温度,下列推断合理的是A.
 、
、 均增大,且
均增大,且 增大的程度更大
增大的程度更大B.
 、
、 均减小,且
均减小,且 减小的程度更小
减小的程度更小C.
 增大、
增大、 减小,平衡正向移动
减小,平衡正向移动D.
 、
、 均减小,且
均减小,且 减小的程度更小
减小的程度更小(3)甲醇脱氢可制取甲醛:
 。温度恒定为T℃时,向体积不等的恒容密闭容器中均加入1mol
。温度恒定为T℃时,向体积不等的恒容密闭容器中均加入1mol 发生上述反应,反应tmin时,测得各容器中甲醇的转化率与容器体积的关系如图所示。
发生上述反应,反应tmin时,测得各容器中甲醇的转化率与容器体积的关系如图所示。
①由图判断,D点:

 ;0~tmin内,消耗甲醇的反应速率:B点
;0~tmin内,消耗甲醇的反应速率:B点②若C点为平衡点,则A、C点对应容器的体积比

 MPa,则该反应的压强平衡常数
MPa,则该反应的压强平衡常数
 ,分压=总压×物质的量分数)。
,分压=总压×物质的量分数)。
您最近一年使用:0次
2023-07-23更新
|
132次组卷
|
2卷引用:贵州省毕节市金沙县2022-2023学年高二上学期12月月考化学试题
2 . 已知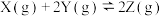
 。为了探究反应条件对该反应的影响,分别向四个密闭容器中充入一定量的反应物,反应条件及达到平衡时的有关数据如表所示,请回答下列问题:
。为了探究反应条件对该反应的影响,分别向四个密闭容器中充入一定量的反应物,反应条件及达到平衡时的有关数据如表所示,请回答下列问题:
(1)设计实验1、3的目的是探究_____ 对反应的影响,实验_____ 是为了探究压强对反应的影响。
(2)
_____ (填“>”、“<”或“=”)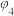 。
。
(3) 、
、 、
、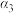 由大到小的顺序为
由大到小的顺序为_____ 。
(4) 、
、 、
、 、
、 的大小关系为
的大小关系为_____ 。
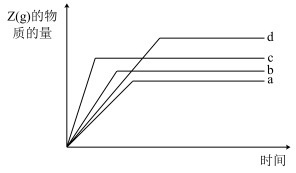
(5)若实验1、2、3、4中Z(g)的物质的量随时间的变化关系如图中曲线所示,实验1对应曲线b,则实验2、3分别对应曲线_____ 、_____ 。(填字母)
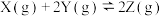
 。为了探究反应条件对该反应的影响,分别向四个密闭容器中充入一定量的反应物,反应条件及达到平衡时的有关数据如表所示,请回答下列问题:
。为了探究反应条件对该反应的影响,分别向四个密闭容器中充入一定量的反应物,反应条件及达到平衡时的有关数据如表所示,请回答下列问题:| 实验编号 | 1 | 2 | 3 | 4 |
| 反应物投入量 | 1molX(g)、2molY(g) | 1molX(g)、3molY(g) | 1molX(g)、2molY(g) | 1molX(g)、2molY(g) |
| 反应温度/℃ | 500 | 500 | 400 | 500 |
| 压强 | 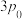 | 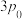 | 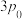 |  |
| 平衡时Z(g)的体积分数 |  | 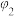 |  | 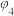 |
| Y(g)的平衡转化率 |  |  | 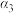 | 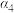 |
| 化学平衡常数 |  |  |  |  |
(2)

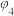 。
。(3)
 、
、 、
、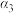 由大到小的顺序为
由大到小的顺序为(4)
 、
、 、
、 、
、 的大小关系为
的大小关系为(5)若实验1、2、3、4中Z(g)的物质的量随时间的变化关系如图中曲线所示,实验1对应曲线b,则实验2、3分别对应曲线

您最近一年使用:0次
2023-07-23更新
|
133次组卷
|
2卷引用:贵州省毕节市金沙县2022-2023学年高二上学期12月月考化学试题
3 . Ⅰ.有九种物质:①Cu②盐酸③HF④NaOH固体⑤ ⑥
⑥ ⑦熔融
⑦熔融 ⑧
⑧ 固体⑨氨水。
固体⑨氨水。
(1)上述物质中,属于电解质的是_____ (填标号,下同),属于弱电解质的是_____ ,能导电的有_____ 。
Ⅱ.已知室温下,部分弱电解质的电离平衡常数如下表所示:
(2) 第一级电离的平衡常数表达式
第一级电离的平衡常数表达式
_____ ;上述3种酸的酸性由强到弱的顺序为_____ (写化学式)。
(3)向10mL一定浓度的 溶液中加入蒸馏水稀释至100mL的过程中,醋酸的电离程度
溶液中加入蒸馏水稀释至100mL的过程中,醋酸的电离程度_____ (填“增大”、“减小”或“不变”)。
(4)向NaClO溶液中通入足量 ,发生反应的离子方程式为
,发生反应的离子方程式为_____ 。
(5)室温下,0.2mol⋅L 的氨水中,
的氨水中,
_____ mol⋅L 。
。
 ⑥
⑥ ⑦熔融
⑦熔融 ⑧
⑧ 固体⑨氨水。
固体⑨氨水。(1)上述物质中,属于电解质的是
Ⅱ.已知室温下,部分弱电解质的电离平衡常数如下表所示:
| 弱电解质 |  | HClO |  |  |
| 电离平衡常数 |  |  | 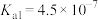  |  |
 第一级电离的平衡常数表达式
第一级电离的平衡常数表达式
(3)向10mL一定浓度的
 溶液中加入蒸馏水稀释至100mL的过程中,醋酸的电离程度
溶液中加入蒸馏水稀释至100mL的过程中,醋酸的电离程度(4)向NaClO溶液中通入足量
 ,发生反应的离子方程式为
,发生反应的离子方程式为(5)室温下,0.2mol⋅L
 的氨水中,
的氨水中,
 。
。
您最近一年使用:0次
解题方法
4 .  重整技术对温室气体的减排具有重要意义,有助于我国早日实现碳达峰。
重整技术对温室气体的减排具有重要意义,有助于我国早日实现碳达峰。
 催化重整反应为
催化重整反应为
 kJ·mol
kJ·mol 。
。
已知:①

②
 kJ⋅mol
kJ⋅mol
③
 kJ⋅mol
kJ⋅mol
请回答下列问题:
(1)若在25℃、101kPa时,4g 燃烧放出222.5kJ热量,则
燃烧放出222.5kJ热量,则
_____ kJ⋅mol 。
。
(2) 的燃烧热
的燃烧热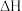 为
为_____ kJ⋅mol 。
。
(3)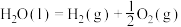 的
的
_____ kJ⋅mol ,若6.72L(标准状况)由
,若6.72L(标准状况)由 和
和 组成的混合气体在足量氧气中完全燃烧,恢复至室温后,放出85.5kJ热量,则
组成的混合气体在足量氧气中完全燃烧,恢复至室温后,放出85.5kJ热量,则
_____ 。
(4)反应 的
的 与
与 、
、 、
、 的关系为
的关系为_____ ,下列能加快该反应的反应速率的措施为_____ (填标号,下同),有利于提高 的平衡转化率的措施为
的平衡转化率的措施为_____ 。
A.扩大容器体积
B.降低温度
C.增大 的反应浓度
的反应浓度
D.及时移除部分
E.使用高效催化剂
 重整技术对温室气体的减排具有重要意义,有助于我国早日实现碳达峰。
重整技术对温室气体的减排具有重要意义,有助于我国早日实现碳达峰。 催化重整反应为
催化重整反应为
 kJ·mol
kJ·mol 。
。已知:①


②

 kJ⋅mol
kJ⋅mol
③

 kJ⋅mol
kJ⋅mol
请回答下列问题:
(1)若在25℃、101kPa时,4g
 燃烧放出222.5kJ热量,则
燃烧放出222.5kJ热量,则
 。
。(2)
 的燃烧热
的燃烧热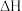 为
为 。
。(3)
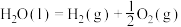 的
的
 ,若6.72L(标准状况)由
,若6.72L(标准状况)由 和
和 组成的混合气体在足量氧气中完全燃烧,恢复至室温后,放出85.5kJ热量,则
组成的混合气体在足量氧气中完全燃烧,恢复至室温后,放出85.5kJ热量,则
(4)反应
 的
的 与
与 、
、 、
、 的关系为
的关系为 的平衡转化率的措施为
的平衡转化率的措施为A.扩大容器体积
B.降低温度
C.增大
 的反应浓度
的反应浓度D.及时移除部分

E.使用高效催化剂
您最近一年使用:0次
5 .  和
和 分别在催化剂1和催化剂2作用下合成
分别在催化剂1和催化剂2作用下合成 的反应路径如图1、2所示(*表示物质吸附在催化剂上),下列说法正确的是
的反应路径如图1、2所示(*表示物质吸附在催化剂上),下列说法正确的是

 和
和 分别在催化剂1和催化剂2作用下合成
分别在催化剂1和催化剂2作用下合成 的反应路径如图1、2所示(*表示物质吸附在催化剂上),下列说法正确的是
的反应路径如图1、2所示(*表示物质吸附在催化剂上),下列说法正确的是
| A.上述两种催化剂没有改变合成氨的反应路径 |
B.图1中的决速步骤为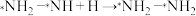 |
| C.图2中有5个放出能量和5个吸收能量的过程 |
| D.使用高效催化剂可以缩短合成氨反应到达平衡的时间 |
您最近一年使用:0次
6 . 对于可逆反应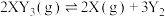 (?)
(?)  ,有关图像
,有关图像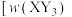 表示平衡时
表示平衡时 所占的体积分数]如图所示,下列说法正确的是
所占的体积分数]如图所示,下列说法正确的是

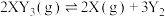 (?)
(?)  ,有关图像
,有关图像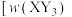 表示平衡时
表示平衡时 所占的体积分数]如图所示,下列说法正确的是
所占的体积分数]如图所示,下列说法正确的是
A.依据图1可知 , , 为液体 为液体 |
B.图2中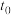 时改变的条件不可能为压缩容器体积 时改变的条件不可能为压缩容器体积 |
| C.图3中曲线b表示的是该反应的正反应速率 |
D.已知100℃时,平衡常数 。若在此温度下,测得某密闭容器中某时刻 。若在此温度下,测得某密闭容器中某时刻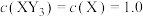 mol⋅L mol⋅L , ,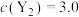 mol⋅L mol⋅L ,则此时 ,则此时 |
您最近一年使用:0次
7 . 1888年提出的勒夏特列原理成为判断化学平衡的重要理论依据,许多化学事实都与其相关,下列不能用勒夏特列原理解释的是
A.工业上合成 通常要在高压下进行 通常要在高压下进行 |
B.压缩盛有 的容器体积时,气体颜色变深 的容器体积时,气体颜色变深 |
C.用饱和食盐水除去 中含有的少量HCl 中含有的少量HCl |
D.向滴加了KSCN溶液的 溶液中再加少量铁粉,溶液红色变浅 溶液中再加少量铁粉,溶液红色变浅 |
您最近一年使用:0次
8 . 下列说法正确的是
| A.由碳酸钙在高温下分解可知,需要加热才能发生的反应一定是吸热反应 |
B.若在一定条件下,白磷(s) 黑磷 黑磷 kJ⋅mol kJ⋅mol ( (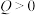 ),则黑磷的稳定性更好 ),则黑磷的稳定性更好 |
C.由  kJ⋅mol kJ⋅mol 知, 知, 的燃烧热 的燃烧热 为 为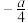 kJ⋅mol kJ⋅mol |
D.一定条件下,若向某密闭容器中充入1mol 和1mol 和1mol ,充分反应后放出bkJ热量,则 ,充分反应后放出bkJ热量,则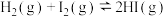  kJ·mol kJ·mol |
您最近一年使用:0次
9 . 为了探究强弱电解质对反应速率的影响,分别向试管1和试管2中加入等浓度、等体积的盐酸和醋酸溶液,再同时加入相同质量的锌粉(不足),下列说法正确的是(不考虑酸的挥发)
| A.反应刚开始时,试管2中反应更剧烈 |
| B.反应结束后,试管1中产生的气体更多 |
C.反应结束后,试管2中溶液含有的 浓度更小 浓度更小 |
D.生成相同体积(相同条件下)的 时,试管1消耗的时间更长 时,试管1消耗的时间更长 |
您最近一年使用:0次
名校
10 . 对一定浓度的氨水进行下列操作后,溶液导电性减弱的是
| A.通入适量HCl气体 | B.加入少量NaOH固体 |
| C.加入一定量的蒸馏水 | D.加入适量等浓度的醋酸溶液 |
您最近一年使用:0次
2023-07-23更新
|
178次组卷
|
2卷引用:贵州省毕节市金沙县2022-2023学年高二上学期12月月考化学试题



