名校
1 . 下列说法正确的是
| A.烷基是推电子基团,故甲酸的酸性强于乙酸 |
| B.水分子在较高温度下也很稳定与氢键有关 |
C.白磷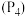 空间结构呈正四面体形,1mol白磷含 空间结构呈正四面体形,1mol白磷含 个P-P 个P-P |
D.邻羟基苯甲醛分子内氢键示意图: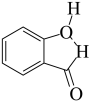 |
您最近一年使用:0次
名校
2 . 下列说法正确的是
A.电子排布不同的两种氮原子:①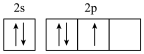 ② ②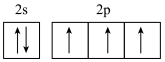 ,能量 ,能量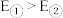 |
| B.焰火、霓虹灯光、激光、苂光、LED灯光等,都与原子核外电子跃迁吸收能量有关 |
C.若以 表示某能级的能量,则 表示某能级的能量,则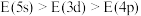 |
| D.三氯乙酸的酸性强于三氟乙酸 |
您最近一年使用:0次
名校
3 . 高铁酸盐是优良的多功能水处理剂。K2FeO4为紫色固体,可溶于水,微溶于浓KOH溶液,难溶于有机物;在0~5℃、强碱性溶液中比较稳定,在酸性、中性溶液中易分解放出O2。某实验小组制备高铁酸钾(K2FeO4)。回答下列问题:
制备K2FeO4:装置如图所示,夹持、加热等装置略。

(1)仪器a的名称是___________ ,装置B中除杂质所用试剂名称是_____________ 。
(2)A中发生反应的离子方程式为_____________ (填序号)
A.MnO2+4H+ +2 Cl- Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
B. MnO2+4H++4 Cl- MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
C.Mn2++ 4H++ 4 Cl- MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
D装置的作用为_____________ (填序号)。
A.吸收多余的HCl B.吸收多余的Cl2 C.防止外界二氧化碳进入 D.防倒吸
(3)C中反应为放热反应,而反应温度须控制在0~5℃,采用的控温方法为______ (选填“热水浴”或者“冰水浴”),反应中KOH必须过量的原因是主要考虑K2 FeO4的_______ 。(选填“强氧化性”,“溶解性”或者“稳定性”)
(4)选出C中总反应的离子方程式: (填序号)。C中混合物经分离提纯得到高铁酸钾。
制备K2FeO4:装置如图所示,夹持、加热等装置略。

(1)仪器a的名称是
(2)A中发生反应的离子方程式为
A.MnO2+4H+ +2 Cl-
 Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O B. MnO2+4H++4 Cl-
 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O C.Mn2++ 4H++ 4 Cl-
 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O D装置的作用为
A.吸收多余的HCl B.吸收多余的Cl2 C.防止外界二氧化碳进入 D.防倒吸
(3)C中反应为放热反应,而反应温度须控制在0~5℃,采用的控温方法为
(4)选出C中总反应的离子方程式: (填序号)。C中混合物经分离提纯得到高铁酸钾。
A.2Cl2+2Fe3++16OH- =2 +4Cl- + 8H2O +4Cl- + 8H2O |
B.3Cl2 + Fe3+ + 8OH- = + 6Cl- + 4H2O + 6Cl- + 4H2O |
C.3Cl2+ 2Fe3+ + 16OH- = 2 + 6Cl- + 8H2O + 6Cl- + 8H2O |
| D.3Cl2+2Fe3++4K+ + 16OH- =2K2 FeO4 + 6Cl- + 8H2O |
您最近一年使用:0次
名校
4 . 下列有关说法不正确的是
①电子排布(23V)1s22s22p63s23p63d5违反了洪特规则
②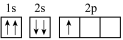 违反了泡利不相容原理
违反了泡利不相容原理
③Fe的外围电子排布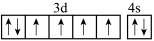
④甲醛(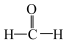 )为极性分子
)为极性分子
⑤SO 中心原子S为sp2杂化,空间构型为平面三角形
中心原子S为sp2杂化,空间构型为平面三角形
⑥干冰晶体中每个CO2分子周围紧邻12个CO2分子
⑦熔融态的NaHSO4中阳离子与阴离子的个数比为2︰1
⑧HF分子之间能形成氢键,故HF分子比HCl分子更稳定
①电子排布(23V)1s22s22p63s23p63d5违反了洪特规则
②
 违反了泡利不相容原理
违反了泡利不相容原理③Fe的外围电子排布

④甲醛(
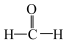 )为极性分子
)为极性分子⑤SO
 中心原子S为sp2杂化,空间构型为平面三角形
中心原子S为sp2杂化,空间构型为平面三角形⑥干冰晶体中每个CO2分子周围紧邻12个CO2分子
⑦熔融态的NaHSO4中阳离子与阴离子的个数比为2︰1
⑧HF分子之间能形成氢键,故HF分子比HCl分子更稳定
| A.①⑤ | B.②③④⑦ | C.①⑤⑦⑧ | D.①⑦⑧ |
您最近一年使用:0次
5 . 经研究表明,Fe(SCN)3是配合物,Fe3+与SCN-不仅能以1:3的个数比配合,还可以其他个数比配合。请按要求填空:
(1)若所得Fe3+和SCN-的配合物中,主要是Fe3+与SCN-以个数比1:1配合所得离子,显血红色。该离子的离子符号是___________ 。
(2)若Fe3+与SCN-以个数比1:5配合,则FeCl3与KSCN在水溶液中发生反应的化学方程式可以表示为___________ 。
(3)某铁的化合物结构简式如图所示,该化合物中属于p区元素的原子第一电离能由小到大的顺序为___________ 。

(4)SCN-与于CO2为等电子体,分别再写出一种分子和离子___________ 。
(5)铜、锌两种元素的第一电离能、第二电离能如表所示。
铜的第一电离能(I1)小于锌的第一电离能,而铜的第二电离能(I2)却大于锌的第二电离能,其主要原因是___________ 。
(6)向硫酸铜水溶液中逐滴加入氨水,现象为先生成蓝色沉淀后沉淀溶解,发生的离子方程式为___________ 、___________ 。若再向其加入乙醇,现象为___________ ,得到晶体的化学式为___________ ,加入乙醇析出晶体的原因___________ 。
(7)向盛有少量氯化钠溶液的试管中滴入少量硝酸银溶液,生成白色的氯化银沉淀,继续向试管里加入氨水,沉淀溶解了,试写出沉淀溶解的化学方程式___________ 。
(8)将铜粉加入浓氨水中,再通入氧气,充分反应后,溶液呈深蓝色(一种铜离子的配位化合物)。该反应的离子反应方程式___________ 。
(1)若所得Fe3+和SCN-的配合物中,主要是Fe3+与SCN-以个数比1:1配合所得离子,显血红色。该离子的离子符号是
(2)若Fe3+与SCN-以个数比1:5配合,则FeCl3与KSCN在水溶液中发生反应的化学方程式可以表示为
(3)某铁的化合物结构简式如图所示,该化合物中属于p区元素的原子第一电离能由小到大的顺序为

(4)SCN-与于CO2为等电子体,分别再写出一种分子和离子
(5)铜、锌两种元素的第一电离能、第二电离能如表所示。
| 电离能/kJ·mol-1 | I1 | I2 |
| 铜 | 746 | 1958 |
| 锌 | 906 | 1733 |
(6)向硫酸铜水溶液中逐滴加入氨水,现象为先生成蓝色沉淀后沉淀溶解,发生的离子方程式为
(7)向盛有少量氯化钠溶液的试管中滴入少量硝酸银溶液,生成白色的氯化银沉淀,继续向试管里加入氨水,沉淀溶解了,试写出沉淀溶解的化学方程式
(8)将铜粉加入浓氨水中,再通入氧气,充分反应后,溶液呈深蓝色(一种铜离子的配位化合物)。该反应的离子反应方程式
您最近一年使用:0次
名校
解题方法
6 . 根据物质结构的有关性质和特点,回答下列问题:
(1)基态氧原子的价电子排布图为___________ ,基态镁原子核外有种能量不同的电子,Cr3+基态核外电子排布式为___________ 。
(2)丙烯腈(CH2=CH-CN)分子中3个碳原子杂化轨道类型从左到右依次是___________ ,H、C、N元素电负性由大到小的顺序为___________ 。
(3)碳、氮、氧、氟元素的第一电离能从小到大的顺序为___________ ,碳、氮、氧、氟元素的第三电离能从小到大的顺序为___________ 。
(4)Sm的价层电子排布式为4f66s2,则Sm位于元素周期表的___________ 区,Sm3+价层电子排布式为___________ 。
(5)雌黄的分子式为As2S3,其分子结构为 ,As原子的杂化类型为
,As原子的杂化类型为___________ 。
(6)LiBH4由Li+和BH 构成,BH
构成,BH 的立体构型是
的立体构型是___________ ,根据化合物LiBH4判断,Li、B、H的电负性由大到小的顺序为___________ 。
(1)基态氧原子的价电子排布图为
(2)丙烯腈(CH2=CH-CN)分子中3个碳原子杂化轨道类型从左到右依次是
(3)碳、氮、氧、氟元素的第一电离能从小到大的顺序为
(4)Sm的价层电子排布式为4f66s2,则Sm位于元素周期表的
(5)雌黄的分子式为As2S3,其分子结构为
 ,As原子的杂化类型为
,As原子的杂化类型为(6)LiBH4由Li+和BH
 构成,BH
构成,BH 的立体构型是
的立体构型是
您最近一年使用:0次
7 . 前四周期A、B、C、D、E五种元素,它们的核电荷数依次增大,其中只有C、E是金属元素;A和C原子的价电子构型均为ns1,B原子中s能级和p能级的电子数相等;D原子核外电子占据9个原子轨道,且只有一个未成对电子;E原子在前四周期中未成对电子数最多。请回答下列问题:
(1)A、B和D按原子个数比1:1:1形成的化合物的电子式为___________ 。
(2)B离子的价电子排布式为:___________ 。
(3)B、C、D三种元素的离子半径由小到大的顺序为(用离子符号表示)___________ 。
(4)基态D原子中,电子占据的最高能层符号为___________ ,该能层填充的电子的电子云轮廓形状为___________ 。
(5)B所在周期中,第一电离能最大的元素是___________ (填元素符号)。
(6)E位于周期表中第___________ 族,___________ 区。
(1)A、B和D按原子个数比1:1:1形成的化合物的电子式为
(2)B离子的价电子排布式为:
(3)B、C、D三种元素的离子半径由小到大的顺序为(用离子符号表示)
(4)基态D原子中,电子占据的最高能层符号为
(5)B所在周期中,第一电离能最大的元素是
(6)E位于周期表中第
您最近一年使用:0次
名校
解题方法
8 . 某配合物的化学式为[PtCl4(NH3)2],其水溶液不导电,下列说法不正确的是
| A.向该配合物溶液中加入硝酸银溶液,产生白色沉淀 |
| B.该配合物配位数为6 |
| C.Pt的化合价为+4 |
| D.配合物中Cl-和NH3都是配体 |
您最近一年使用:0次
名校
解题方法
9 . A、B、C、D、E、F为硫酸铝钾和硫酸铝铵的组成元素,A元素原子核外的电子只有1种运动状态,B、C元素位于第二周期,且原子半径:B>C,C元素与D元素同主族,E、F元素的电离能数据如表所示。请回答下列问题:
(1)E元素基态原子的电子排布式为___________ 。
(2)D、E、F元素的简单离子半径大小顺序为___________ (用离子符号表示)。
(3)由题给信息判断:Mg元素的第一电离能___________ (填“大于”或“小于”)578 。
。
(4)B、C、D三种元素中,___________ (填元素符号)元素的气态原子失去一个电子所需的能量最多。
(5)钾元素的焰色反应呈紫色,其中紫色对应的辐射波长为___________ (填编号)
A.404.4nm B.553.5nm C.589.2nm D.670.8nm E.766.5nm
电离能( ) )元素 |  |  |  |  |
| E | 418.8 | 3052 | 4420 | 5877 |
| F | 578 | 1817 | 2745 | 11575 |
(2)D、E、F元素的简单离子半径大小顺序为
(3)由题给信息判断:Mg元素的第一电离能
 。
。(4)B、C、D三种元素中,
(5)钾元素的焰色反应呈紫色,其中紫色对应的辐射波长为
A.404.4nm B.553.5nm C.589.2nm D.670.8nm E.766.5nm
您最近一年使用:0次
名校
解题方法
10 . 下列说法正确的是
A. 是一种稳定的化合物,这是由于 是一种稳定的化合物,这是由于 分子之间形成氢键所致 分子之间形成氢键所致 |
| B.稀有气体原子最外层电子已达到饱和,不能与其它元素形成化合物 |
C. 是由离子构成的,其溶于水形成溶液的过程中既有离子键、共价键的断裂又有离子键、共价键的形成 是由离子构成的,其溶于水形成溶液的过程中既有离子键、共价键的断裂又有离子键、共价键的形成 |
D.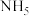 是既含有离子键又含有共价键的离子化合物,所有原子的最外层都符合同周期的稀有气体原子的最外层电子结构 是既含有离子键又含有共价键的离子化合物,所有原子的最外层都符合同周期的稀有气体原子的最外层电子结构 |
您最近一年使用:0次
2023-04-20更新
|
117次组卷
|
2卷引用:四川省广元中学2021-2022学年高二下学期第一次段考化学试题



