解题方法
1 . 接触法制硫酸的工艺流程中的关键步骤是SO2的催化氧化: ,在催化剂表面的反应历程如下:
,在催化剂表面的反应历程如下:
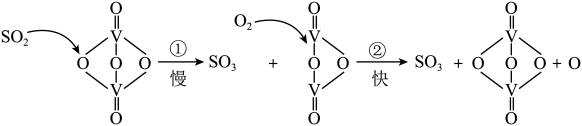
下列说法正确的是
 ,在催化剂表面的反应历程如下:
,在催化剂表面的反应历程如下:
下列说法正确的是
| A.过程中既有V-O键的断裂,又有V-O键的形成 |
| B.该反应的中间产物是V2O5 |
| C.反应①的活化能比反应②大 |
| D.反应放热,为提高SO2转化率,应尽可能在较低温度下反应 |
您最近一年使用:0次
2 . 下列关于物质分类的说法正确的是
| A.纯碱、烧碱都属于碱 |
| B.冰水混合物属于纯净物 |
| C.凡能电离出H+的化合物都属于酸 |
| D.盐类物质一定含有金属阳离子和酸根离子 |
您最近一年使用:0次
2024-04-07更新
|
170次组卷
|
2卷引用:海南省海口观澜湖华侨学校2023-2024学年高一上学期11月期中考试化学试题
3 . 现有A、B、C、D、E、F、G、H8种元素,均为前四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答有关问题。
(1) 的电子式为
的电子式为________ 。(A、C为字母代号,请将字母代号用元素符号表示,下同)。
(2)B元素基态原子中能量最高的电子所占据的原子轨道呈________ 形。
(3)E元素基态原子的核外价电子轨道表示式为________ ,该元素的 远远大于
远远大于 ,其原因是
,其原因是________ 。
(4)D、E、F三种元素的简单离子半径由大到小的顺序是________________ 。
(5)G的最高价氧化物对应的水化物与E的氧化物反应的离子方程式________________________ 。
(6)H位于元素周期表中________ 区(按电子排布分区)。
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素是形成化合物种类最多的元素 |
| C元素基态原子的核外p能级电子数比s能级电子数少1 |
| D元素基态原子的核外p轨道中有两个未成对电子 |
E元素的气态基态原子的第一至第四电离能分别是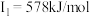 , ,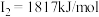 , ,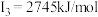 , ,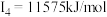 |
| F元素的主族序数与周期数的差为4 |
| G元素是前四周期中电负性最小的元素 |
| H元素位于元素周期表中的第8列 |
 的电子式为
的电子式为(2)B元素基态原子中能量最高的电子所占据的原子轨道呈
(3)E元素基态原子的核外价电子轨道表示式为
 远远大于
远远大于 ,其原因是
,其原因是(4)D、E、F三种元素的简单离子半径由大到小的顺序是
(5)G的最高价氧化物对应的水化物与E的氧化物反应的离子方程式
(6)H位于元素周期表中
您最近一年使用:0次
4 . 热化学方程式是一种能够表明反应释放或吸收热量的热化学方程式。
(1)已知:①CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-846.3kJ·mol-1
②CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=+2.8kJ·mol-1
③2CO(g)+O2(g)=2CO2(g) ΔH=-566.0kJ·mol-1
反应CO2(g)+CH4(g)=2CO(g)+2H2(g)的ΔH=_____ 。
(2)已知下列反应的反应热:
①CH3COOH(1)+2O2(g)=2CO2(g)+2H2O(1) ΔH=-870.3kJ/mol
②C(s)+O2(g)=CO2(g) ΔH=-393.5kJ/mol
③2C(s)+2H2(g)+O2(g)=CH3COOH(1) ΔH=-488.3kJ/mol
请写出H2燃烧热的热化学方程式_____ 。
(3)在101kPa下,CH4(g)、H2(g)、C(s)的燃烧热分别为890.3kJ/mol、285.8kJ/mol和393.5kJ/mol,则CH4(g)分解为H2(g)、C(s)的热化学方程式_____ 。
(1)已知:①CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-846.3kJ·mol-1
②CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=+2.8kJ·mol-1
③2CO(g)+O2(g)=2CO2(g) ΔH=-566.0kJ·mol-1
反应CO2(g)+CH4(g)=2CO(g)+2H2(g)的ΔH=
(2)已知下列反应的反应热:
①CH3COOH(1)+2O2(g)=2CO2(g)+2H2O(1) ΔH=-870.3kJ/mol
②C(s)+O2(g)=CO2(g) ΔH=-393.5kJ/mol
③2C(s)+2H2(g)+O2(g)=CH3COOH(1) ΔH=-488.3kJ/mol
请写出H2燃烧热的热化学方程式
(3)在101kPa下,CH4(g)、H2(g)、C(s)的燃烧热分别为890.3kJ/mol、285.8kJ/mol和393.5kJ/mol,则CH4(g)分解为H2(g)、C(s)的热化学方程式
您最近一年使用:0次
解题方法
5 . 已知乙醇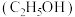 能与
能与 和
和 的混合溶液在一定条件下发生反应:
的混合溶液在一定条件下发生反应: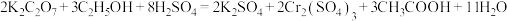 ,
, 和
和 在溶液中分别显橙色和绿色,回答下列问题:
在溶液中分别显橙色和绿色,回答下列问题:
(1)该反应现象是___________ 。
(2)该反应___________ (填“是”或“不是”)氧化还原反应,判断的依据是___________ 。
(3)你认为能否用这一反应来检测司机是否酒后驾车?___________ (填“能”或“不能”),简述其原理:___________ 。
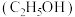 能与
能与 和
和 的混合溶液在一定条件下发生反应:
的混合溶液在一定条件下发生反应: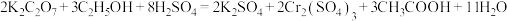 ,
, 和
和 在溶液中分别显橙色和绿色,回答下列问题:
在溶液中分别显橙色和绿色,回答下列问题:(1)该反应现象是
(2)该反应
(3)你认为能否用这一反应来检测司机是否酒后驾车?
您最近一年使用:0次
6 . 实验室中可用MnO2或KMnO4固体制备氯气,反应的化学方程式如下:
①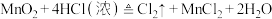
②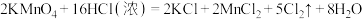
回答下列问题:
(1)对比反应①和②的反应原理,下列作为反应②的发生装置的是_______ (填字母序号)。

(2)反应①和②中,浓盐酸均体现出_______ 性和_______ 性。
(3)用双线桥法,标出下列反应中的电子转移情况_______ 。
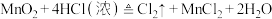
(4)若反应②在水溶液中进行,将反应②改写成离子方程式_______ 。
(5)化学实验中经常提到“酸性高锰酸钾溶液”,这里的“酸性”是因为配制高锰酸钾溶液时加入了_______ (填“硫酸”或“盐酸”)的缘故。
(6)1868年狄肯和洪特发明了用氯化铜作催化剂,在加热到450℃时,用空气中的氧气来氧化氯化氢气体制取氯气的方法——地康法。根据信息,写出该反应的化学方程式_______ 。
①
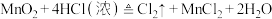
②
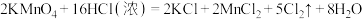
回答下列问题:
(1)对比反应①和②的反应原理,下列作为反应②的发生装置的是

(2)反应①和②中,浓盐酸均体现出
(3)用双线桥法,标出下列反应中的电子转移情况
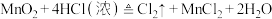
(4)若反应②在水溶液中进行,将反应②改写成离子方程式
(5)化学实验中经常提到“酸性高锰酸钾溶液”,这里的“酸性”是因为配制高锰酸钾溶液时加入了
(6)1868年狄肯和洪特发明了用氯化铜作催化剂,在加热到450℃时,用空气中的氧气来氧化氯化氢气体制取氯气的方法——地康法。根据信息,写出该反应的化学方程式
您最近一年使用:0次
7 . 能正确表示下列反应的离子方程式为
A.向 溶液中通入过量 溶液中通入过量 : : |
B.食醋去除水垢中的 : :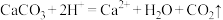 |
C.向碳酸钠溶液中通入少量 : : |
D.次磷酸(一元弱酸)与足量NaOH溶液反应: |
您最近一年使用:0次
2024-04-03更新
|
63次组卷
|
2卷引用:海南省华东师范大学第二附属中学乐东黄流中学2023-2024学年高一上学期11月期中化学试题
解题方法
8 . 下列实验装置可用于实验室制备少量无水 ,已知
,已知 遇水会强烈反应。
遇水会强烈反应。
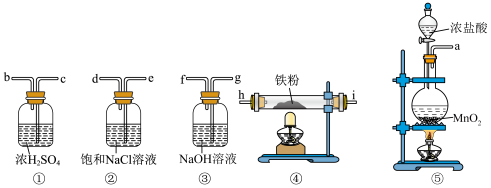
(1)装置⑤装有浓盐酸的仪器名称为_______ ,装有 的仪器名称为
的仪器名称为_______ 。
(2)为达到实验目的,各装置的正确连接顺序是:
__________ 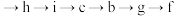 (填接口的字母,箭头的方向即气流的方向,部分装置可重复使用)。
(填接口的字母,箭头的方向即气流的方向,部分装置可重复使用)。
(3)请写出装置⑤中制备氯气的离子方程式_______ 。
(4)装置②的作用_______ 。
(5)请写出④制备 的化学方程式
的化学方程式_______ 。
(6)用离子方程式表示③的作用_______ 。
(7)本实验装置④⑤两处均有酒精灯,实验开始前应先点燃_______ (填装置序号)处酒精灯,后点燃_______ (填装置序号)处酒精灯。
(8)①装置前后两次使用,第1次使用时①装置的作用为_______ ,第2次使用时①装置的作用为_______ 。
 ,已知
,已知 遇水会强烈反应。
遇水会强烈反应。
(1)装置⑤装有浓盐酸的仪器名称为
 的仪器名称为
的仪器名称为(2)为达到实验目的,各装置的正确连接顺序是:

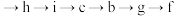 (填接口的字母,箭头的方向即气流的方向,部分装置可重复使用)。
(填接口的字母,箭头的方向即气流的方向,部分装置可重复使用)。(3)请写出装置⑤中制备氯气的离子方程式
(4)装置②的作用
(5)请写出④制备
 的化学方程式
的化学方程式(6)用离子方程式表示③的作用
(7)本实验装置④⑤两处均有酒精灯,实验开始前应先点燃
(8)①装置前后两次使用,第1次使用时①装置的作用为
您最近一年使用:0次
9 . 甲醇、乙烯都是重要的有机化工原料,工业上可利用 和
和 在催化剂作用下合成,发生的主要反应有:
在催化剂作用下合成,发生的主要反应有:
ⅰ.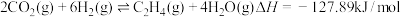
ⅱ.
ⅲ.
(1)上述反应ⅲ中的活化能
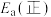
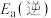 (填“>”或“<”),该反应应选择
(填“>”或“<”),该反应应选择(2)不同压强下
 的平衡转化率与温度的关系如图:
的平衡转化率与温度的关系如图: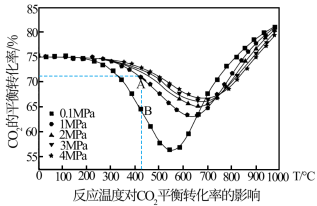
①如图B点
 (填“>”“<”或“=”),在B点给定的温度和压强下,提高
(填“>”“<”或“=”),在B点给定的温度和压强下,提高 平衡转化率的方法有
平衡转化率的方法有
②在恒定压强下,随着温度的升高, 的平衡转化率先降低后升高。表明在较低温度下体系中合成低碳烯烃时
的平衡转化率先降低后升高。表明在较低温度下体系中合成低碳烯烃时
③在较高温度如850℃时, 的平衡转化率随着压强的升高而减小的原因是
的平衡转化率随着压强的升高而减小的原因是
a.温度300~400℃ b.温度900~1000℃ c压强0.1~1.0MPa d.压强2.0~3.0MPa
您最近一年使用:0次
解题方法
10 . 某工业原料主要成分是 、
、 和
和 。利用此原料可以得到多种工业产品。分析下面流程,回答问题。
。利用此原料可以得到多种工业产品。分析下面流程,回答问题。
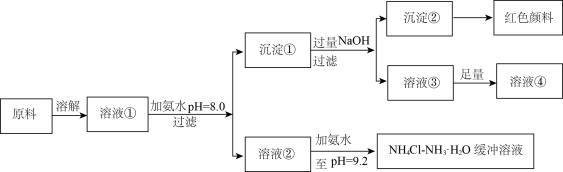
已知: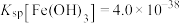
(1)用稀硫酸中和等体积等
 值的氨水和烧碱溶液,前者消耗的酸液体积
值的氨水和烧碱溶液,前者消耗的酸液体积(2)计算溶液②中
 的物质的量浓度为
的物质的量浓度为(3)缓冲溶液中存在的平衡体系有:(Ⅰ)
 ;此时溶液中
;此时溶液中
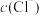 (填>、=、<)。
(填>、=、<)。(4)在缓冲溶液中加入少量盐酸或者NaOH溶液,溶液的pH值几乎依然为9.2。简述原理:
您最近一年使用:0次



