1 . 对石油开采和炼制过程中产生的含硫废水(其中硫元素的主要化合价是―2价)进行处理,防止污染环境。
已知:ⅰ.―2价硫元素易被氧化为S或 ;
;
ⅱ.常温下, 、
、 、
、 等含硫微粒在水溶液中的物质的量分数随pH的分布曲线如图。
等含硫微粒在水溶液中的物质的量分数随pH的分布曲线如图。
向pH≈10的含硫废水中加入适量 溶液,产生黑色沉淀且溶液的pH降低。
溶液,产生黑色沉淀且溶液的pH降低。
①pH≈10的含硫废水中含―2价硫元素的主要存在形式是___________ (填化学式)。
②用化学平衡移动原理解释pH降低的原因:___________ 。
③初始pH≈10时,除硫效果最好,初始pH>10,硫的沉淀率开始降低,原因是___________ 。
(2)常温下,氧化法处理含硫废水
向含硫废水中加入稀 并调节溶液的pH时为6。
并调节溶液的pH时为6。
①根据电离常数计算溶液中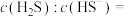
___________ 。
②向废水中匀速加入足量 的
的 溶液,溶液的pH随时间变化如图。10min后pH减小的原因是
溶液,溶液的pH随时间变化如图。10min后pH减小的原因是___________ (用化学方程式和必要的文字描述)。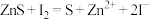 、
、
①向浊液2中滴加 溶液至滴定终点的现象为
溶液至滴定终点的现象为___________ 。
②处理后的废水中―2价硫元素的含量是___________  。
。
已知:ⅰ.―2价硫元素易被氧化为S或
 ;
;ⅱ.常温下,
 、
、 、
、 等含硫微粒在水溶液中的物质的量分数随pH的分布曲线如图。
等含硫微粒在水溶液中的物质的量分数随pH的分布曲线如图。
向pH≈10的含硫废水中加入适量
 溶液,产生黑色沉淀且溶液的pH降低。
溶液,产生黑色沉淀且溶液的pH降低。①pH≈10的含硫废水中含―2价硫元素的主要存在形式是
②用化学平衡移动原理解释pH降低的原因:
③初始pH≈10时,除硫效果最好,初始pH>10,硫的沉淀率开始降低,原因是
(2)常温下,氧化法处理含硫废水
向含硫废水中加入稀
 并调节溶液的pH时为6。
并调节溶液的pH时为6。①根据电离常数计算溶液中
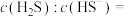
②向废水中匀速加入足量
 的
的 溶液,溶液的pH随时间变化如图。10min后pH减小的原因是
溶液,溶液的pH随时间变化如图。10min后pH减小的原因是

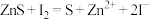 、
、
①向浊液2中滴加
 溶液至滴定终点的现象为
溶液至滴定终点的现象为②处理后的废水中―2价硫元素的含量是
 。
。
您最近一年使用:0次
2024-09-14更新
|
36次组卷
|
3卷引用:黑龙江省齐齐哈尔市龙西北高中名校联盟2023-2024学年高三上学期期末联合考试化学试卷
名校
2 . 下列离子方程式不正确的是
A.NaHCO3与NaOH溶液反应: +OH-= +OH-= +H2O +H2O |
| B.氢氧化铜溶液与硫酸反应:OH-+H+=H2O |
C.氯化铁溶液中加入足量的氨水:Fe3++3NH3·H2O=Fe(OH)3 ↓+3 |
D.盛放碱性试剂的溶液不能用玻璃塞的原因:SiO2+2OH-= +H2O +H2O |
您最近一年使用:0次
解题方法
3 . 锶的化合物应用广泛, 可用于陶瓷工业。以天青石精矿(主要含有
可用于陶瓷工业。以天青石精矿(主要含有 ,还含有少量
,还含有少量 )为原料制备高纯
)为原料制备高纯 的工艺流程如下:
的工艺流程如下:
② 、
、 溶解度随温度变化关系如图所示。
溶解度随温度变化关系如图所示。
(1)“转化”中维持反应温度40℃, 转化为
转化为 ,
, 完全转化为
完全转化为 ,其中生成
,其中生成 的离子方程式为
的离子方程式为___________ ;过程中需要控制氨水过量的主要原因是___________ 。
(2)固相经过充分“煅烧”后,所得固体成分除了“转化”过程剩余的少量 外,还有
外,还有___________ 。
(3)“浸取”时控制水温为80℃的原因是___________ 。
(4)“浸取”后趁热过滤,维持温度80℃进行“沉淀”操作,主要发生反应的化学方程式为___________ ;该温度下,100mL溶液中最多溶解 的质量为
的质量为 ,若“沉淀”后的滤液中
,若“沉淀”后的滤液中 ,则
,则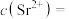
___________  (用含a的算式表示)。
(用含a的算式表示)。
(5)工业上还可以在空气中氧化煅烧锶的硫化物(SrS、 )的方法制取
)的方法制取 。
。
① 中锶元素的化合价为
中锶元素的化合价为___________ 。
②氧化煅烧锶的硫化物制取 时有刺激性气味的气体生成,若反应物中
时有刺激性气味的气体生成,若反应物中 和SrS物质的量之比为1∶1,该反应的化学方程式为
和SrS物质的量之比为1∶1,该反应的化学方程式为___________ 。
 可用于陶瓷工业。以天青石精矿(主要含有
可用于陶瓷工业。以天青石精矿(主要含有 ,还含有少量
,还含有少量 )为原料制备高纯
)为原料制备高纯 的工艺流程如下:
的工艺流程如下:
②
 、
、 溶解度随温度变化关系如图所示。
溶解度随温度变化关系如图所示。
(1)“转化”中维持反应温度40℃,
 转化为
转化为 ,
, 完全转化为
完全转化为 ,其中生成
,其中生成 的离子方程式为
的离子方程式为(2)固相经过充分“煅烧”后,所得固体成分除了“转化”过程剩余的少量
 外,还有
外,还有(3)“浸取”时控制水温为80℃的原因是
(4)“浸取”后趁热过滤,维持温度80℃进行“沉淀”操作,主要发生反应的化学方程式为
 的质量为
的质量为 ,若“沉淀”后的滤液中
,若“沉淀”后的滤液中 ,则
,则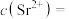
 (用含a的算式表示)。
(用含a的算式表示)。(5)工业上还可以在空气中氧化煅烧锶的硫化物(SrS、
 )的方法制取
)的方法制取 。
。①
 中锶元素的化合价为
中锶元素的化合价为②氧化煅烧锶的硫化物制取
 时有刺激性气味的气体生成,若反应物中
时有刺激性气味的气体生成,若反应物中 和SrS物质的量之比为1∶1,该反应的化学方程式为
和SrS物质的量之比为1∶1,该反应的化学方程式为
您最近一年使用:0次
名校
解题方法
4 . 按照要求回答下列问题:
(1)下列物质:①铁片 ②液态的HCl ③蔗糖 ④酒精 ⑤稀盐酸 ⑥H2SO4 ⑦KOH ⑧熔融状态的KNO3 ⑨O2 ⑩BaSO4固体。
(a)以上物质中能导电的是_______ 。(填序号,下同)
(b)以上物质中属于电解质的是_______ 。
(c)以上物质中属于非电解质的是_______ 。
(2)取少量Fe2O3粉末(红棕色)加入适量盐酸,得到黄色溶液,用此溶液进行以下实验:
(a)在小烧杯中加入20mL蒸馏水,加热至沸腾后,向沸水中加入制取的黄色溶液2mL,继续煮沸至液体呈_______ 色,停止加热,用激光笔照射烧杯中的液体,可以观察到液体中_______ 。
(b)氢氧化铁胶体制备的化学方程式为_______ 。
(c)向烧杯中逐滴加入过量的盐酸,会出现一系列变化:现象为_______ ,原因是(用离子方程式表示)_______ 。
(d)氢氧化铁胶体稳定存在的主要原因是_______ 。
(3)某温度下将Cl2通入KOH溶液里,反应后得到KCl、KClO、KClO3的混合溶液,经测定ClO﹣与ClO 的个数比为11:1,则Cl2与KOH反应时,被还原的氯元素和被氧化的氯元素个数之比为
的个数比为11:1,则Cl2与KOH反应时,被还原的氯元素和被氧化的氯元素个数之比为_______ 。
(4)铜器久置于空气中会和空气中的水蒸气、CO2、O2作用产生“绿锈”,该“绿锈”俗称“铜绿”,又称“孔雀石”[化学式为Cu2(OH)2CO3],“铜绿”能跟酸反应生成铜盐和CO2、H2O。某同学利用下述系列反应实现了“铜→铜绿→…→铜”的转化。
铜 铜绿
铜绿 A
A Cu(OH)2
Cu(OH)2 B
B Cu
Cu
(a)从三种不同分类标准回答,“铜绿”属于哪类物质?_______ 。
(b)写出B的化学式_______ 。
(c)上述转化过程中属于置换反应的是_______ (填序号)。
(d)写出②反应的化学方程式:_______ 。
(5)下列方程式中G、Q、X、Y、Z均为含氯元素的物质,它们之间存在如下反应:
(a)Y+NaOH→G+Q+H2O;(b)G→Q+NaCl;(c)Q+H2O→X+H2;(d)Z+NaOH→Q+X+H2O。
试推断五种物质中氯元素的化合价由低到高的顺序为_______ 。
(1)下列物质:①铁片 ②液态的HCl ③蔗糖 ④酒精 ⑤稀盐酸 ⑥H2SO4 ⑦KOH ⑧熔融状态的KNO3 ⑨O2 ⑩BaSO4固体。
(a)以上物质中能导电的是
(b)以上物质中属于电解质的是
(c)以上物质中属于非电解质的是
(2)取少量Fe2O3粉末(红棕色)加入适量盐酸,得到黄色溶液,用此溶液进行以下实验:
(a)在小烧杯中加入20mL蒸馏水,加热至沸腾后,向沸水中加入制取的黄色溶液2mL,继续煮沸至液体呈
(b)氢氧化铁胶体制备的化学方程式为
(c)向烧杯中逐滴加入过量的盐酸,会出现一系列变化:现象为
(d)氢氧化铁胶体稳定存在的主要原因是
(3)某温度下将Cl2通入KOH溶液里,反应后得到KCl、KClO、KClO3的混合溶液,经测定ClO﹣与ClO
 的个数比为11:1,则Cl2与KOH反应时,被还原的氯元素和被氧化的氯元素个数之比为
的个数比为11:1,则Cl2与KOH反应时,被还原的氯元素和被氧化的氯元素个数之比为(4)铜器久置于空气中会和空气中的水蒸气、CO2、O2作用产生“绿锈”,该“绿锈”俗称“铜绿”,又称“孔雀石”[化学式为Cu2(OH)2CO3],“铜绿”能跟酸反应生成铜盐和CO2、H2O。某同学利用下述系列反应实现了“铜→铜绿→…→铜”的转化。
铜
 铜绿
铜绿 A
A Cu(OH)2
Cu(OH)2 B
B Cu
Cu(a)从三种不同分类标准回答,“铜绿”属于哪类物质?
(b)写出B的化学式
(c)上述转化过程中属于置换反应的是
(d)写出②反应的化学方程式:
(5)下列方程式中G、Q、X、Y、Z均为含氯元素的物质,它们之间存在如下反应:
(a)Y+NaOH→G+Q+H2O;(b)G→Q+NaCl;(c)Q+H2O→X+H2;(d)Z+NaOH→Q+X+H2O。
试推断五种物质中氯元素的化合价由低到高的顺序为
您最近一年使用:0次
2024-09-03更新
|
411次组卷
|
2卷引用: 黑龙江省鹤岗市第一中学2023-2024学年高一上学期第一次月考 (9月)化学试题
5 . 下列实验装置及现象正确的
|
|
| 图甲 | 图乙 |
|
|
| 图丙 | 图丁 |
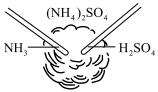
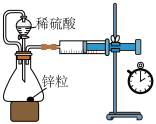
| A.图甲:浓氨水与浓硫酸反应 | B.图乙:测量锌与稀硫酸反应的反应速率 |
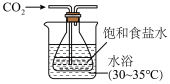
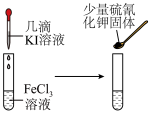
C.图丙:用图丙装置制备 晶体 晶体 | D.图丁:验证 与 与 的反应是可逆反应 的反应是可逆反应 |
您最近一年使用:0次
6 . 磷能形成次磷酸 、亚磷酸
、亚磷酸 等多种含氧酸。回答下列问题:
等多种含氧酸。回答下列问题:
(1) 是一元中强酸,其中磷元素的化合价为
是一元中强酸,其中磷元素的化合价为_______ ,写出其电离方程式:_______ 。
(2) 是
是_______ (填“正盐”或“酸式盐”),其溶液中离子浓度由大到小的顺序为_______ ;室温下 的
的 溶液和
溶液和 的
的 溶液,
溶液, 更大的是
更大的是_______ [已知 时,
时,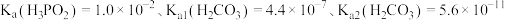 ]。
]。
(3)已知亚磷酸 是二元中强酸,
是二元中强酸, 时,
时,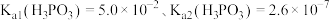 。向
。向 溶液中滴加
溶液中滴加 溶液:
溶液:
①当恰好中和生成 时,所得溶液的
时,所得溶液的
_______ 7(填“>”“<”或“=”,下同)。
②当溶液呈中性时,所得溶液中
_______  。
。
 、亚磷酸
、亚磷酸 等多种含氧酸。回答下列问题:
等多种含氧酸。回答下列问题:(1)
 是一元中强酸,其中磷元素的化合价为
是一元中强酸,其中磷元素的化合价为(2)
 是
是 的
的 溶液和
溶液和 的
的 溶液,
溶液, 更大的是
更大的是 时,
时,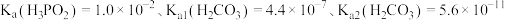 ]。
]。(3)已知亚磷酸
 是二元中强酸,
是二元中强酸, 时,
时,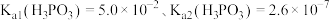 。向
。向 溶液中滴加
溶液中滴加 溶液:
溶液:①当恰好中和生成
 时,所得溶液的
时,所得溶液的
②当溶液呈中性时,所得溶液中

 。
。
您最近一年使用:0次
解题方法
7 . 氯化铬晶体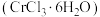 是一种重要的工业原料,
是一种重要的工业原料, 不溶于乙醚,易溶于水、乙醇,易水解。以高铝铬铁矿(主要含
不溶于乙醚,易溶于水、乙醇,易水解。以高铝铬铁矿(主要含 和
和 ,还含
,还含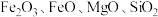 )为原料制氯化铬晶体的工艺流程如下。
)为原料制氯化铬晶体的工艺流程如下。 :
:
回答下列问题:
(1)为了提高铬的浸取率,“酸浸”时可采取措施有_______ (任写两种即可)。
(2)“氧化”的目的是将溶液中的 转化为
转化为 ,试剂X可选用
,试剂X可选用 ,写出
,写出 氧化
氧化 的离子方程式:
的离子方程式:_______ 。
(3)“滤渣2”的主要成分为_______ 。第二次加氨水调节 的范围是
的范围是_______ ;加稀盐酸中和前,需要洗涤沉淀,证明沉淀洗涤干净的操作方法是_______ 。
(4)写出“滤渣3”用稀盐酸“中和”的离子方程式:_______ ;请将“一系列操作”补充完整:将过滤后所得的洁净固体完全溶解于过量的盐酸中,蒸发浓缩,_______ ,过滤,_______ ,低温干燥,得到 (实验中可供选择的试剂:盐酸、硫酸、蒸馏水、乙醇、乙醚)。
(实验中可供选择的试剂:盐酸、硫酸、蒸馏水、乙醇、乙醚)。
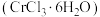 是一种重要的工业原料,
是一种重要的工业原料, 不溶于乙醚,易溶于水、乙醇,易水解。以高铝铬铁矿(主要含
不溶于乙醚,易溶于水、乙醇,易水解。以高铝铬铁矿(主要含 和
和 ,还含
,还含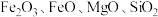 )为原料制氯化铬晶体的工艺流程如下。
)为原料制氯化铬晶体的工艺流程如下。
 :
:金属离子 |
|
|
|
|
|
开始沉淀的 | 2.3 | 10.4 | 4.9 | 7.5 | 3.4 |
沉淀完全的 | 4.1 | 12.4 | 6.8 | 9.7 | 4.7 |
(1)为了提高铬的浸取率,“酸浸”时可采取措施有
(2)“氧化”的目的是将溶液中的
 转化为
转化为 ,试剂X可选用
,试剂X可选用 ,写出
,写出 氧化
氧化 的离子方程式:
的离子方程式:(3)“滤渣2”的主要成分为
 的范围是
的范围是(4)写出“滤渣3”用稀盐酸“中和”的离子方程式:
 (实验中可供选择的试剂:盐酸、硫酸、蒸馏水、乙醇、乙醚)。
(实验中可供选择的试剂:盐酸、硫酸、蒸馏水、乙醇、乙醚)。
您最近一年使用:0次
解题方法
8 . 亚硝酸钠 是一种白色结晶性粉末,易溶于水,微溶于乙醇,主要用于制造偶氮染料,也可用作织物染色的媒染剂、漂白剂、金属热处理剂。某学习小组设计如图装置制备亚硝酸钠(夹持装置、加热装置已省略)。
是一种白色结晶性粉末,易溶于水,微溶于乙醇,主要用于制造偶氮染料,也可用作织物染色的媒染剂、漂白剂、金属热处理剂。某学习小组设计如图装置制备亚硝酸钠(夹持装置、加热装置已省略)。 ;
; 在空气中慢慢氧化为
在空气中慢慢氧化为 。
。
回答下列问题:
(1)仪器X的名称为_______ ,装置A中反应的化学方程式为_______ 。
(2)装置B中 的作用是
的作用是_______ (用离子方程式表示)。
(3)装置C中U型管中盛放的试剂可能是_______ ,若无装置C时,装置D中生成的杂质主要有_______ (填化学式)。
(4)当装置D中淡黄色固体变为白色时,关闭分液漏斗活塞,停止加热,打开弹簧夹,通入 一段时间,请简述通入
一段时间,请简述通入 的目的:
的目的:_______ 。
(5)检测产物中 的含量:称取装置D中固体
的含量:称取装置D中固体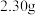 ,完全溶解配制成溶液
,完全溶解配制成溶液 ,取出
,取出 溶液用
溶液用 酸性
酸性 溶液进行滴定(设杂质不与
溶液进行滴定(设杂质不与 反应),三次滴定平均消耗
反应),三次滴定平均消耗 溶液
溶液 ,则样品中
,则样品中 的质量分数为
的质量分数为_______ (结果保留一位小数)。
 是一种白色结晶性粉末,易溶于水,微溶于乙醇,主要用于制造偶氮染料,也可用作织物染色的媒染剂、漂白剂、金属热处理剂。某学习小组设计如图装置制备亚硝酸钠(夹持装置、加热装置已省略)。
是一种白色结晶性粉末,易溶于水,微溶于乙醇,主要用于制造偶氮染料,也可用作织物染色的媒染剂、漂白剂、金属热处理剂。某学习小组设计如图装置制备亚硝酸钠(夹持装置、加热装置已省略)。
 ;
; 在空气中慢慢氧化为
在空气中慢慢氧化为 。
。回答下列问题:
(1)仪器X的名称为
(2)装置B中
 的作用是
的作用是(3)装置C中U型管中盛放的试剂可能是
(4)当装置D中淡黄色固体变为白色时,关闭分液漏斗活塞,停止加热,打开弹簧夹,通入
 一段时间,请简述通入
一段时间,请简述通入 的目的:
的目的:(5)检测产物中
 的含量:称取装置D中固体
的含量:称取装置D中固体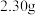 ,完全溶解配制成溶液
,完全溶解配制成溶液 ,取出
,取出 溶液用
溶液用 酸性
酸性 溶液进行滴定(设杂质不与
溶液进行滴定(设杂质不与 反应),三次滴定平均消耗
反应),三次滴定平均消耗 溶液
溶液 ,则样品中
,则样品中 的质量分数为
的质量分数为
您最近一年使用:0次
解题方法
9 . 室温下,用 的
的 溶液滴定
溶液滴定 溶液,测得混合溶液的
溶液,测得混合溶液的 与
与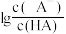 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是
 的
的 溶液滴定
溶液滴定 溶液,测得混合溶液的
溶液,测得混合溶液的 与
与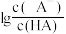 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是
A. 为弱酸,室温下 为弱酸,室温下 的数量级为 的数量级为 |
B.b点消耗 溶液的体积等于 溶液的体积等于 |
C.c点坐标中, |
D.当消耗V( 溶液) 溶液) 时,溶液中存在 时,溶液中存在 |
您最近一年使用:0次
10 . 某工业废水中残留较高浓度的 和
和 ,利用四室电解池可对废水进行脱盐净化,装置原理如图所示。下列说法错误的是
,利用四室电解池可对废水进行脱盐净化,装置原理如图所示。下列说法错误的是
 和
和 ,利用四室电解池可对废水进行脱盐净化,装置原理如图所示。下列说法错误的是
,利用四室电解池可对废水进行脱盐净化,装置原理如图所示。下列说法错误的是
| A.甲极的电势高于乙极的电势 |
B.若电路中通过 电子,Ⅳ室增重 电子,Ⅳ室增重 |
| C.Ⅱ室可得较高浓度的硫酸和盐酸混合液 |
D.Ⅰ室的电极反应式为 |
您最近一年使用:0次